Хеликобактер пилори суммарные антитела (IgM, IgА, IgG) к антигену CagA
Описание
Хеликобактер пилори (H. pylori) — спиралевидная или палочковидная бактерия, она поселяется на слизистых оболочках желудка и двенадцатиперстной кишки человека, приводит к повреждению слизистых и вызывает воспалительные заболевания.
Заражение происходит от больного человека или носителя инфекции. Хеликобактер пилори передается фекально-оральным или орально-оральным путем при нарушении правил гигиены, через воду, пищу, загрязненные предметы, часты семейные случаи инфицирования. Хеликобактер пилори имеет большую распространенность во всем мире.
Хеликобактер пилори может приводить к развитию гастрита, язвенной болезни желудка и двенадцатиперстной кишки, ассоциируется с повышенным риском развития рака желудка.
Как можно установить инфицирование Хеликобактер пилори
Методы лабораторной диагностики делятся на прямые и косвенные.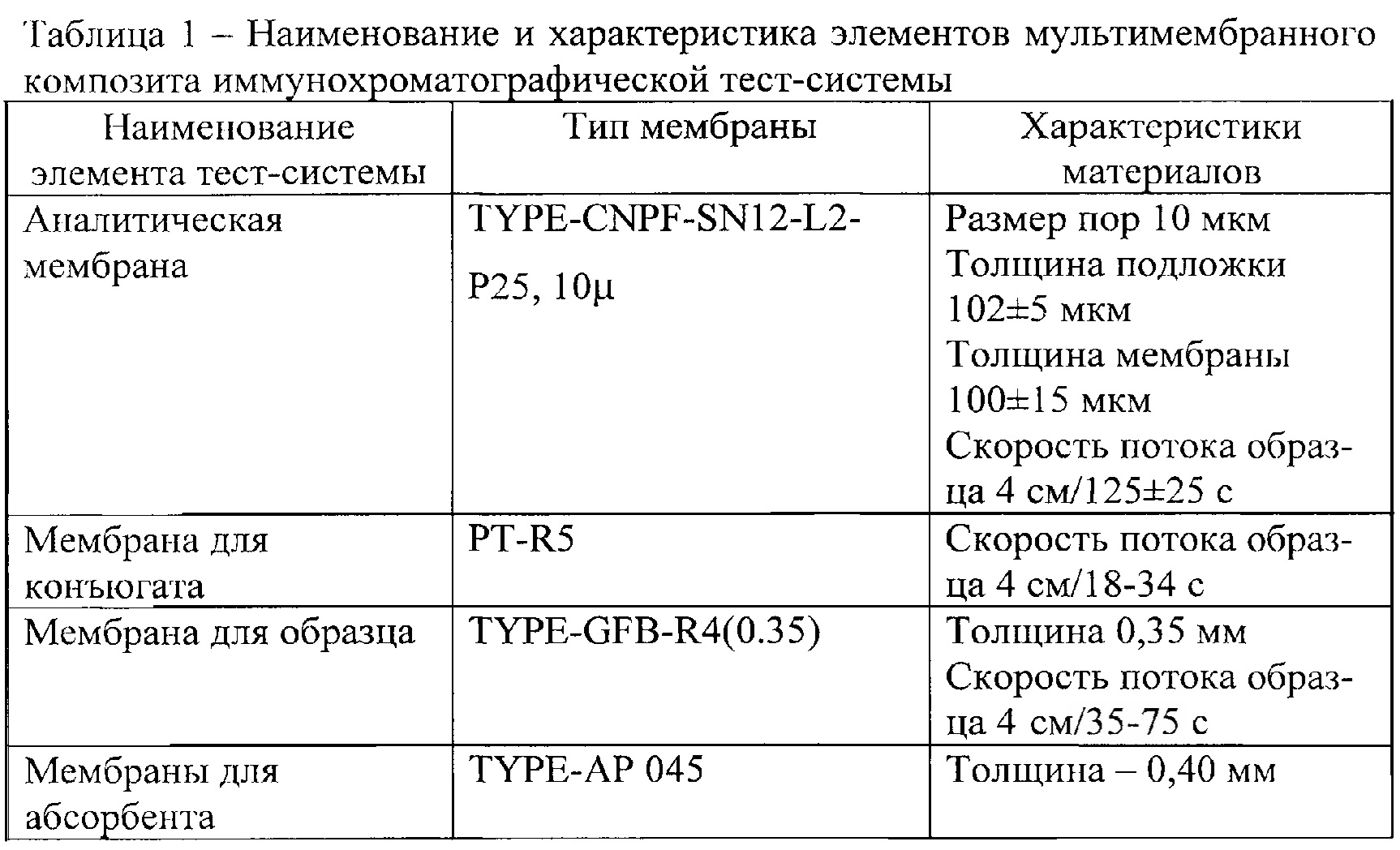
Прямые – методы определения самого возбудителя или его частиц. Хеликобактер пилори может быть обнаружен на слизистых оболочках желудка или двенадцатиперстной кишки:
- методом микроскопии (при проведении гистологического или цитологического исследования),
- методом культурального исследования (бактериального посева),
- методом полимеразной цепной реакции (ПЦР) определяются участки генетического материала – ДНК бактерии в пробе (при исследовании биоптата слизистых жедудка и двенадцатиперстной кишки, в пробах кала).
Косвенные — методы исследования антител (иммуноглобулинов). Антитела к антигенам (белкам) микроорганизма вырабатываются в ответ на проникновение возбудителя в организм и отражают реакцию организма на инфекцию. Наиболее распространенным методом определения антител является иммуноферментный анализ (ИФА).
Что показывает анализ на суммарные антитела (IgA, IgM, IgG) к антигену CagA Хеликобактер пилори
Иммуноглобулины характеризуют течение инфекции. По мере формирования иммунного ответа к инфекции антитела разных классов сменяют друг друга. Сначала на проникновение чужеродного микроорганизма начитают вырабатываться специфичные к данному возбудителю иммуноглобулины класса М (IgM), позже специфичные иммуноглобулины классов A (IgA) и G (IgG).
По мере формирования иммунного ответа к инфекции антитела разных классов сменяют друг друга. Сначала на проникновение чужеродного микроорганизма начитают вырабатываться специфичные к данному возбудителю иммуноглобулины класса М (IgM), позже специфичные иммуноглобулины классов A (IgA) и G (IgG).
Иммуноглобулины класса М при инфицировании Хеликобактер пилори обнаруживаются в крови первыми, через 5-7 дней от проникновения возбудителя в организм, через 1-2 недели появляются иммуноглобулины класса A, через 3-4 недели антитела класса G. Пока развивается заболевание, уровни антител нарастают, а после выздоровления, снижаются.
Суммарные антитела (IgA, IgM, IgG) определяются весь период заболевания Хеликобактер пилори и длительно сохраняются после выздоровления.
Определение антител является вспомогательным методом диагностики Хеликобактер пилори. Положительный анализ на суммарные антитела может говорить о перенесенной инфекции или о текущей в данный момент. Антитела определяют для наблюдения за динамикой процесса, осуществления контроля за лечением.
Для подтверждения диагноза, в случае обнаружения положительных IgA, IgM, IgG к антигену CagA Хеликобактер пилори, может быть проведено исследование гастробиоптата или кала на выявление Хеликобактер пилори методом ПЦР-анализа.
Кому показано исследование иммуноглобулинов IgA, IgM, IgG к Хеликобактер пилори
- Пациентам с заболеваниями желудка и двенадцатиперстной кишки.
- Членам семей пациентов, инфицированных Хеликобактер пилори.
Результат анализа
Исследование антител являются методом косвенной диагностики инфекции, зависит от состояния иммунной системы человека и особенностей возбудителя. Положительные результаты исследований антител требуют подтверждения прямыми методами диагностики.
Полученный результат анализа обязательно должен интерпретировать лечащий врач с учетом всех данных о состоянии здоровья пациента, комплекса проведенных инструментальных и лабораторных исследований.
Правила подготовки
- Необходимо исключить факторы, влияющие на результаты исследований: физическую нагрузку (бег, подъем по лестнице, подъем тяжестей), тепловые процедуры (посещение бани, сауны), эмоциональное возбуждение.
- Перед забором крови следует отдохнуть 10-15 минут в приемной, успокоиться.
- Исключить прием алкоголя за 1-2 дня до исследования.
- Кровь не следует сдавать после рентгенографии, физиотерапевтических воздействий, после проведения диагностических или лечебных процедур.
- Практически все анализы делают натощак. «Натощак» — это когда между последним приемом пищи и взятием крови проходит не менее 8 ч (желательно — не менее 12 ч). Можно только пить воду. Накануне исследования следует избегать пищевых перегрузок.
- При исследовании крови учитывают влияние принимаемых лекарственных препаратов. Если прием лекарственного средства обязателен и исследование проводится на фоне приема препарата, об этом необходимо делать отметку на направлении
Суммарные антитела (IgA, IgG) к антигену CagA Helicobacter pilori
Количественный анализ антител IgG и IgA к Helicobacter pylori, используемый для диагностики гастрита и язвенной болезни желудка и двенадцатиперстной кишки.
Метод исследования
Иммуноферментный.
Единицы измерения
МЕ/мл (международная единица на миллилитр).
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Helicobacter pylori (H. pylori) – это грамотрицательная спиралевидная бактерия, способная колонизировать слизистую оболочку желудка и двенадцатиперстной кишки и вызывать воспаление.
Инфекция H. pylori (геликобактериоз, хеликобактериоз) очень распространена среди населения. Так, более 50 % людей в возрасте старше 60 лет имеют геликобактериоз. Как правило, заражение H. pylori происходит в детстве и протекает в виде острого гастрита. В большинстве случаев после разрешения симптомов острого гастрита геликобактериоз принимает хроническое течение. Несмотря на то, что хронический гастрит, вызванный H.

Серологические исследования позволяют выявить в крови специфические иммуноглобулины, направленные против H. pylori. Определение антител к H. pylori в крови не требует эндоскопического исследования, поэтому является более безопасным методом диагностики.
Для чего используется исследование?
- Для выявления H. pylori у пациентов с подозрением на гастрит, язву желудка или двенадцатиперстной кишки;
- для косвенной оценки состояния слизистой оболочки желудка («серологическая биопсия»).
Когда назначается исследование?
- При обследовании пациента с признаками диспепсии: дискомфорт или боли в эпигастральной области, тошнота, рвота, быстрая насыщаемость, чувство тяжести в желудке, нарушения аппетита.
Что означают результаты?
Референсные значения
IgA, IgG
Результат: отрицательный.
Что может влиять на результат?
- Время, прошедшее с момента первичного инфицирования: антитела к H.
 pylori определяются через 2-4 недели после заражения;
pylori определяются через 2-4 недели после заражения; - состояние иммунной системы организма человека: ложноотрицательный результат может быть получен у пожилых людей и людей с иммунодефицитом;
- прием антибактериальных препаратов (тетрациклинов, пенициллинов, макролидов и метронидазола) также может приводить к получению ложноотрицательного результата.
Важные замечания
Анализ не является основным способом оценки эффективности лечения / эрадикации H. pylori, но в некоторых случаях может быть использован для этих целей;
результаты исследования оценивают с учетом дополнительных анамнестических, инструментальных и лабораторных данных.
Вопрос: Яна | 10 Апреля, 2021
Здравствуйте, после сдачи пцр теста на ковид, через какое время будет результат? Где и как его можно получить? И есть ли возможность получения результата на английском языке?
Здравствуйте. Результат обследования готов в течение 24 часов (чаще, уже через 12 часов Вам приходит СМС с кодом посещения и ссылкой, пройдя по которой можно увидеть анализа). Печатную версию результата можно получить в нашем филиале, расположенном по адресу 15 микр дом 8 а. Анализ на английском языке выдаем (не забудьте предупредить об этом администратора)
Результат обследования готов в течение 24 часов (чаще, уже через 12 часов Вам приходит СМС с кодом посещения и ссылкой, пройдя по которой можно увидеть анализа). Печатную версию результата можно получить в нашем филиале, расположенном по адресу 15 микр дом 8 а. Анализ на английском языке выдаем (не забудьте предупредить об этом администратора)
Вопрос: Дарья | 07 Апреля, 2021
Добрый день)
Здравствуйте. Из Вашего вопроса непонятно ПЦР на какой вид возбудителя Вам требуется провести. Этот вопрос лучше обсудить с врачом, который рекомендует провести обследование
Хеликобактерная инфекция (Helicobacter pylori) (суммарные антитела классов IgA,IgG, IgM к белку Cag А)
Выполнение данного анализа направлено на выявление суммарных антител Ig A, Ig М, Ig G к антигену Helicobacter pylori в сыворотке крови человека.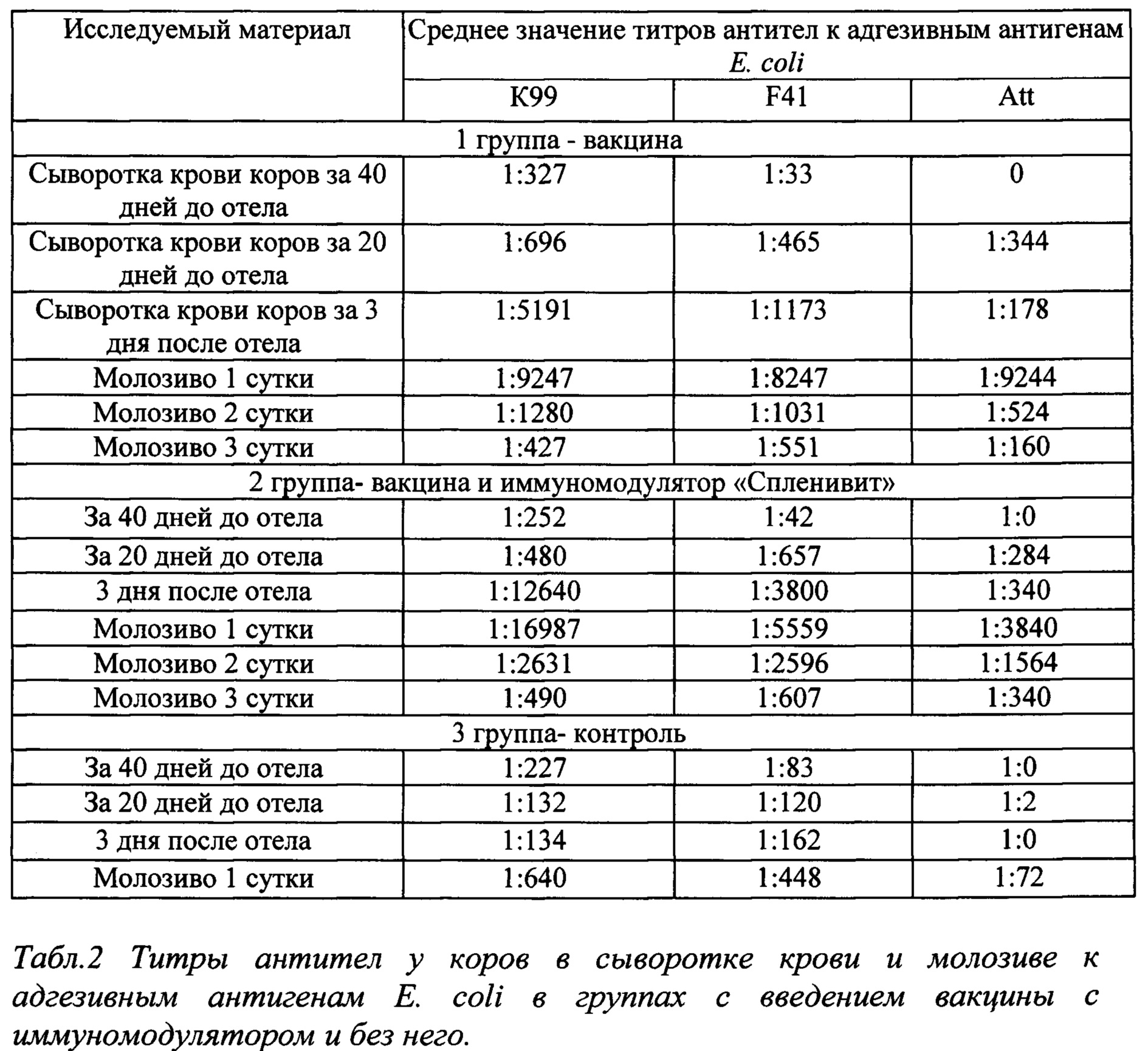 Циркулирующие антитела обычно представлены иммуноглобулинами класса IgG. Антитела класса Ig G начинают вырабатываться через 3-4 недели после инфицирования. Высокие титры антител к H. pylori сохраняются до и некоторое время после ликвидации микроорганизма. Системный IgA ответ обычно менее выражен, но может указывать на более сильное местное воспаление. В редких случаях у инфицированного человека может наблюдаться только IgA ответ.
Циркулирующие антитела обычно представлены иммуноглобулинами класса IgG. Антитела класса Ig G начинают вырабатываться через 3-4 недели после инфицирования. Высокие титры антител к H. pylori сохраняются до и некоторое время после ликвидации микроорганизма. Системный IgA ответ обычно менее выражен, но может указывать на более сильное местное воспаление. В редких случаях у инфицированного человека может наблюдаться только IgA ответ.
Инфекция Helicobacter pylori на сегодняшний день — одна из широко распространенных инфекций на земле. К H. pylori — ассоциированным болезням относятся хронический гастрит, язвенная болезнь желудка и двенадцатиперстной кишки. Поражение слизистой оболочки желудка обусловлено прямым повреждение ее микроорганизмом, а также вторичным повреждением слизистой оболочки желудка, двенадцатиперстной кишки и кардиальной части пищевода под действием факторов агрессии H.pylori. Хеликобактер представляет собой грамотрицательную бактерию спиралевидной формы со жгутиками. Бактериальная клетка окружена слоем геля — гликокаликса, который защищает ее от воздействия соляной кислоты желудочного сока. Хеликобактер чувствителен к действию высоких температур, но длительно сохраняется во влажной среде.
Бактериальная клетка окружена слоем геля — гликокаликса, который защищает ее от воздействия соляной кислоты желудочного сока. Хеликобактер чувствителен к действию высоких температур, но длительно сохраняется во влажной среде.
Заражение происходит пищевым, фекально-оральным, бытовым путями. H.pylori обладает способностью к колонизации и персистированию в слизистой оболочке желудка. Микроорганизм прикрепляется к поверхности эпителия и проникает в клетки. Под действием уреазы и других факторов патогенности повреждается слизистая оболочка, усиливаются воспалительные реакции. Липополисахаридный антиген обладает структурным сходством с антигенами групп крови (по системе Lewis) и клетками желудочного эпителия человека, в результате возможна продукция аутоантител к эпителию слизистой оболочки желудка и развитие атрофического аутоиммунного гастрита.
Обсеменение слизистой оболочки желудка H.pylori сопровождается развитием поверхностного антрального гастрита и дуоденита, ведет к повышению уровня гастрина и снижению выработки соматостатина с последующим усилением секреции соляной кислоты. Избыточное количество соляной кислоты, попадая в просвет двенадцатиперстной кишки, ведет к прогрессированию дуоденита и развитию же-лудочной метаплазии, что создает условия для заселения H.pylori. В дальнейшем, особенно при наличии дополнительных факторов риска (наследственная предрасположенность, I группа крови, курение, частые стрессы), в участках мета-плазированной слизистой оболочки формируется язвенный дефект. В 1995г. Международной ассоциацией по изучению рака H.pylori признан абсолютным канцерогеном и определен как важнейшая причина злокачественных новообразований желудка у человека.
Избыточное количество соляной кислоты, попадая в просвет двенадцатиперстной кишки, ведет к прогрессированию дуоденита и развитию же-лудочной метаплазии, что создает условия для заселения H.pylori. В дальнейшем, особенно при наличии дополнительных факторов риска (наследственная предрасположенность, I группа крови, курение, частые стрессы), в участках мета-плазированной слизистой оболочки формируется язвенный дефект. В 1995г. Международной ассоциацией по изучению рака H.pylori признан абсолютным канцерогеном и определен как важнейшая причина злокачественных новообразований желудка у человека.
Необходимо воздержаться от приема пищи в течение 2-3 часов.
Сдать анализ Антитела к Хеликобактер (Helicobacter pylori) класса IgA
Helicobacter pylori (хеликобактер пилори), IgA, – это специфические иммуноглобулины (иммунные антитела) класса А к бактериям Helicobacter pylori. Тест на Helicobacter pylori, IgA , – лабораторное исследование сыворотки крови методом иммуноферментного анализа, которое проводится в целях выявления инфекции, вызванной Helicobacter pylori, в стенке желудка и двенадцатиперстной кишки на основании титра IgА к этому виду возбудителя. Антитела класса IgA к Helicobacter pylori вырабатываются через 2-3 недели после инфицирования и сохраняются в крови в течение длительного времени. Снижение титра антител IgA говорит о переходе заболевания в латентную фазу, а повышение — об активизации процесса. Иммуноглобулины класса A отвечают за местный иммунитет, и их количество прямо пропорционально степени тяжести воспаления. У небольшой части инфицированных Helicobacter pylori антитела IgA не определяются.
Тест на Helicobacter pylori, IgA , – лабораторное исследование сыворотки крови методом иммуноферментного анализа, которое проводится в целях выявления инфекции, вызванной Helicobacter pylori, в стенке желудка и двенадцатиперстной кишки на основании титра IgА к этому виду возбудителя. Антитела класса IgA к Helicobacter pylori вырабатываются через 2-3 недели после инфицирования и сохраняются в крови в течение длительного времени. Снижение титра антител IgA говорит о переходе заболевания в латентную фазу, а повышение — об активизации процесса. Иммуноглобулины класса A отвечают за местный иммунитет, и их количество прямо пропорционально степени тяжести воспаления. У небольшой части инфицированных Helicobacter pylori антитела IgA не определяются.
Cимптомы гастрита, дуоденита и/или язвенной болезни желудка или двенадцатиперстной кишки: боли, тяжести в верхних отделах живота после еды, тошноте, изжоге, неприятном и/или кислом привкусе во рту и/или запахе изо рта, отрыжке кислым.
Оценка тяжести воспалительного/инфекционного процесса, который вызван хеликобактер пилори.
Оценка адекватности терапевтических мероприятий или их окончательных результатов.
Проведение профилактических осмотров лиц с повышенным риском заболеть гастритом и/или язвенной болезнью желудка в целях принятия мер по предупреждению заболевания
html:Специальная подготовка не требуется.Забор крови для исследования производят не ранее чем через 2 часа после приема пищи.
Перед исследованием (за 1 час) желательно исключить факторы, влияющие на результаты лабораторного исследования: физическое и эмоциональное напряжение, курение.
Рекомендуется за 1-2 дня до предполагаемого исследования не употреблять жирную пищу и алкоголь.
При приеме лекарственных препаратов следует проконсультироваться с врачом по поводу целесообразности проведения исследования на фоне приема препаратов или возможности отмены приема препарата. Длительность отмены препарата определена периодом выведения препарата из крови (в среднем, рекомендуют выждать 4-5 периодов полувыведения препарата, указанного в аннотации).
Если отменить прием лекарств нельзя, необходимо проинформировать об этом лабораторию.
Детей до 5 лет перед забором крови обязательно поить кипяченой водой (порциями, до 150-200 ml, на протяжении 30 минут)
Внимание!
В соответствии с Федеральным законом ФЗ № 323 «Об основах защиты здоровья граждан в Российской Федерации» интерпретация результатов исследований, установление диагноза, назначение лечения, должны производиться врачом соответствующей специализации.
Телефон отделения: +7 (495) 695-56-95
Хеликобактер Пилори ( H.Pilory) суммарные антитела
Helicobacter pylori (хеликобактер пилори) мелкие подвижные неспорообразующие грам-отрицательные бактерии, вызывающие язвенную болезнь желудка и двенадцатиперстной кишки, гастродуоденит, хронический гастрит, рак желудка.
Все перечисленные заболевания возникают в результате инфицирования Helicobacter pylori слизистой желудка, при котором нарушается целостность его эпителиального слоя.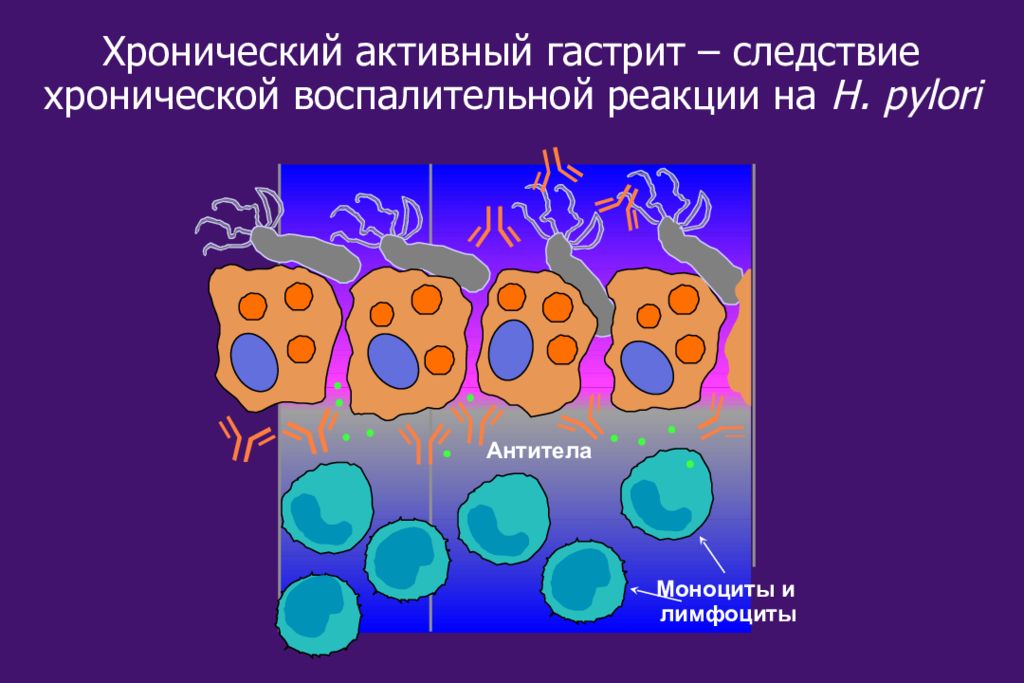
Многочисленные эпидемиологические исследования показали, что Helicobacter pylori-инфекция является одной из самых распространенных инфекций в мире. В развивающихся странах Н.pylori выявляется с высокой частотой — до 90% уже в детском возрасте, а к 30-ти годам Н.pylori инфекция выявляется почти у всего населения. В большинстве развитых стран Н.pylori выявляется у детей в 5-15 % случаев, а у взрослых, в зависимости от возраста, в 20-65%.
Несмотря на высокий процент инфицирования населения H.pylori подавляющее большинство инфицированных лиц не имеют клинических проявлений на момент диагностики, но они представляют собой группу риска, в которой с течением времени развивается хронический гастрит, язвенная болезнь желудка, язвенная болезнь двенадцатиперстной кишки, экстранодальная В-клеточня MALT-лимфома или аденокарцинома желудка.
К настоящему времени, у двух штаммов хеликобактер пилори (J99 и 26695) определены полные последовательности генома. Геном H.pylori содержит 1600 генов. Ряд генов, продукты которых белки CagA, VacA, IceA, BabA считаются факторами патогенности.
Ряд генов, продукты которых белки CagA, VacA, IceA, BabA считаются факторами патогенности.
В настоящее время чтобы определить Helicobacter Pylori применяют микробиологический, микроскопический, гистологический методы, ДНК-диагностику, серологическое выявление антител .
Антитела начинают вырабатываться через 3-4 недели после инфицирования. Высокие титры антител к H. pylori сохраняются до и некоторое время после ликвидации микроорганизма.
Сдавать кровь утром, в период с 7:30 до 12:00 часов, строго натощак.
Рекомендуется не менее 8 часов и не более 14 часов голода, питье – вода, в обычном режиме; накануне избегать пищевых перегрузок; исключить курение и употребление алкоголя.
Сотрудники лаборатории и лечащий врач должны знать, принимает ли пациент препараты, которые могут повлиять на результат анализа (в некоторых случаях от их применения необходимо воздержаться).
Anti-H.pylori IgG (антитела класса IgG к Helicobacter pylori)
Исследуемый материал Сыворотка крови
Метод определения Иммуноанализ
Маркёр, подтверждающий инфицированность Хеликобактер пилори. Эти антитела начинают вырабатываться через 3 — 4 недели после инфицирования. Высокие титры антител к H.pylori сохраняются до и некоторое время после ликвидации микроорганизма.
Особенности инфекции. Инфекция Helicobacter pylori. H. pylori на сегодняшний день — одна из широко распространённых инфекций на земле. К H.pylori-ассоциированным болезням относятся хронический гастрит, язвенная болезнь желудка и двенадцатиперстной кишки. Поражение слизистой оболочки желудка обусловлено прямым повреждением её микроорганизмом, а также вторичным повреждением слизистой оболочки желудка, двенадцатиперстной кишки и кардиальной части пищевода под действием факторов агрессии H.pylori. Хеликобактер представляет собой грамотрицательную бактерию спиралевидной формы со жгутиками. Бактериальная клетка окружена слоем геля — гликокаликса, который защищает её от воздействия соляной кислоты желудочного сока. Хеликобактер чувствителен к действию высоких температур, но длительно сохраняется во влажной среде.
Эти антитела начинают вырабатываться через 3 — 4 недели после инфицирования. Высокие титры антител к H.pylori сохраняются до и некоторое время после ликвидации микроорганизма.
Особенности инфекции. Инфекция Helicobacter pylori. H. pylori на сегодняшний день — одна из широко распространённых инфекций на земле. К H.pylori-ассоциированным болезням относятся хронический гастрит, язвенная болезнь желудка и двенадцатиперстной кишки. Поражение слизистой оболочки желудка обусловлено прямым повреждением её микроорганизмом, а также вторичным повреждением слизистой оболочки желудка, двенадцатиперстной кишки и кардиальной части пищевода под действием факторов агрессии H.pylori. Хеликобактер представляет собой грамотрицательную бактерию спиралевидной формы со жгутиками. Бактериальная клетка окружена слоем геля — гликокаликса, который защищает её от воздействия соляной кислоты желудочного сока. Хеликобактер чувствителен к действию высоких температур, но длительно сохраняется во влажной среде.
Заражение происходит пищевым, фекально-оральным, бытовым путями. H.pylori обладает способностью к колонизации и персистированию в слизистой оболочке желудка. К патогенным факторам относятся ферменты (уреаза, фосфолипаза, протеаза и гамма-ГТ), жгутики, цитотоксин А (VacA), гемолизин (RibA), белки теплового шока и липополисахарид. Бактериальная фосфолипаза повреждает мембрану эпителиоцитов, микроорганизм прикрепляется к поверхности эпителия и проникает в клетки. Под действием уреазы и других факторов патогенности повреждается слизистая оболочка, усиливаются воспалительные реакции и образование цитокинов, радикалов кислорода, окиси азота. Липополисахаридный антиген обладает структурным сходством с антигенами групп крови (по системе Lewis) и клетками желудочного эпителия человека, в результате возможна продукция аутоантител к эпителию слизистой оболочки желудка и развитие атрофического аутоиммунного гастрита. Поверхностное расположение уреазы позволяет ускользать от действия антител: комплекс уреаза-антитело сразу же отделяется с поверхности. Усиление перекисного окисления липидов и повышение концентрации свободных радикалов увеличивает вероятность канцерогенеза.
Обсеменение слизистой оболочки желудка H.pylori сопровождается развитием поверхностного антрального гастрита и дуоденита, ведёт к повышению уровня гастрина и снижению выработки соматостатина с последующим усилением секреции соляной кислоты. Избыточное количество соляной кислоты, попадая в просвет двенадцатиперстной кишки, ведёт к прогрессированию дуоденита и развитию желудочной метаплазии, что создает условия для заселения H.pylori.
Усиление перекисного окисления липидов и повышение концентрации свободных радикалов увеличивает вероятность канцерогенеза.
Обсеменение слизистой оболочки желудка H.pylori сопровождается развитием поверхностного антрального гастрита и дуоденита, ведёт к повышению уровня гастрина и снижению выработки соматостатина с последующим усилением секреции соляной кислоты. Избыточное количество соляной кислоты, попадая в просвет двенадцатиперстной кишки, ведёт к прогрессированию дуоденита и развитию желудочной метаплазии, что создает условия для заселения H.pylori.
В дальнейшем, особенно при наличии дополнительных факторов риска (наследственная предрасположенность, I группа крови, курение, приём ульцерогенных лекарственных препаратов, частые стрессы, алиментарные погрешности), в участках мета-плазированной слизистой оболочки формируется язвенный дефект.
В 1995 г. Международной ассоциацией по изучению рака (IARC) H.pylori признан абсолютным канцерогеном и определён как важнейшая причина злокачественных новообразований желудка у человека (MALToma — Mucosa Associated Lymphoid Tissue lymphoma, аденокарцинома). При проведении эпидемиологических исследований выявлена более частая инфицированность H.pylori у пациентов с неязвенной диспепсией и гастроэзофагеальной рефлюксной болезнью (ГЭРБ), чем без них.
При проведении эпидемиологических исследований выявлена более частая инфицированность H.pylori у пациентов с неязвенной диспепсией и гастроэзофагеальной рефлюксной болезнью (ГЭРБ), чем без них.
Факторами, ответственными за развитие неязвенной диспепсии или ГЭРБ у H.pylori-инфицированных пациентов, считают нарушение желудочной моторики, секреции, повышение висцеральной чувствительности и проницаемости клеточного барьера слизистой оболочки, а также высвобождение цитокинов в результате её воспалительных изменений. Ликвидация H. pylori у пациентов с язвенной болезнью позволяет прекратить приём антисекреторных препаратов.
Особое значение лабораторная диагностика H. pylori имеет в следующих ситуациях:
| Ситуация | Причина |
| Случаи инфекции в семье или среди совместно проживающих лиц | Контактно-бытовая передача в семье. Инфекция H. pylori увеличивает риск
развития рака желудка.
Инфекция H. pylori увеличивает риск
развития рака желудка. |
| Язвенная болезнь | Ликвидация H. pylori позволяет прекратить приём антисекреторных препаратов; снизить риск развития рака желудка. |
Helicobacter pylori CagA сум (IgG, IgM, IgA)
Helicobacter pylori — бактерия в форме спирали, которая поражает стенку желудка и двенадцатиперстной кишки, вызывая атрофический гастрит, язвенную болезнь и злокачественные образования. Около 50-60% населения инфицировано Helicobacter pylori, обычно заражение происходит еще в детстве.
Благодаря своей форме Helicobacter pylori способна повреждать защитный слой слизистой оболочки желудка. Бактерия продуцирует фермент уреаза, который способен нейтрализовать соляную кислоту желудка. Таким образом стенка желудка становится восприимчивой к повреждающему действию соляной кислоты и пепсина, что ведет к язвенной болезни желудка или двенадцатиперстной кишки.
Helicobacter pylori может действовать непосредственно на клетки желудка, ослабляя защитный механизм и провоцируя воспаление слизистой. Helicobacter pylori способна усиливать секрецию соляной кислоты в желудке, хотя механизм этого процесса не изучен.
Путь передачи инфекции — орально-фекальный и бытовой. Заражение обычно происходит от человека к человеку посредством близкого контакта (при поцелуях). Источником инфекции может быть слюна, вода.
Часто инфекция может протекать латентно, не вызывая никаких симптомов.
Язвенная болезнь двенадцатиперстной кишки практически в 100% случаев ассоциирована с Helicobacter pylori. Антибактериальная терапия, которая направлена на уничтожение бактерии, приводит к полному излечению от язвенной болезни.
У 90% страдающих язвенной болезнью желудка обнаруживается Helicobacter pylori. Антибактериальное лечение приводит к рубцеванию язвы в 70-90% случаев.
Тяжелое заболевание желудка — аденокарцинома — в 70-90% случаев вызвано инфицированием Helicobacter pylori.
Наиболее цитотоксичный антиген Helicobacter pylori — СаgA — cytotoxin assotiated gene. Штаммы бактерий, которые экспрессируют СаgA, отличает большая агрессивность, они вызывают 80-100% язвенных поражений желудка и двенадцатиперстной кишки и 94% аденокарцином желудка. Штаммы Helicobacter pylori, не продуцирующие СаgA эффекторные белки, ассоциируются с атрофическим гастритом или латентным течением инфекции.
Данный анализ позволяет определить количество суммарных антител IgM, IgА, IgG к антигену СаgA Helicobacter pylori, возбудителю заболеваний желудка и двенадцатиперстной кишки. Анализ позволяет диагностировать инфицирование штаммами Helicobacter pylori, экспрессирующими антиген СаgA.
Стоимость исследования
Антитела к Helicobacter pylori, IgG
Антитела к Helicobacter pylori, IgG
Лаборатория коммерческой рассылки
5231 RCP
356-8593
Средний сбор:
| Красная верхняя пробирка 5 мл (активатор свертывания) |
Минимум:
Предпочтительный минимум: 1 мл сыворотки в красной пробирке
Абсолютный минимум: 0,5 мл сыворотки в красной верхней пробирке
Критерии отклонения:
Образцы, не относящиеся к сыворотке крови; термоинактивированная сыворотка; сильно гемолизированный; желтушные или липемические; образцы, содержащие твердые частицы или показывающие очевидное микробное загрязнение..gif)
Инструкции по доставке:
Держите образец при комнатной температуре.
График испытаний:
Графики тестирования могут отличаться.
Turn Around Время:
1-3 дня с момента поступления в референс-лабораторию. В некоторых случаях следует выделить дополнительное время для дополнительных подтверждающих или дополнительных рефлекторных тестов.
Эталонный диапазон:
Отрицательный:
Однозначно: 0,80 — 0,89
Положительно:> 0,89
Комментарии:
Серологическое тестирование на Helicobacter IgG не рекомендуется в качестве первичного тестирования из-за низкой специфичности и чувствительности.Альтернативными вариантами являются тесты на антиген H. pylori, стул (LAB4483) или мочевину (дыхательный тест на H. pylori (для взрослых), LAB947; дыхательный тест на H. pylori (для детей), LAB8127). Этот тест представляет собой рассылку с увеличенным сроком выполнения. Тестирование не рекомендуется для отделения неотложной помощи или стационара.
Артикул :
Амиева МР, Эль ‐ Омар ЭМ. Бактериальные взаимодействия хозяина в инфекции Helicobacter pylori . Гастроэнтерология . 2008 Янв; 134 (1): 306-323. PubMed 18166359
Коричневый LM. Helicobacter pylori : эпидемиология и пути передачи. Эпидемиол Ред. . 2000; 22 (2): 283-297. PubMed 11218379
DiaSorin LIAISON®. H. pylori IgG [вкладыш в упаковке]. (REF 318980), US-47667-2017-01.
Kusters JG, van Vliet AH, Kuipers EJ. Патогенез инфекции Helicobacter pylori . Clin Microbiol Ред. . Июль 2006; 19 (3): 449-490. PubMed 16847081
Megraud F. Передача Helicobacter pylori : фекально-оральный или орально-оральный путь. Алимент Фармакол Тер . 1995; 9 Дополнение 2: 85-91. PubMed 8547533
Тест Ограничения:
Результаты анализа следует использовать вместе с другими клиническими и лабораторными данными, чтобы помочь клиницисту в принятии индивидуальных решений по ведению пациента. Гетерофильные антитела в сыворотке крови человека могут реагировать с реагентными иммуноглобулинами или другим реагентным материалом, препятствуя иммуноанализу in vitro .
Гетерофильные антитела в сыворотке крови человека могут реагировать с реагентными иммуноглобулинами или другим реагентным материалом, препятствуя иммуноанализу in vitro .Этот анализ не оценивался в педиатрической популяции.
Этот анализ следует использовать только для оценки пациентов с клиническими признаками и симптомами, указывающими на желудочно-кишечные заболевания, и не предназначен для использования с бессимптомными пациентами.
Положительный результат теста не позволяет отличить активную инфекцию от колонизации H. pylori . Положительный тест указывает только на присутствие антител IgG к H. pylori и не обязательно указывает на наличие желудочно-кишечного заболевания.
Отрицательный результат показывает, что антитела IgG к H.pylori отсутствует или находится на уровне, который не может быть обнаружен анализом.
Методология:
Хемилюминесцентный иммуноферментный анализ (CLIA)
Helicobacter pylori (H.
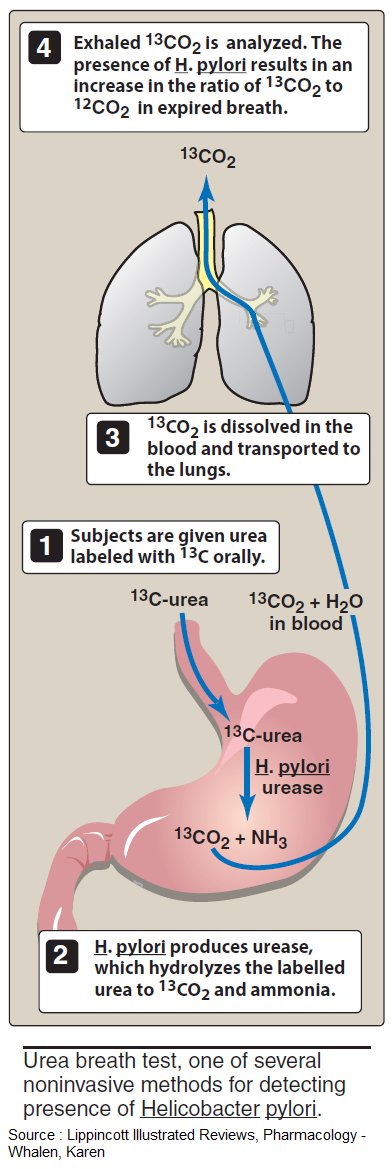 pylori) Тестирование
pylori) ТестированиеИсточники, использованные в текущем обзоре
Сантакроче, Л. и Бутани, М. (9 августа 2018 г., обновлено). Инфекция Helicobacter Pylori. Medscape Gastroenterology. Доступно на сайте https://emedicine.medscape.com/article/176938-overview. Доступ 9.08.18.
Лай, С. (обновлено 1 августа 2017 г.). Тесты на H. pylori. Медицинская энциклопедия MedlinePlus. Доступно на сайте https://medlineplus.gov/ency/article/007501.htm. Доступ 9.08.18.
Кутюрье М. и Джарбо Э. (август 2018 г., обновлено). Helicobacter pylori. ARUP Consult. Доступно на сайте https://arupconsult.com/content/helicobacter-pylori. Доступ 9.08.18.
Zingman, B. et. al. (12 октября 2017 г., обновлено). Инфекция Helicobacter pylori. Медицинская энциклопедия MedlinePlus.Доступно на сайте https://medlineplus.gov/ency/article/007715.htm. Доступ 9.08.18.
(© 1995– 2018). Дыхательный тест на Helicobacter pylori. Клиника Мэйо Медицинские лаборатории Мэйо. Доступно на сайте https://www.mayomedicallaboratories.com/test-catalog/Clinical+and+Interpretive/81590. Доступ 9.08.18.
Доступно на сайте https://www.mayomedicallaboratories.com/test-catalog/Clinical+and+Interpretive/81590. Доступ 9.08.18.
(© 1995– 2018). Антиген Helicobacter pylori, Кал. Клиника Мэйо Медицинские лаборатории Мэйо. Доступно на сайте https://www.mayomedicallaboratories.com/test-catalog/Clinical+and+Interpretive/81806.Доступ 9.08.18.
Sultan, M. et. al. (12 февраля 2018 г., обновлено). Детская инфекция Helicobacter Pylori. Медицинская педиатрия: общая медицина. Доступно на сайте https://emedicine.medscape.com/article/929452-overview. Доступ 9.08.18.
(5 апреля 2017 г.) Арманд В. Х. пилори, настоящий желудочный «микроб»: кого врачи должны проверять и лечить? Гарвардское здоровье. Доступно на сайте https://www.health.harvard.edu/blog/h-pylori-a-true-stomach-bug-who-should-doctors-test-and-treat-2017040511328.По состоянию на сентябрь 2018 г.
(© 1995–2018). Алгоритм диагностики Helicobacter pylori. Клиника Мэйо Медицинские лаборатории Мэйо. Доступно в Интернете по адресу https://www. mayocliniclabs.com/it-mmfiles/Helicobacter_pylori_Diagnostic_Algorithm.pdf. По состоянию на сентябрь 2018 г.
mayocliniclabs.com/it-mmfiles/Helicobacter_pylori_Diagnostic_Algorithm.pdf. По состоянию на сентябрь 2018 г.
© 2018 ARUP Laboratories. Дыхательный тест на Helicobacter pylori. Доступно на сайте https://www.aruplab.com/testing/0020646. По состоянию на сентябрь 2018 г.
Источники, использованные в предыдущих обзорах
Медицинский информационный центр клиники Кливленда.Дыхательный тест для H. pylori (онлайн-информация). Доступно в Интернете по адресу http://www.clevelandclinic.org/health/. По состоянию на февраль 2008 г.
Пагана К., Пагана Т. Мосби Руководство по диагностическим и лабораторным исследованиям. 3-е издание, Сент-Луис: Мосби Эльзевьер; 2006.
Forbes BA, Sahm DF, Weissfeld AS. Диагностическая микробиология Бейли и Скотта, 12-е издание: Мосби Эльзевьер, Сент-Луис, Миссури; 2007.
Чисхолм С.А., Оуэн Р.Дж. Применение анализов на основе полимеразной цепной реакции для быстрой идентификации и скрининга антибиотикорезистентности Helicobacter pylori в биоптатах желудка. Diagn Microbiol Infect Dis. 11 января 2008 г.
Diagn Microbiol Infect Dis. 11 января 2008 г.
Siddique I, et. al. Диагностика Helicobacter pylori : повышение чувствительности теста CLO путем увеличения количества биопсий антрального отдела желудка. Дж Клин Гастроэнтерол. , апрель 2008 г .; 42 (4): 356-360.
Клиническая химия: принципы, процедуры, взаимосвязи. Епископ М., Дубен-Энгелькирк Дж., Фоди Е., ред. 4-е изд. Филадельфия: Липпинкотт Уильямс и Уилкинс; 2000.
Клиническая химия: теория, анализ и корреляции.Каплан Л., Пеше А., ред. 2-е изд. Сент-Луис: Компания К. В. Мосби; 1989.
Национальный информационный центр по заболеваниям пищеварительной системы. H. pylori и язвенная болезнь. Доступно в Интернете по адресу http://digestive.niddk.nih.gov/ddiseases/pubs/hpylori/. По состоянию на июнь 2011 г.
Майкл Селград, Арне Кандульски и Питер Малфертхайнер. Helicobacter pylori : Диагностика и лечение: Диагностика Helicobacter pylor i. Курр Опин Гастроэнтерол .2009; 25 (6): 549-556. Доступно в Интернете по адресу http://www.medscape.com/viewarticle/711405_2. По состоянию на июнь 2011 г.
Курр Опин Гастроэнтерол .2009; 25 (6): 549-556. Доступно в Интернете по адресу http://www.medscape.com/viewarticle/711405_2. По состоянию на июнь 2011 г.
Бауманн А. и Кац П. (обновлено 27 января 2014 г.). Тест на антиген Helicobacter Pylori. Медицинские препараты и болезни [Он-лайн информация]. Доступно в Интернете по адресу http://emedicine.medscape.com/article/2117821-overview. По состоянию на октябрь 2014 г.
Сантакроче, Л. и Бутани, М. (обновлено 11 сентября 2014 г.). Инфекция Helicobacter Pylori. Медицинские препараты и болезни [Информация в Интернете].Доступно в Интернете по адресу http://emedicine.medscape.com/article/176938-overview. По состоянию на октябрь 2014 г.
Longstreth, G. (Обновлено 22 августа 2013 г.). Тесты на H. pylori. Медицинская энциклопедия MedlinePlus [Он-лайн информация]. Доступно в Интернете по адресу http://www.nlm.nih.gov/medlineplus/ency/article/007501.htm. По состоянию на октябрь 2014 г.
ДиМарино, М. (редакция, май 2014 г. ). Инфекция Helicobacter pylori. Руководство Merck Professional Edition [Электронная информация]. Доступно в Интернете по адресу http: // www.merckmanuals.com. По состоянию на октябрь 2014 г.
). Инфекция Helicobacter pylori. Руководство Merck Professional Edition [Электронная информация]. Доступно в Интернете по адресу http: // www.merckmanuals.com. По состоянию на октябрь 2014 г.
(© 1995–2014). Антитела к Helicobacter pylori, IgA, сыворотка. Клиника Мэйо Медицинские лаборатории Мэйо [Он-лайн информация]. Доступно в Интернете по адресу http://www.mayomedicallaboratories.com/test-catalog/Overview/35755. По состоянию на октябрь 2014 г.
(ноябрь 2013 г.). Инфекция Helicobacter pylori: стратегии использования тестов для диагностики. Коммюнике клиники Мэйо Медицинские лаборатории Мэйо [Он-лайн информация]. Доступно в Интернете по адресу http: //www.mayomedicallaboratories.ком / статьи / коммюнике / 2013/11-hpylori-заражение /. По состоянию на октябрь 2014 г.
Келли, Дж. (30 сентября 2014 г.). ВОЗ призывает провести скрининг на H. pylori для предотвращения рака желудка. Новости Medscape [Он-лайн информация]. Доступно в Интернете по адресу http://www.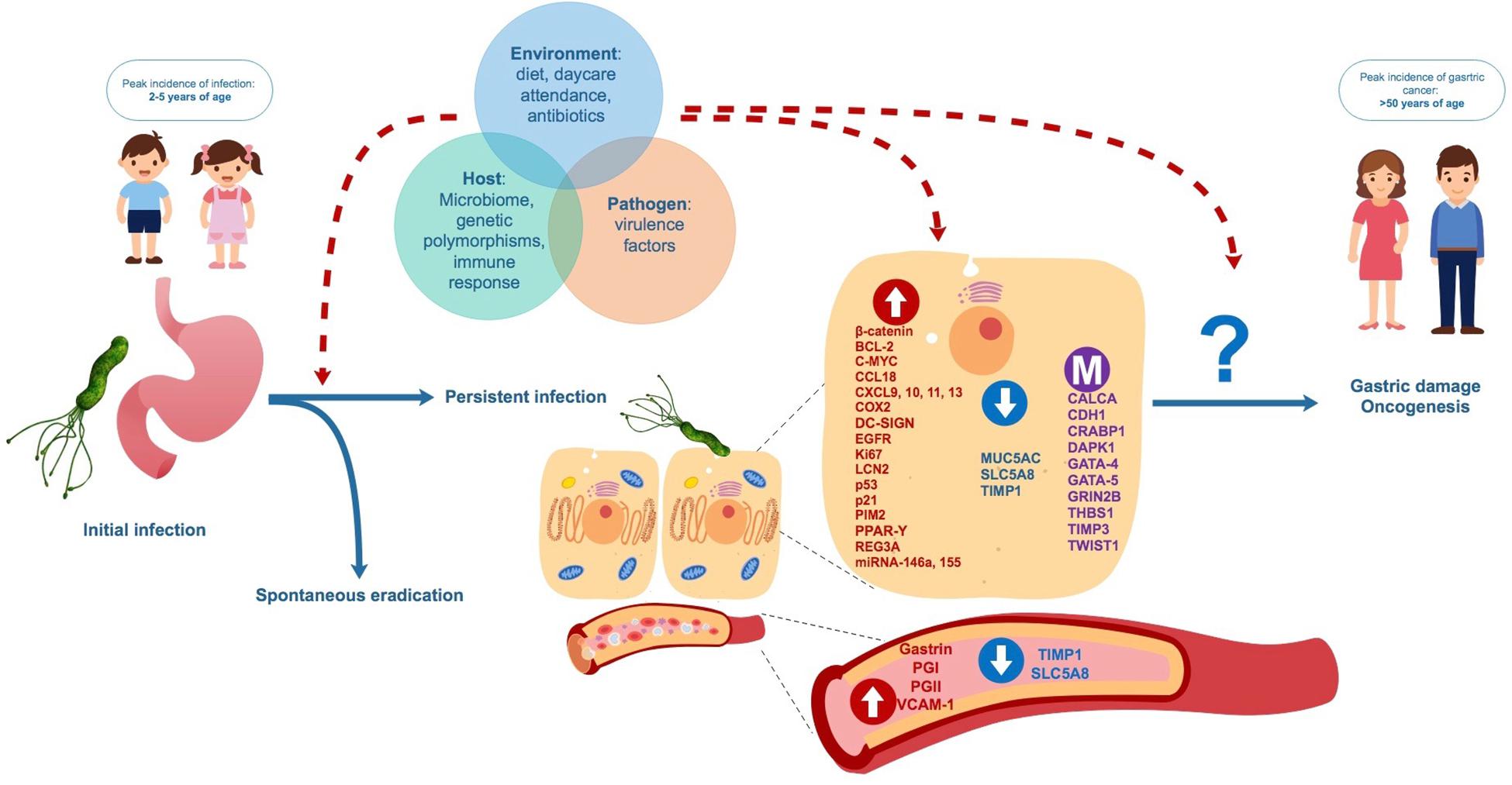 medscape.com/viewarticle/832581. По состоянию на октябрь 2014 г.
medscape.com/viewarticle/832581. По состоянию на октябрь 2014 г.
Baron, E. et. al. (10 июля 2013 г.). Руководство по использованию микробиологической лаборатории для диагностики инфекционных заболеваний: Рекомендации Американского общества инфекционных болезней (IDSA) и Американского общества микробиологов (ASM), 2013 г.[Он-лайн информация]. Доступно в Интернете по адресу http://www.idsociety.org. По состоянию на октябрь 2014 г.
Пагана, К. Д., Пагана, Т. Дж., И Пагана, Т. Н. (© 2015). Справочник по диагностическим и лабораторным испытаниям Мосби, 12-е издание: Mosby, Inc., Сент-Луис, Миссури. Стр. 494-496.
титр антител IgG против Helicobacter pylori коррелирует с присутствием цитотоксин-ассоциированных генов A-положительных штаммов H. pylori | Возбудители и болезни
Абстрактные
Уровень титра антител IgG против Helicobacter pylori коррелирует с тяжестью гастрита. Штаммы H. pylori могут нести так называемый остров патогенности, содержащий ген, связанный с цитотоксином ( cagA) . Поскольку штаммы cag A более вирулентны, можно предположить, что гастрит будет более тяжелым и, следовательно, титр антител IgG выше. В поперечном исследовании изучалась корреляция титра антител IgG и статуса cag A у пациентов, перенесших эндоскопию верхних отделов желудочно-кишечного тракта. Были получены образцы биопсии для определения H.pylori статус. Кроме того, был взят образец сыворотки для обнаружения антител IgG против H. pylori , а также CagA. Всего было включено 290 пациентов, положительных на антитела IgG против H. pylori . Из них 153 были cag A-положительными и 137 были cag A-отрицательными. Средний титр антител IgG был значительно выше у cag A-положительных пациентов по сравнению с cag A-отрицательных, 0,75 (стандартное отклонение 0,22) по сравнению с 0,69 (стандартное отклонение 0,24) ( P = 0.
Штаммы H. pylori могут нести так называемый остров патогенности, содержащий ген, связанный с цитотоксином ( cagA) . Поскольку штаммы cag A более вирулентны, можно предположить, что гастрит будет более тяжелым и, следовательно, титр антител IgG выше. В поперечном исследовании изучалась корреляция титра антител IgG и статуса cag A у пациентов, перенесших эндоскопию верхних отделов желудочно-кишечного тракта. Были получены образцы биопсии для определения H.pylori статус. Кроме того, был взят образец сыворотки для обнаружения антител IgG против H. pylori , а также CagA. Всего было включено 290 пациентов, положительных на антитела IgG против H. pylori . Из них 153 были cag A-положительными и 137 были cag A-отрицательными. Средний титр антител IgG был значительно выше у cag A-положительных пациентов по сравнению с cag A-отрицательных, 0,75 (стандартное отклонение 0,22) по сравнению с 0,69 (стандартное отклонение 0,24) ( P = 0. 033). Сделан вывод о том, что титр антител IgG значительно выше у пациентов с cag A-позитивными штаммами H. pylori . Однако в повседневной практике уровень титра антител IgG не может предсказать, несет ли человек штамм cag A-позитивный H. pylori , поскольку титр антител IgG перекрывается между cag A-позитивным и cag . А-отрицательные пациенты.
033). Сделан вывод о том, что титр антител IgG значительно выше у пациентов с cag A-позитивными штаммами H. pylori . Однако в повседневной практике уровень титра антител IgG не может предсказать, несет ли человек штамм cag A-позитивный H. pylori , поскольку титр антител IgG перекрывается между cag A-позитивным и cag . А-отрицательные пациенты.
1 Введение
Helicobacter pylori вызывает системный ответ антител.Определение антител IgG в сыворотке крови используется для диагностики колонизации H. pylori . Высота титра антител коррелирует с тяжестью гастрита [1]. Штаммы H. pylori могут нести так называемый остров патогенности, содержащий ген, связанный с цитотоксином ( cagA) . Продукт этого гена (CagA) является маркером вирулентности H. pylori [2,3]. H. pylori Гастрит, связанный с язвенной болезнью, почти в 100% случаев вызван cag A-позитивным H. pylori , тогда как количество cagA-положительных штаммов у пациентов с функциональной диспепсией и гастритом значительно ниже (35–50%) [4–10]. Однако эта связь не всегда обнаруживается [11].
pylori , тогда как количество cagA-положительных штаммов у пациентов с функциональной диспепсией и гастритом значительно ниже (35–50%) [4–10]. Однако эта связь не всегда обнаруживается [11].
Поскольку cag A-положительные штаммы более вирулентны, можно предположить, что степень воспаления будет более серьезной, что приведет к более высокому титру антител IgG у пациентов с cag A-положительной колонизацией H. pylori . Было проведено поперечное исследование для корреляции титра антител IgG со статусом cag A.
2 Пациенты и методы
Для настоящего исследования использовалась сыворотка пациентов, описанных ранее [12]. Всем пациентам выполнена эндоскопия верхних отделов желудочно-кишечного тракта по поводу жалоб со стороны верхних отделов брюшной полости. Исключались пациенты с активной язвенной болезнью и раком желудка. Во время процедуры были взяты образцы биопсии из антрального отдела желудка для окрашивания гематоксилином / эозином и иммунопероксидазой ( n = 2), экспресс-теста на уреазу ( n = 1) и культуры ( n = 1) согласно ранее описанным методам.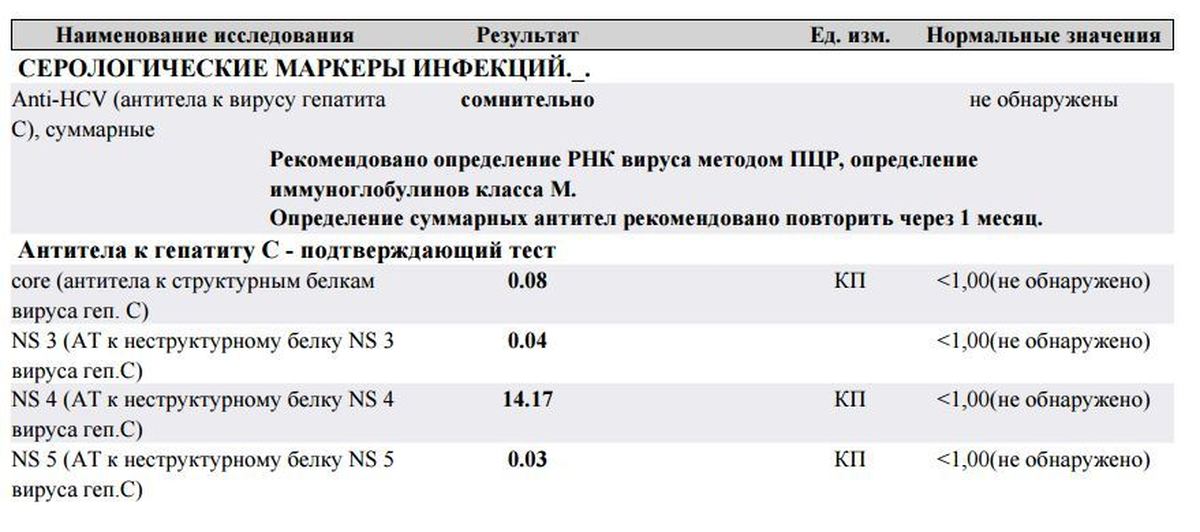 описаны методы [13].Кроме того, был взят образец сыворотки и заморожен при -70 ° C для обнаружения антител IgG против H. pylori , а также CagA. Специфические IgG-антитела против H. pylori измеряли в сыворотке с использованием собственного метода ELISA, как описано [14]. Неочищенный антиген был получен из смеси шести объединенных штаммов H. pylori , четыре из которых были cagA-положительными. Индекс оптической плотности выше 0,31 считался положительным. Чувствительность и специфичность этого ELISA для обнаружения H.pylori составляло 98,5 и 91,7% соответственно [14]. Определение статуса cagA H. pylori было основано на присутствии сывороточных антител IgG к рекомбинантному продукту CagA (orv220). Штамм E. coli , из которого был очищен этот белок, содержал значительную часть гена cagA H. pylori , который затем можно легко получить в чистом виде в виде рекомбинантного продукта массой 65 кДа [15]. Наличие этих антител оценивали с помощью ELISA согласно ранее описанным методикам [15].
описаны методы [13].Кроме того, был взят образец сыворотки и заморожен при -70 ° C для обнаружения антител IgG против H. pylori , а также CagA. Специфические IgG-антитела против H. pylori измеряли в сыворотке с использованием собственного метода ELISA, как описано [14]. Неочищенный антиген был получен из смеси шести объединенных штаммов H. pylori , четыре из которых были cagA-положительными. Индекс оптической плотности выше 0,31 считался положительным. Чувствительность и специфичность этого ELISA для обнаружения H.pylori составляло 98,5 и 91,7% соответственно [14]. Определение статуса cagA H. pylori было основано на присутствии сывороточных антител IgG к рекомбинантному продукту CagA (orv220). Штамм E. coli , из которого был очищен этот белок, содержал значительную часть гена cagA H. pylori , который затем можно легко получить в чистом виде в виде рекомбинантного продукта массой 65 кДа [15]. Наличие этих антител оценивали с помощью ELISA согласно ранее описанным методикам [15]. Метод ELISA был ранее проверен в США и дал чувствительность 94,4% и специфичность 92,5% для обнаружения носительства cag A положительных штаммов H. pylori . Кроме того, мы проверили методику для голландской популяции с помощью сывороток 311 пациентов, получивших отрицательный результат на H. pylori путем комбинации отрицательных гистологических исследований, посева, экспресс-теста на уреазу и серологии для H. pylori . Средний результат +2 S.D.в этой популяции пороговое значение составило 0,458. Все результаты выше этого уровня считались положительными. К сожалению, не существует стандартной контрольной сыворотки, которую можно было бы использовать для определения концентрации CagA-специфических антител в сыворотке пациентов на пороговом уровне для cagA-положительности. Чтобы сравнить наши данные с данными других, была построена стандартная кривая с использованием серийных разведений конъюгированного с HRPO козьего античеловеческого IgG + M + A IgG (American Qualex, Ла Мирада, Калифорния, США), который использовался в CagA ELISA.
Метод ELISA был ранее проверен в США и дал чувствительность 94,4% и специфичность 92,5% для обнаружения носительства cag A положительных штаммов H. pylori . Кроме того, мы проверили методику для голландской популяции с помощью сывороток 311 пациентов, получивших отрицательный результат на H. pylori путем комбинации отрицательных гистологических исследований, посева, экспресс-теста на уреазу и серологии для H. pylori . Средний результат +2 S.D.в этой популяции пороговое значение составило 0,458. Все результаты выше этого уровня считались положительными. К сожалению, не существует стандартной контрольной сыворотки, которую можно было бы использовать для определения концентрации CagA-специфических антител в сыворотке пациентов на пороговом уровне для cagA-положительности. Чтобы сравнить наши данные с данными других, была построена стандартная кривая с использованием серийных разведений конъюгированного с HRPO козьего античеловеческого IgG + M + A IgG (American Qualex, Ла Мирада, Калифорния, США), который использовался в CagA ELISA.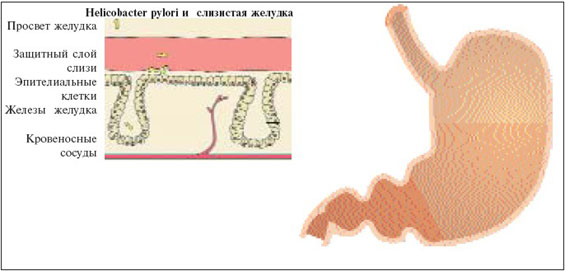 Из этой стандартной кривой было сделано заключение, что граница для CagA-положительности соответствует концентрации 4,2 × 10 -6 мг / мл -1 специфических антител CagA в сыворотках испытуемых субъектов.
Из этой стандартной кривой было сделано заключение, что граница для CagA-положительности соответствует концентрации 4,2 × 10 -6 мг / мл -1 специфических антител CagA в сыворотках испытуемых субъектов.
Были включены только пациенты, положительные по антителам IgG против H. pylori .
Статистический анализ проводился с использованием критерия χ-квадрата для таблиц сопряженности и критерия t . Исследование было одобрено комитетом по медицинской этике Ziekenhuis De Heel.
3 Результаты
Всего было включено 290 пациентов, положительных на антитела IgG против H. pylori . Из них 153 были cag A-положительными и 137 были cag A-отрицательными. Средний титр антител CagA составил 0,85 (стандартное отклонение 0,21, диапазон 0,50–1,27). Средний титр антител IgG был значительно выше у cag A-положительных пациентов по сравнению с cag A-отрицательных, 0,75 (стандартное отклонение 0,22) по сравнению с 0,69 (стандартное отклонение 0,24) ( P = 0,033). Однако, как будет ясно из данных, значительное совпадение имело место (рис. 1). Разницы не было, если титр антител IgG против H. pylori был разделен на низкий (0,31–0,60), средний (0,61–0,90) и высокий (> 0,91) уровни (Таблица 1). Пациенты с язвенной болезнью в анамнезе, но не с текущей активной язвой, имели более высокий титр антител IgG, если они были cag A-положительными; среднее 0,73 (стандартное отклонение 0,23) n = 42 по сравнению со средним значением 0,64 (стандартное отклонение 0,22) n = 11.Из-за небольшого числа пациентов с предшествующей язвенной болезнью этот показатель не достиг статистической значимости. При сравнении пациентов с язвенной болезнью в анамнезе и без нее не было различий в уровне титра антител IgG против H. pylori .
Однако, как будет ясно из данных, значительное совпадение имело место (рис. 1). Разницы не было, если титр антител IgG против H. pylori был разделен на низкий (0,31–0,60), средний (0,61–0,90) и высокий (> 0,91) уровни (Таблица 1). Пациенты с язвенной болезнью в анамнезе, но не с текущей активной язвой, имели более высокий титр антител IgG, если они были cag A-положительными; среднее 0,73 (стандартное отклонение 0,23) n = 42 по сравнению со средним значением 0,64 (стандартное отклонение 0,22) n = 11.Из-за небольшого числа пациентов с предшествующей язвенной болезнью этот показатель не достиг статистической значимости. При сравнении пациентов с язвенной болезнью в анамнезе и без нее не было различий в уровне титра антител IgG против H. pylori .
Рисунок 1
Высотатитра антител IgG (оптическая плотность) в зависимости от наличия или отсутствия антител против CagA. (1 = 0,31–0,40; 2 = 0,41–0,50; 3 = 0,51–0,60; 4 = 0.61–0,70; 5 = 0,71–0,80; 6 = 0,81–090; 7 = 0,91–1,00; 8 = 1,01–1,10; 9 = 1,11–1,20; 10 = 1,21–1,30)
Рис. 1
1
Высота титра антител IgG (оптическая плотность) в зависимости от наличия или отсутствия антител против CagA. (1 = 0,31–0,40; 2 = 0,41–0,50; 3 = 0,51–0,60; 4 = 0,61–0,70; 5 = 0,71–0,80; 6 = 0,81–090; 7 = 0,91–1,00; 8 = 1,01–1,10; 9 = 1,11–1,20; 10 = 1,21–1,30)
Таблица 1Соотношение титра антител IgG против H. pylori и наличия антител IgG против CagA
| Титр антител IgG против H.pylori | cagA-положительный | cagA-отрицательный |
| Низкий | 39 (25%) | 51 (37%) |
| Промежуточный | 71 (46%) | 52 (37 %) |
| Высокий | 44 (28%) | 34 (25%) |
| Титр антител IgG против H. pylori | cagA-положительный | cagA-отрицательный |
| Низкий | 39 (25%) | 51 (37%) |
| Промежуточный | 71 (46%) | 52 (37%) |
| Высокий | 44 (28%) | 34 (25%) |
Отношение титра антител IgG к H.pylori и наличие антител IgG против CagA
| Титр антител IgG против H. pylori | cagA-позитивный | cagA-негативный |
| Низкий | 39 (25%) | 51 (37%) |
| Промежуточный | 71 (46%) | 52 (37%) |
| Высокий | 44 (28%) | 34 (25%) |
| Титр антител IgG против H.pylori | cagA-положительный | cagA-отрицательный |
| Низкий | 39 (25%) | 51 (37%) |
| Промежуточный | 71 (46%) | 52 (37 %) |
| Высокий | 44 (28%) | 34 (25%) |
На рис. 2 показана взаимосвязь разных возрастных когорт с наличием антител IgG к CagA. Пациенты с cagA-положительными штаммами были значительно моложе ( P <0.002).
Рисунок 2
Наличие антител CagA в зависимости от возраста исследуемых пациентов. (1 = <40 лет; 2 = 41–60 лет; 3 => 60 лет)
Рисунок 2
Наличие антител CagA в зависимости от возраста исследованных пациентов. (1 = <40 лет; 2 = 41–60 лет; 3 => 60 лет)
4 Обсуждение
Хотя не существует международной стандартизированной сыворотки на антитела IgG против H. pylori , измеренная оптическая плотность ELISA отдельного пациента может быть использована для оценки степени тяжести H.pylori ассоциированный гастрит [1]. Чем выше оптическая плотность, тем тяжелее гастрит. В настоящем исследовании титр антител IgG был значительно выше у пациентов, несущих cag A-позитивных штаммов H. pylori . Это согласуется с данными литературы [16]. Это говорит о том, что высоту титра антител IgG можно использовать в качестве маркера наличия вирулентного, то есть cag A-позитивного штамма H. pylori . Однако из литературных данных выяснилось, что наличие cag A не всегда связано с более тяжелым гастритом [17].В повседневной практике рост титра антител IgG не может предсказать, несет ли человек штамм cag A-позитивный H. pylori , так как титры антител IgG перекрываются между cag A-позитивными и cag A- отрицательные пациенты присутствуют. Другими словами, если врач хочет знать, есть ли у пациента cag A-позитивный H. pylori , лучший способ установить это — серологическое обнаружение антител CagA. Удивительно, но пациенты с cagA-положительными H.pylori были моложе, чем cagA-негативы. Объяснение этому не очевидно. Однако возможным смешивающим фактором может быть тот факт, что пациенты с активной язвенной болезнью и раком были исключены из исследования, следовательно, присутствует систематическая ошибка отбора.
Пациенты с предшествующей язвенной болезнью и штаммом cag A-положительным имели более высокий титр антител IgG, чем пациенты со штаммом cag A, но это не достигло статистической значимости, вероятно, из-за небольшого числа в обеих группах .Однако это является показанием к применению более вирулентных штаммов у большинства пациентов с язвенной болезнью.
Список литературы
[1](
1989
)Диагностическая ценность иммуноанализа для выявления антител против Campylobacter pylori при неязвенной диспепсии
.Ланцет
i
,1182
—1185
. [2]и другие. . (
1996
)cag остров патогенности Helicobacter pylori
. В:Helicobacter pylori Основной механизм клинического лечения
(, ред.), Стр.40
—49
.Kluwer
,Dordrecht
. [3]и другие. (
1996
)Cag, остров патогенности Helicobacter pylori , кодирует факторы вирулентности
, специфичные для типа I и связанные с заболеванием.Proc. Natl. Акад. Sci. США
93
,14648
—14653
. [4](
1996
)Взаимосвязь между цитотоксин-ассоциированным геном-A и вакуолизирующим цитотоксином и Helicobacter pylori заболеваниями
.J. Infect. Дис.
173
,1171
—1175
. [5]и другие. (
1991
)Распознавание IgA слизистой оболочки Helicobacter pylori Белок 120 кДа, язвенная болезнь желудка и патология желудка
.Ланцет
338
,332
—335
. [6](
1997
)Гены, ассоциированные с вирулентностью, как маркеры разнообразия штаммов в инфекции Helicobacter pylori
.J. Gastroenterol. Гепатол.
12
,666
—669
. [7](
1998
)Клинические и гистологические ассоциации генотипов cagA и vacA при гастрите Helicobacter pylori
.J. Clin. Патол.
51
,55
—61
. [8](
1997
)Лимфома желудка MALT-типа связана с штаммами Helicobacter pylori , экспрессирующими белок CagA
.Гастроэнтерология
112
,1482
—1486
. [9]и другие. (
1997
)Эффект эрадикации Helicobacter pylori на гастрит в связи с cagA: проспективное последующее исследование через год
.Гастроэнтерология
113
,25
—30
. [10](
1997
)Сывороточные антитела против Helicobacter pylori белков VacA и CagA связаны с повышенным риском развития аденокарциномы желудка
.Dig. Дис. Sci.
42
,1652
–1659
. [11](
1999
)Наличие антител к CagA у детей не является маркером конкретного заболевания
.J. Pediatr. Гастроэнтерол. Nutr.
28
,71
—75
. [12](
1999
)Cag Положительная инфекция штамма H. pylori защищает от гастроэзофагеальной рефлюксной болезни (ГЭРБ)
.Гастроэнтерология
116
,A239
. [13](
1993
)Обзор диагностических методов диагностики инфекции Helicobacter pylori
.Dig. Дис.
11
,173
—180
. [14]и другие. (
1989
)Значение серологии (ELISA и иммуноблоттинг) для диагностики инфекции Campylobacter pylori
.Пищеварение
44
,131
—141
. [15](
1995
)Заражение штаммами Helicobacter pylori , обладающими Cag A, связано с повышенным риском развития аденокарциномы желудка
.Cancer Res.
55
,2111
—2115
. [16](
1999
)Воспаление желудка усиливается у детей с cag A-позитивной инфекцией Helicobacter pylori
.Pediatr. Заразить. Дис. J.
18
,337
—341
. [17](
1996
)Сывороточные антитела CagA у субъектов с симптомами и пациентов с язвенной болезнью: отсутствие корреляции антител IgG у пациентов с язвенной болезнью или бессимптомным Helicobacter pylori гастрит
.J. Clin. Патол.
49
,829
—832
.© 2000 Федерация европейских микробиологических обществ.
LAB.00034 Тестирование серологических антител к Helicobacter Pylori
LAB.00034 Тестирование серологических антител к Helicobacter Pylori| Медицинская политика |

 pylori определяются через 2-4 недели после заражения;
pylori определяются через 2-4 недели после заражения;