защита, здоровое пищеварение и др
Гистидин – аминокислота, входящая в состав белков и выполняющая в организме множество важных функций. Она считается условно-незаменимой, т.к. может синтезироваться в организме взрослых людей, но в количестве, недостаточном для нормального жизнеобеспечения. Для детей данная аминокислота является незаменимой и должна поступать с пищей.
Гистидин хорошо всасывается в желудочно-кишечном тракте: почти 60% гистидина поступает в кровь сразу из кишечника и отправляется работать.
Функции гистидина
- Предшественник для синтеза биогенного амина гистамина
- Предшественник для синтеза дипептидов карнозина и ансерина
- Участие в синтезе белков
- Защита от повреждающих факторов
- И много чего еще
Синтез гистамина
Гистамин – биогенный амин, обладающий регуляторными функциями.
Синтез гистамина из гистидина происходит
- В тучных клетках, расположенных в соединительной ткани. Там он образует комплекс с белками и сохраняется в секреторных гранулах.
- В клетках белой крови: базофилах и эозинофилах
- В клетках желудочно-кишечного эпителия
Гистамин образуется при декарбоксилировании гистамина под влиянием фермента гистидиндекарбоксилазы при участии витамина В-6 (пиридоксальфосфата).
Основные функции гистамина
- Защитная: как медиатор воспаления защищает организм от воздействия агрессивных факторов внешней среды
- Повышает проницаемость капилляров, в результате чего возникают отеки.
- Снижает артериальное давление, но увеличивает внутричерепное давление, что провоцирует головную боль
- Сокращает гладкую мускулатуру бронхов, вплоть до удушья
- Участвует в формировании воспалительной реакции: вызывает расширение сосудов, покраснение кожи, отеки
- Является медиатором боли
- Является пищеварительным гормоном: стимулирует выделение слюны и желудочного сока
- Является нейромедиатором, ответственным за регуляцию сна и бодрствования: активирует нервные клетки, противодействует сну
- Участвует в механизмах эрекции у мужчин
При воздействии повреждающих факторов: ожог, ранение, травма, действие токсинов микроорганизмов, воздействие аллергенов и др. гистамин выходит из тучных клеток в межклеточное пространство и кровь, вызывая воспалительную реакцию.
Скажете, а зачем нам такое счастье, как боль, отек и удушье? Но надо понимать, что это патологические реакции, а в норме гистамин помогает организму мобилизовать защиту при повреждении агрессивными внешними факторами или биологическими агентами. Расширение сосудов способствует притоку крови, а с кровью приходят солдаты – иммунные клетки. Спецназ – лимфоциты-киллеры атакуют зловредных бактерий и вирусов, а строй.бат – макрофаги начинают разбирать завалы из отмерших клеток, перерабатывая осколки мембран, обрывки белков, расчищая площадку для нового строительства – репарации поврежденной ткани.
Часто бывает и так, что повреждение, вызванное воспалением в связи с выбросом гистамина, превышает вред от действия агрессивных факторов внешней среды. Это похоже на то, что проникшую в город банду террористов, которые отстреливают случайных путников, правительство решило уничтожить, сбросив атомную бомбу. И это не преувеличение. Такие грозящие смертельным исходом реакции, как анафилактические шок или острый эпидермонекролиз (синдром Лайела), когда кожа сходит, будто ошпаренная – это тоже работа гистамина. Чаще действие гистамина напоминает борьбу с террористами путем разрушения города установкой «Град» — это аллергические и аутоиммунные заболевания. В ответ на внедрение какой-нибудь растительной пыльцы, которая не угрожает благополучию города-организма, начинается выраженная реакция: отек слизистой носа, слезотечение, насморк, удушье. Вся эта радость – тоже действие гистамина, но это действие не на пользу, а во вред.
Гистамин – основной медиатор воспаления, в т.ч. он ответственен за развитие аллергических реакций.
Синтез дипептидов карнозина и ансерина
Дипептиды карнозин и ансерин образуются в мышцах и головном мозге, причем их содержание в скелетных мышцах особенно велико и достигает 100-200 мг\на 100 г. мышечной ткани.
Карнозин был впервые обнаружен русским ученым В.С.Гулевичем в 1900 г., в последующим другой русский биохимик С.Е…Северин изучал его биологическую роль, сделав солидный подарок спортсменам и бодибилгерам.
Оказалось, что дипептиды являются чудо-соединениями, которые восстанавливают работоспособность утомленной мышцы. Этот процесс был назван «феномен Северина». Кроме того, дипептиды карнозин и ансерин связывают вещества, которые могут отравлять клетку: это и избыток протонов (активных ионов водорода), и тяжелые металлы, и активные формы кислорода, т.е. дипептиды выступают мощными антиоксидантами. Они защищают клетки от радиактивного облучения, тормозят клеточное старение. Они увеличивают иммунитет, способствуют быстрому заживлению ран. Они защищают нервные клетки от токсического действия глутамата.
Подробнее о чудо-дипептидах читайте здесь: http://zaryad-zhizni.ru/beta-alanin-dlya-sportsmenov-i-ne-tolko/
Для повышения синтеза чудо-дипептидов нет нужды обогащать диету продуктами, богатыми гистидином. Гистидина организму хватает, а вот β-аланин требуется в избытке.
Синтез белков
Гистидин участвует в синтезе множества белков, чем обуславливается его важная роль в организме.
- Каталитическая.
Гидрофильная аминокислота, имеющая дополнительную аминную группу, гистидин легко вступает в реакции, чем обусловлена его роль суперкатализатора. Он входит в активные центры множества ферментов, в т.ч. рибонуклеазы и транскетолазы
- Структурная
- Остатки метилированного гистидина являются составной частью мышечных белков актина и миозина. При их расщеплении, образуется 3-метилгистидин, который выводится почками с мочой. Количество выводимого почками 3-метилгистидина является показателем деградации мышечных белков и является индикатором азотистого баланса организма
- Гистидин входит в состав красных и белых кровяных телец. Гем связан с белком глобином через гистидиновые остатки. Дефицит гистидина ведет к анемии – снижению количества эритроцитов (красных кровяных телец) в крови.
- Гистидин помогает формировать миелиновые оболочки нервных клеток – своеобразные биологические изоляторы, которые способствуют нормальному прохождению электрического сигнала по нервному волокну. Повреждение миелиновых оболочек вызывает нейродегенеративные заболевания, такие как рассеянный склероз, болезнь Паркинсона и болезнь Альцгеймера.
Превращения гистидина
Свободный гистидин в организме распадается по двум путям:
- Отщепление аминной головы ферментом гистидиназой с образованием уроканиновой кислоты
- Отщепление карбоксильного хвоста ферментом гистидиндекарбоксилазой с образованием биогенного амина — гистамина
Трансформация гистидина по первому пути осуществляется в печени и коже. Конечными продуктами расщепления уроканиновой кислоты являются глутаминовая кислота (глутамат) и муравьиная кислота. Реакция отщепления аминной головы необратима.
В слизистой желудка и кишечника содержится фермент гистидиндекарбоксилаза, который превращает гистидин в гистамин. Избыточное поступление гистидина с пищей активирует фермент, и лишний гистидин преобразуется в гистамин. Этот гистамин называется эндогенным. Около 5% гистамина поступает с пищей и является экзогенным. Гистамин в пищеварительном тракте защищает слизистую желудка и кишечника от повреждений, способствует заживлению эрозий и язв. Избыток гистамина выводится с мочой.
Глутаминовая кислота необходима для синтеза гистидина, а гистидин является источником для синтеза глутамата. Так замыкается аминокислотный круг. Глутамат участвует в синтезе белков соединительной ткани: коллагена и эластина, а эти белки необходимы для построения всего опорного скелета, как внутреннего – кости, связки, внутренний каркас для органов и тканей, так и внешнего — кожи.
Становится понятным, почему без гистидина невозможен рост и развитие организма, а также его ведущая роль для детей, у которых эти процессы особенно интенсивны. Гистидин координирует процессы роста и развития, важен для роста костей и мышц. Он способствует быстрому заживлению ран, ускоряет восстановление после травм, заболеваний, хирургических операций.
Подвергаясь трансформациям, гистидин в образует α-кетоглуторат, который, сгорая в цикле Кребса, может подвергаться дальнейшему расщеплению до цитрата (лимонной кислоты) с образованием энергии. По участию в энергетическом цикле трикарбоновых кислот (цикле Кребса) гистидин относят к глюкогенным аминокислотам.
Гистидин – защитник от вредных факторов
- Входит в состав белых кровяных телец, улучшает иммунитет, обеспечивает защиту от инфекций.
- Снижает остроту аллергических реакций
- Поглощает ультрафиолетовые лучи,
- Защищает организм от радиации
- Выводит тяжелые металлы
Другие функции гистидина
- Способствует притоку крови ко внутренним органам, за счет чего улучшается либидо.
- Регулирует свертывающую систему крови
- Повышает стрессоустойчивость, борется с депрессией
- Улучшает работу печени, является гепатопротектором, эффективен в лечении паренхиматозного гепатита
- Уменьшает болевые ощущения при гастритах, язвенной болезни желудка, способствует заживлению язв и эрозий пищеварительного тракта, останавливает кровотечения
- Поддерживает функцию слухового нерва
- Поддерживает здоровье кожи и гибкость суставов
Аминокислота гистидин – необходима для здоровья и долголетия, но ее применение в качестве лекарственного средства имеет множество противопоказаний.
О том, в каких продуктах содержится гистидин, читайте здесь: http://zaryad-zhizni.ru/gistidin-v-produktah-pitaniya/
— по карбоксигруппе — Биохимия
Синтез биогенных аминов (нейромедиаторов) из аминокислот связан с вовлечением в метаболизм α-карбоксильной группы аминокислот или, проще говоря, ее удалением.
Гистамин
Реакция образования гистамина наиболее активно идет в тучных клетках легких, кожи, печени, базофилах и эозинофилах. В них гистамин синтезируется и накапливается в секреторных гранулах.
Реакция синтеза гистамина
В кровь гистамин выделяется при повреждении ткани, при ударе, при электрическом раздражении. В клинической практике секреция гистамина обычно связана с аллергиями – при повторном попадании антигена в ранее сенсибилизированный организм развивается аллергическая реакция.
Физиологические эффекты
- расширение артериол и капилляров и, как следствие, покраснение кожи, снижение артериального давления;
- повышение проницаемости стенки капилляров и, как следствие, выход жидкости в межклеточное пространство (отечность), снижение артериального давления;
- если предыдущие пункты имеют место в головном мозге – повышение внутричерепного давления;
- увеличивает тонус гладких мышц бронхов, как следствие – спазм и удушье;
- слабо повышает тонус мышц желудочно-кишечного тракта;
- стимулирует секрецию слюны и желудочного сока.
Серотонин
Серотонин активно синтезируется в тучных клетках кожи, легких, печени, в селезенке, ЦНС.
Реакции синтеза серотонина
Физиологические эффекты
- стимулирует сокращение гладких мышц желудочно-кишечного тракта и, как следствие, повышение перистальтики ЖКТ;
- выражено стимулирует сокращение гладких мышц сосудов, кроме сосудов миокарда и скелетных мышц и, как следствие, повышение артериального давления;
- слабо увеличивает тонус гладких мышц бронхов;
- в центральной нервной системе является тормозным медиатором;
- в периферических нервных окончаниях обусловливает возникновение боли и зуда (например, при укусе насекомых).
Гамма-аминомасляная кислота
Синтез γ-аминомасляной кислоты (ГАМК) происходит исключительно в центральной нервной системе в подкорковых образованиях головного мозга.Реакция синтеза ГАМК
Физиологические эффекты
В центральной нервной системе ГАМК (наряду с глутаминовой кислотой) является тормозным медиатором. Наиболее высока ее роль в височной и лобной коре, гиппокампе, миндалевидных и гипоталамических ядрах, черной субстанции, ядрах мозжечка.
Дофамин
Синтез дофамина происходит в основном в нейронах промежуточного и среднего мозга.
Реакции синтеза дофамина
Физиологические эффекты
Является медиатором дофаминовых рецепторов в подкорковых образованиях ЦНС, в больших дозах расширяет сосуды сердца, стимулирует частоту и силу сердечных сокращений, расширяет сосуды почек, увеличивая диурез.
Гистамин Википедия
| Гистамин | |||
|---|---|---|---|
| |||
| Систематическое наименование | 4-(2-Аминоэтил)-имидазол, или β-имидазолил-этиламин | ||
| Традиционные названия | Гистамин | ||
| Хим. формула | C5H9N3 | ||
| Рац. формула | C1=C(NC=N1)CCN | ||
| Молярная масса | 111,15 г/моль | ||
| Температура | |||
| • плавления | 83,5 °C (182,3 °F) | ||
| • кипения | 209,5 °C (409,1 °F) °C | ||
| Рег. номер CAS | 51-45-6 | ||
| PubChem | 774 | ||
| Рег. номер EINECS | 200-100-6 | ||
| SMILES | |||
| InChI | |||
| ChEBI | 18295 | ||
| Номер ООН | <— номер UN —> | ||
| ChemSpider | 753 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |||
Гистамин, также имидазолил-2-этиламин — органическое соединение, биогенный амин, медиатор аллергических реакций немедленного типа, также является регулятором многих физиологических процессов.
Тема 9.13. Биогенные амины: синтез, инактивация, биологическая роль
1. Некоторые аминокислоты и их производные могут подвергаться
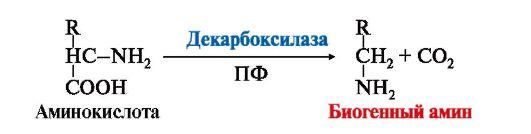 Биогенные
амины являются биологически активными
веществами, выполняют функцию
нейромедиаторов (серотонин, дофамин,
ГАМК), гормонов (адреналин), регуляторных
факторов местного действия (гистамин).
Биогенные
амины являются биологически активными
веществами, выполняют функцию
нейромедиаторов (серотонин, дофамин,
ГАМК), гормонов (адреналин), регуляторных
факторов местного действия (гистамин).
2. В нервных клетках декарбоксилирование глутамата приводит к образованию γ-аминомасляной кислоты (ГАМК), которая являетсяосновным тормозным медиатором. Инактивации ГАМК происходит либо путем трансаминирования и превращения в сукцинат, являющийся метаболитом ЦТК, либо окислительным путем под действием моноаминооксидазы (МАО)
(рис. 9.25).
 Рис.
9.25. Схема синтеза и инактивации ГАМК
Рис.
9.25. Схема синтеза и инактивации ГАМК
ГАМК в виде препаратов гаммалон или аминалон применяют при нарушениях мозгового кровообращения, умственной отсталости, эндогенных депрессиях и травмах головного мозга.
3. В нервной ткани из серина синтезируется ацетилхолин, который также относится к биогенным аминам:
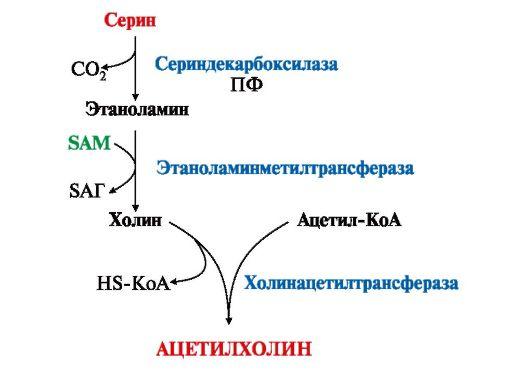 Нарушение
образования ацетилхолина в синапсах
может вызватьмиастению — мышечную
слабость.
Нарушение
образования ацетилхолина в синапсах
может вызватьмиастению — мышечную
слабость.
4. Серотонин — нейромедиатор проводящих путей, образуется в гипоталамусе, надпочечниках из аминокислоты триптофана:
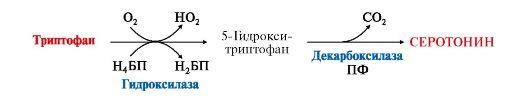 Серотонин представляет
собой биологически активное вещество
широкого спектра действия. Он стимулирует
сокращение гладкой мускулатуры,
перистальтику кишечника, оказывает
сосудосуживающий эффект, регулирует
артериальное давление, температуру
тела, дыхание, обладает антидепрессантным
действием («гормон удовольствия»),
принимает участие в аллергической
реакции, поскольку в небольших количествах
синтезируется в тучных клетках.
Серотонин представляет
собой биологически активное вещество
широкого спектра действия. Он стимулирует
сокращение гладкой мускулатуры,
перистальтику кишечника, оказывает
сосудосуживающий эффект, регулирует
артериальное давление, температуру
тела, дыхание, обладает антидепрессантным
действием («гормон удовольствия»),
принимает участие в аллергической
реакции, поскольку в небольших количествах
синтезируется в тучных клетках.
5. К биогенным аминам относятся и катехоламины (дофамин, норадреналин и адренамин) (см. рис. 9.23, В).
Таблица 9.7. Биологическая роль и предшественники некоторых биогенных аминов
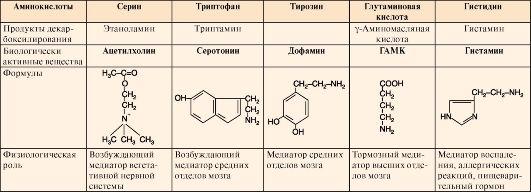 6.
Инактивация биогенных аминов происходит
двумя путями:
6.
Инактивация биогенных аминов происходит
двумя путями:
• метилирование с участием SAM под действием метилтрансфераз — характерно для гистамина, адреналина, норадреналина:
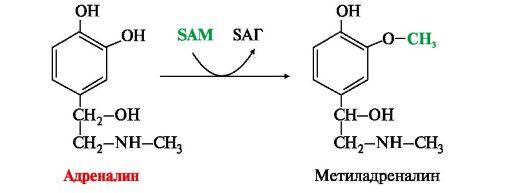 окисление ферментами моноаминооксидазами
(МАО) с
коферментом FAD — характерно для дофамина,
норадреналина, серотонина, ГАМК.
окисление ферментами моноаминооксидазами
(МАО) с
коферментом FAD — характерно для дофамина,
норадреналина, серотонина, ГАМК.
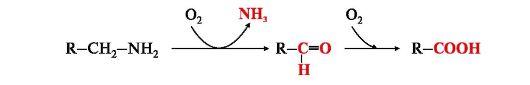
При окислении биогенных аминов происходит дезаминирование и образование альдегида, а затем кислоты, которые выводятся почками:
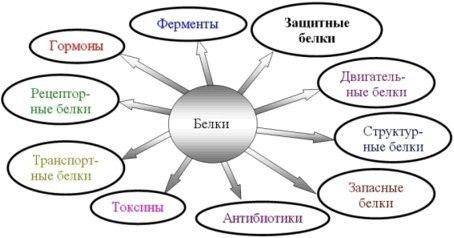
1. Белки являются одним из важнейших элементов живого организма, именно поэтому мы начнем с описания роли и строения именно этого класса биоорганических соединений. Белки в организме выполняют следующие функции: 1. Структурная или пластическая функция. Белки являются универсальным строительным материалом, из которого состоят практически все структуры живых клеток. Например, в организме человека белки составляют около 1/6 от массы тела. Причем, у тренированных людей с хорошо развитыми мышцами эта цифра может быть и выше. 2. Каталитическая функция. Многие белки, называемые ферментами или энзимами, выполняют в живых системах функцию катализаторов, то есть изменяют скорости протекания химических реакций (о чем подробно будет сказано ниже). 3. Сократительная функция. Именно белковые молекулы лежат в основе всех форм движения живых систем. Мышечное сокращение = это, прежде всего работа белков. 4. Регуляторная функция. В основе этой функции лежит способность белковых молекул реагировать и с кислотами и основаниями, называемых в химии амфотерностью. Белки участвуют в создании гомеостаза(поддержание постоянства внутренней стреды) организма. Многие белки являются гормонами. 5. Рецепторная функция. В основе этой функции лежит способность белков реагировать на возникающие изменения условий внутренней среды организма. Различные рецепторы в организме, чувствительные к температуре, давлению, освещенности являются белками. Рецепторы гормонов – это тоже белки. 6. Транспортная функция. Белковые молекулы имеют большой размер, хорошо растворимы в воде, что позволяет им легко перемещаться по водным растворам и переносить различные вещества. Например, гемоглобин переносит газы, альбумины крови переносят жиры и жирные кислоты. 7. Защитная функция. Белки защищают организм, прежде всего, участвуя в создании иммунитета. 8. Энергетическая функция. Белки не являются главными участниками энергетического обмена, но все же до 10% суточной потребности организма в энергии обеспечивают именно они. В то же время, это слишком ценный продукт, чтобы использовать его, как источник энергии. Поэтому белки используются в качестве источника энергии только после углеводов и жиров.
По материал Интернет
Изучение проблемы нормы белка в питании человека имеет, кроме академического интереса, большое социальное значение. Принятые в нашей стране нормы белка для взрослого человека и для детей разного возраста основаны на результатах многочисленных научных исследований отечественных ученых, учитывают разные климатические условия, условия труда, профессию, возраст и другие факторы. Эти нормы выводятся из оптимального содержания белка в пищевом рационе. Так, взрослый человек, занимающийся умственным трудом или подвергающийся средней физической нагрузке (полностью механизированный труд), должен получать 100–120 г белкав сутки при трате общего количества энергии 12000 кДж. При изменении условий труда (недостаточно механизированный труд) и больших тратах энергии нормабелка увеличивается на 10 г на каждые 2100 кДж. Рабочие, выполняющие тяжелую физическую работу, должны получать 130–150 г белка в сутки.
Потребности в белках детей определяются в первую очередь возрастом и массой тела. Дети даже раннего детского возраста нуждаются в 55–72 г белка в сутки. С возрастом (от 12 до 15 лет) эта норма увеличивается до суточной нормы взрослого человека. Суточные потребности в белке резко возрастают прибеременности и лактации, а также при некоторых патологических состояниях, когда организм теряет белок с мочой или асцитной жидкостью, экссудатами при нефритах, тяжелых инфекционных заболеваниях, ожогах, травмах и т.д.
На долю аминокислот (в составе белков и свободных) приходится более 95 % всего азота организма. Поэтому об общем состоянии аминокислотного и белкового обмена можно судить по азотистому балансу, т. е. разнице между количеством азота,поступающего с пищей, и количеством выделяемого азота (главным образом в составе мочевины).
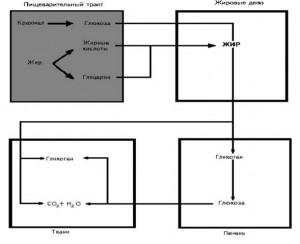
Азотистый баланс — схема.
У взрослого здорового человека при нормальном питании имеет место азотистое равновесие, т. е. количество выделяемого азота равно количеству поступающего. В период роста организма, а также при выздоровлении после истощающих заболеваний выводится азота меньше, чем поступает, — положительный азотистый баланс. При старении, голодании и в течение истощающих заболеваний азота выводится больше, чем поступает, — отрицательный азотистый баланс. При положительном азотистом балансе часть аминокислот пищи задерживается в организме, включаясь в состав белков и клеточных структур; общая масса белков в организме увеличивается. Наоборот, при отрицательном азотистом балансе общая масса белков уменьшается (катаболическое состояние). Если из диеты исключить все белки, но полностью сохранить другие компоненты в количествах, обеспечивающих энергетические потребности организма, то азотистый баланс становится отрицательным. Примерно через неделю пребывания на такой диете количество выводимого азота стабилизируется, достигая величины около 4 г за сутки. Такое количество азота соответствует 25 г белка (или аминокислот). Следовательно, при белковом голодании организм ежесуточно расходует около 25 г белков собственных тканей. Практически такой же результат получается при исключении из диеты не всех белков, а только незаменимых аминокислот или даже только одной из них. При полном голодании отрицательный азотистый баланс еще больше, чем при исключении из пищи только белков. Это обусловлено тем, что аминокислоты, образующиеся при распаде тканевых белков, при полном голодании используются также и для обеспечения энергетических потребностей организма. В рационе, достаточном по калорийности, минимальное количество белков, необходимое для поддержания азотистого равновесия, составляет 30-50 г. Однако это количество не обеспечивает оптимума для здоровья и работоспособности. Взрослый человек при средней физической нагрузке должен получать о100коло 100 г белков в сутки.
2. В пищевых продуктах содержание свободных аминокислот очень мало. Подавляющее их количество входит в состав белков, которые гидролизуются
461
в ЖКТ под действием ферментов протеаз (пептидщцролаз). Субстратная специфичность этих ферментов заключается в том, что каждый из них с наибольшей скоростью расщепляет пептидные связи, образованные определёнными аминокислотами. Протеазы, гидролизующие пептидные связи внутри белковой молекулы, относят к группе эндопептидаз. Ферменты, относящиеся к группе экзопептидаз, гидролизуют пептидную связь, образованную концевыми аминокислотами. Под действием всех протеаз ЖКТ белки пищи распадаются на отдельные аминокислоты, которые затем поступают в клетки тканей.
А. Переваривание белков в желудке
Желудочный сок — продукт нескольких типов клеток. Обкладочные (париетальные) клетки стенок желудка образуют соляную кислоту, главные клетки секретируют пепсиноген. Добавочные и другие клетки эпителия желудка выделяют муцинсодержащую слизь. Париетальные клетки секретируют в полость желудка также гликопротеин, который называют «внутренним фактором» (фактором Касла). Этот белок связывает «внешний фактор» — витамин В12, предотвращает его разрушение и способствует всасыванию.
ГИСТАМИН — Большая Медицинская Энциклопедия
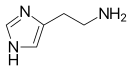
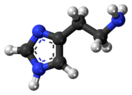
ГИСТАМИН (бета-имидазолин-4(5)-этиламин) — биогенный, физиологически активный гетероциклический амин, C5H9N3; участвует в осуществлении аллергических реакций в качестве медиатора, используется как лекарственное средство. Структурная формула:

Синтезирован в 1907 г. из имидазолпропионовой к-ты А. Виндаусом и Фогтом (W. Voght). В 1909 г. Г. Дейл и Лейдлоу (P. Laidlaw) извлекли гистамин из спорыньи.
В организм человека и животных Г. в незначительных количествах (менее 5%) поступает с пищей (напр., молоко содержит его 0,5 мкг/мл, мясо — 0,5 мкг/г, хлеб — 0,1 мкг/г). Часть Г. образуется в кишечнике из гистидина (см.) под влиянием бактериальной гистидиндекарбоксилазы (КФ 4. 1. 1. 22). Избыточное поступление гистидина с пищей (напр., при преимущественно мясной диете) активирует бактериальную гистидиндекарбоксилазу. Избыток образовавшегося при этом Г. выводится с мочой. Гистамин, образующийся в кишечнике, называют экзогенным (см. схему).
 Схема образования и метаболизма гистамина
Схема образования и метаболизма гистаминаБольшая часть Г. синтезируется в клетках организма путем декарбоксилирования гистидина тканевой гистидиндекарбоксилазой. Ее коферментом является пиридоксаль-5′-фосфат, сильным ингибитором — альфа-метилгистидин. Г., образованный в клетках, называют эндогенным гистамином.
Почти все органы человека и животных содержат Г. Количество его сильно варьирует в разных тканях и у разных видов животных: в легких обезьян до 100 мкг/г, в коже человека ок. 30 мкг/г (А. Д. Адо, 1970). В мозге больше всего Г. обнаруживают в гипоталамусе и гипофизе. Мало его в таламусе, продолговатом и спинном мозге. Основная масса Г. в тканях находится в неактивном состоянии в виде лабильных комплексов с белками, гепарином, сернокислыми полисахаридами, нуклеиновыми к-тами, фосфатидами. Различают две формы депонирования связанного Г. Первая — депонирование в тучных клетках соединительной ткани, где связь Г. с белково-гепариновым комплексом относительно устойчива и освобождение его происходит под влиянием определенных веществ, так наз. либераторов. Вторая форма — депонирование в тканях, бедных тучными клетками, в клетках самого органа, напр, в легких, слюнных железах, слизистой оболочке желудка. Эти органы обычно имеют высокую гистаминообразующую способность, и Г. освобождается из клеток под влиянием физиол, стимулов, напр, под влиянием раздражения холинергических нервных волокон. В крови Г. преимущественно связан с гранулами базофилов и эозинофилов, часть Г. может образовывать комплекс с гамма-глобулинами. Небольшие количества Г. постоянно находятся в крови и других биол, жидкостях В свободном состоянии. Содержание свободного Г. в цельной крови здоровых людей колеблется, по данным разных авторов, от 20 до 100 нг/мл, а в плазме от 0 до 5 нг/мл. При различных патол, процессах содержание свободного Г. в крови может резко увеличиться. Однако высокой фармакол, активности свободного Г. противодействуют механизмы его разрушения в организме и выведение его метаболитов с мочой (см. схему).
Основными путями инактивирования Г. в организме являются окислительное дезаминирование с помощью пиридоксалевого фермента гистаминазы (см. Диаминоксидаза) с образованием имидазолуксусной к-ты и рибозида имидазолуксусной к-ты и метилирование имидазольного кольца Г. с помощью гистамин-метилтрансферазы (КФ 2. 1. 1. 8). Метил гистамин является основным метаболитом Г. у многих видов животных и человека. Часть образованного метилгистамина выводится непосредственно с мочой, часть окисляется моноаминоксидазой (КФ 1. 4. 3. 4) и выводится в виде 1-метилимидазол-4-уксусной к-ты. Таков же путь нейтрализации Г. в тканях мозга. Нейтрализация Г. может осуществляться также с помощью ацетилирования, к-рое происходит при участии ацетилирующего фактора, скорее всего являющегося КоА. Этот путь нейтрализации Г. не имеет большого значения в тканях теплокровных животных, ацетилирование Г. происходит, в основном, в кишечнике под влиянием кишечной флоры; образующийся ацетилгистамин выводится с мочой.
Физиол, роль Г. не совсем ясна и продолжает изучаться. Действие Г. проявляется на месте его образования и освобождения. Физиол, активностью в наибольшей степени обладает эндогенный Г., образующийся вне тучных клеток [по терминологии Шайера (R. Schayer, 1968), «индуцированный» Г.]. В жел.-киш. тракте, по данным Броди (В. Brodie, 1966), Г. играет роль гуморального посредника в секреции слизи, пищеварительных ферментов и соляной к-ты. А. М. Чернухом установлена роль Г. в регуляции микроциркуляции и поддержании гомеостаза. Г. участвует в передаче нервного импульса. Есть сведения об участии Г. в регуляции процессов роста (эмбрионального роста, регенерации тканей).
Гистамин как медиатор аллергических реакций
Г. участвует в реализации патохимических и патофизиол. стадий аллергических реакций.
Повышение содержания свободного Г. в крови и лимфе грудного протока при анафилактическом шоке показали впервые Фелдберг (W. Feldberg, 1932) и Драгстедт (С. Dragstedt, 1932). С тех пор этот факт подтвержден многочисленными экспериментами и клин, исследованиями и стал основным доказательством так наз. гистаминной теории анафилаксии (см.) и аллергии (см.). В пользу этой теории говорили и следующие факты: Г., введенный животным извне, вызывает состояние, схожее с анафилактическим шоком, оказывает на изолированные гладко-мышечные органы животных (тонкая кишка, рог матки, ткани бронхов) такое же действие, как и специфический аллерген, т. е. вызывает анафилактическую контрактуру, к-рую снимают антагонисты Г.; после перенесения анафилактического шока в тканях уменьшается число тучных клеток, являющихся основными депо связанного Г.
В то же время есть и факты, противоречащие признанию Г. в качестве универсального медиатора анафилаксии. Напр., шок, возникающий при введении Г. в кровь животных, не всегда идентичен анафилактическому; антагонисты Г., предупреждающие развитие гистаминового шока, не всегда и не в полной мере снимают анафилактический шок; при анафилактическом шоке из тканей освобождается не только Г., но и другие биологически активные вещества: гепарин, серотонин, медленно реагирующая субстанция [Остин (К. F. Austen), 1974], кинины; некоторые сенсибилизированные ткани (нервная, гладкие мышцы) возбуждаются аллергеном непосредственно, без участия Г. как промежуточного звена; гистаминовый шок не сопровождается десенсибилизацией животного к последующему введению Г., как это наблюдается при анафилактическом шоке; при анафилактическом шоке свертываемость крови снижается, а Г. ее повышает (А. Д. Адо, 1970).
Таким образом, Г. не является универсальным медиатором для всех случаев аллергии, но играет роль важного промежуточного ’эвена при многих аллергических реакциях. Известно участие Г. в механизме некоторых аллергических заболеваний человека (атопической и инфекционно-аллергической бронхиальной астмы, крапивницы, отека Квинке, поллинозов, аллергического риносинусита, дерматозов и т. д.), сопровождающихся изменением содержания Г. в крови, изменением активности гистаминазы и других ферментов, разрушающих Г., и появлением Г. и его метаболитов в моче в большем против нормы количестве [Э. Райка (E. Rajka), 1966; И. Л.Вайсфельд, 1969; Т. С. Соколова, 1971].
Роль Г. в реакциях при аллергии замедленного типа неясна. Однако Шильд (H. О. Schild, 1967), H. Д. Беклемишев (1968) и др. считают возможным участие Г. в некоторых ее проявлениях, напр, в туберкулиновой реакции и контактном дерматите. Обнаружены колебания содержания связанного Г. в тканях и усиление гистаминообразующей способности кожи. Но явления эти кратковременны и обнаруживаются преимущественно в ранние сроки, когда клеточные и тканевые реакции еще не успели развернуться. Шайер (1963) считает, что усиление образования Г. при замедленной аллергии происходит в результате действия гистидин декарбоксил азы, обеспечивающей появление так наз. «индуцированного» Г. (по терминологии Шайера), действие к-рого направлено на регуляцию микроциркуляции и поддержание т. о. в тканях необходимого количества крови.
Увеличение содержания Г. в сенсибилизированных тканях за счет усиления его образования из гистидина хорошо известно и в реакциях немедленной аллергии [Кальсон (G. Kahlson) и соавт., 1964]. Гистаминообразующая способность в сенсибилизированных тканях по сравнению с нормальными повышается с различной интенсивностью и скоростью. В легких, печени и коже максимум образования Г. наблюдается через 3—6 час. после действия аллергена, в селезенке и кишечнике — через 24 часа и более. Образование Г. может продолжаться многие часы, а то и дни. Количество образовавшегося Г. не зависит от насыщенности органа тучными клетками. В аорте, где их мало, Г. образуется столь же интенсивно, как и в коже, где тучных клеток много.
Новообразующийся Г. физиологически лабилен, легко высвобождается из места образования и обнаруживается в жидкостях организма. Метаболиты его выводятся с мочой.
Другим источником свободного Г. в жидких средах организма является его высвобождение из связанного состояния в тучных клетках соединительной ткани и базофилах крови, в которых депонирована большая часть запасов Г. организма. В тучных клетках, напр., его содержится 20—30 мкг на 106 клеток; из тучных клеток и базофилов Г. освобождается под действием либераторов. Патон (W. Paton, 1958), Б. Альперн (1973) делят либераторы Г. на две группы: низкомолекулярные вещества (моноамины, диамины, диамидины, замещенные ароматические амины, аммоний, d-тубокурарин, морфин и др.) и высокомолекулярные (декстраны, овомукоиды, пептоны, поливинилпирролидин, вещество 48/80, Твин-20, полимиксин, протеолитические ферменты, яды и токсины, комплексы антиген—антитело). Свойствами либераторов обладают многие белки, в т. ч. белки сыворотки крови.
При действии либераторов на клетки происходит выброс гранул (единичных или массами) из клетки (дегрануляция) и выход из них Г. и других биологически активных веществ (гепарина, серотонина, протеаз).
По механизму действия либераторы Г. разделяют [Стануорт (D. R. Stanworth), 1974] на неизбирательные (цитотоксические) агенты, напр, октиламин, дециламин, хлорпромазин, Тритон Х-100, мелиттин, и избирательные (нецитотоксические) агенты, напр, вещество 48/80, комплекс антиген — антитело, некоторые полипептиды с основными свойствами и пр. Вещества второй группы вызывают высвобождение Г. без разрушения тучных клеток. На это указывает отсутствие выхода ионов К+ и внегранулярных цитоплазматических включений (АТФ, лактатдегидрогеназы) из тучных клеток при высвобождении из них Г., вызванном специфическим антигеном, а также сохранение мембранного потенциала тучных клеток и отсутствие поступления в цитоплазму за пределы цитоплазматической мембраны и перигранулярных мембран внеклеточных маркеров (гемоглобина и лантана).
Многие либераторы Г. представляют собой соединения со свойствами оснований. Считают (Стануорт, 1974), что если положение и чередование основных группировок в молекуле либератора соответствует положению и чередованию свободных группировок с кислотными свойствами (карбоксильных групп) на мембране тучной клетки, то это приводит к их взаимодействию, что и является толчком, активирующим клетку. В том участке Fc-фрагмента молекулы антитела, который открывается после соединения с антигеном и который имеет отношение к активации клетки, последовательность аминокислотных остатков с основными свойствами сходна с последовательностью основных группировок в других либераторах Г.
Высвобождение Г., вызванное нецитотоксическими либераторами, является активным (энергетически зависимым) процессом, протекающим с затратой энергии, обеспечиваемой АТФ, который образуется в тучных клетках за счет как аэробного, так и анаэробного путей энергетического обмена. Поэтому истощение запасов АТФ и связанное с этим торможение высвобождения Г. может быть достигнуто при условии одновременного ингибирования дыхания и гликолиза. На высвобождение Г. расходуется до 20% общего количества АТФ в тучных клетках [Диамант (В. Diamant), 1975]. Конкретные пути использования АТФ для высвобождения Г. пока неизвестны. Считают, что АТФ затрачивается на обеспечение продвижения гранул по системе микроканальцев к клеточной поверхности. Однако прямых доказательств существования в тучных клетках этой системы нет.
Начальным этапом активации тучных клеток образующимся на их поверхности комплексом антиген — антитело является активация клеточных серин-эстераз при участии ионов Са2+. Высвобождение Г., вызванное антигеном, зависит от системы циклического 3′,5′-аденозинмонофосфата (цАМФ): увеличение его содержания в клетках тормозит, а снижение усиливает высвобождение Г. Роль цАМФ не является универсальной во всех видах нецитотоксического высвобождения Г.: вещество 48/80 высвобождает Г., действуя в обход системы цАМФ [Фредхольм (В. Fredholm) и соавт., 1976].
Ионы Ca2+ необходимы для активации не только начальных, но и более поздних этапов реакции, следующих за энергетически зависимым этапом и состоящих в продвижении гранул к клеточной мембране и в выводе их за пределы клетки (процесс дегрануляции).
Повышение проницаемости общей цитоплазматической мембраны и сливающихся с ней перигранулярных мембран приводит к поступлению в пространства, окружающие гранулы, внеклеточных ионов. Внеклеточные катионы, гл. обр. ионы Na+, вытесняют Г. с гранулярного матрикса, представляющего собой гепариново-белковый комплекс, обладающий свойствами слабого катионита (Б. У внес, 1970). Т. о., Г. высвобождается не только из гранул, покинувших клетку, но также из остающихся в пределах клетки гранул, к к-рым появился доступ внеклеточных катионов. Каким бы способом (цитотоксическим или нецитотоксическим) не было вызвано поступление внеклеточных катионов в перигранулярные пространства, снятие Г. с гранулярного матрикса осуществляется однотипно — по механизму катионообменного процесса.
Механизм высвобождения Г. из базофилов, вызванного специфическим антигеном или аллергеном, принципиально сходен с механизмом его высвобождения из тучных клеток. Этот процесс может рассматриваться как активная реакция живых клеток на специфический раздражитель. Для обеспечения выхода Г. из сенсибилизированных лейкоцитов человека достаточно добавить всего несколько пикограммов (10-12 г) соответствующего аллергена, что свидетельствует о высокой иммунной специфичности этой реакции.
Свободный Г., освободившийся из гранул тучных клеток, или новообразованный в других тканях, проникая в жидкие среды организма, вызывает общие и местные реакции. Наиболее типично общая реакция проявляется в коллапсе, или в «гистаминовом шоке», возникающем при недостаточности механизмов нейтрализации свободного Г. Характерными для аллергии формами местной реакции на Г. являются бронхоспазм и кожная реакция, описываемая как «тройная реакция» или «тройной ответ» Льюиса (1924): 1) местное расширение капилляров и появление красноты; 2) распространение эритемы в результате расширения соседних артериол; 3) образование волдыря вследствие увеличения проницаемости сосудов кожи. 1-я и 3-я фазы реакции обусловлены непосредственным действием Г. на капилляры, 2-я фаза обусловлена действием ацетилхолина, выделяющегося рефлекторно при раздражении Г. сенсорных волокон задних корешков спинного мозга.
Клин, проявления аллергии, обусловленные высвобождением из тканей Г., могут быть в какой-то мере уменьшены введением антагонистов Г. (см. Антигистаминные вещества). Механизм их действия различен: они могут тормозить высвобождение Г. из клеток, блокировать гистаминрецепторы на поверхности эффекторных клеток или обладать конкурентным действием по отношению к Г. См. также Медиаторы аллергических реакций.
Гистамин как препарат
Histamini dihydrochloridum; син.: Eramin, Ergamine, Histalgine, Histodol, Istal, Peremin.
Выпускается в виде кристаллического Г. фосфата или дигидрохлорида. Хорошо растворим в воде. На месте введения Г. появляется покраснение, обусловленное расширением капилляров, и образуется папула в результате повышения проницаемости капилляров и отека тканей; возникает ощущение зуда, боль, обусловленные раздражением окончаний чувствительных нервов.
При введении per os Г. малоактивен, т. к. разрушается гистаминазой жел.-киш. тракта. При парентеральном введении Г. специфически стимулирует функцию секреторных клеток пищеварительных, бронхиальных, слезных желез и усиливает отделение желчи. Особенно сильно Г. повышает образование желудочного сока, являясь мощным стимулятором секреторной деятельности обкладочных клеток желудка, выделяющих соляную к-ту. Г. повышает тонус (вплоть до спазма) и усиливает сокращения мышц бронхов и тонкого кишечника. У большинства животных и у человека Г. вызывает понижение АД в результате расширения капилляров, повышения их проницаемости и, как следствия этого, уменьшения массы циркулирующей крови. Расширение капилляров является результатом вызываемого Г. паралича прекапиллярных сфинктеров. Действие Г. связывают с его влиянием на гистаминчувствительные рецепторы клеток. Г. вызывает также задержку крови в венах печени и легких с уменьшением притока крови к правому или левому сердцу, вследствие чего также уменьшается количество циркулирующей крови.
В клинике Г. применяют для диагностики феохромоцитомы (см.): внутривенное введение 0,025—0,05 мг Г. через 1—5 мин. вызывает у больных кратковременное повышение АД на 40/25 мм рт. ст., сопровождающееся повышением концентрации адреналина в крови. У части здоровых лиц Г. вызывает аналогичный феномен.
Гистаминовую пробу проводят в предоперационном периоде для определения состояния кровообращения и секреторной способности желудочных желез.
Как лекарственное средство Г. имеет ограниченное применение. Г. иногда пользуются при полиартритах, суставном и мышечном ревматизме: внутрикожное введение дигидрохлорида или фосфата Г. (0,1— 0,5 мл 0,1% р-ра), втирание мазей, содержащих Г., и электрофорез Г. вызывают сильную гиперемию и уменьшение болезненности; при болях, связанных с поражением нервов, при радикулитах, плекситах и т. п., при этом препарат вводят внутрикожно (0,2—0,3 мл 0,1% р-ра). Применение Г. противопоказано при менструациях, ангине, лихорадочных состояниях. При передозировке возможен коллапс (гистаминовый шок).
Форма выпуска: ампулы, содержащие Г. от 0,01 до 10 мкг и от 15 до 50 мкг.
Тест специфического высвобождения гистамина
Метод выявления специфической сенсибилизации организма основан на освобождении гистамина из лейкоцитов крови больного после добавления к ним специфического аллергена.
Тест используется с научно-исследовательскими целями для выявления атопической сенсибилизации (см. Атопия), при поллинозах (см.), пищевой аллергии (см.) и лекарственной аллергии (см.), а также для контроля эффективности специфической гипосенсибилизации (см. Гипосенсибилизация). Предложен в 1964 г. Л. Лихтенстайном и Ослером (A. G. Osier). Существенный недостаток метода — использование большого объема крови (100 мл). В 1970 г. Мей (Ch. D. May) с сотр. несколько изменили метод, что позволило уменьшить объем крови до 10 мл.
IgE-антитела, накапливаясь в крови больных атопическими заболеваниями, фиксируются гл. обр. на базофилах, к-рые содержат большую часть гистамина крови. Фиксированные IgE-антитела выполняют функцию рецептора для специфического аллергена, обусловливая явление сенсибилизации. В результате реакции аллерген — антитело из базофилов высвобождаются медиаторы, в т. ч. и гистамин (см. Медиаторы аллергических реакций). Т, о., с помощью этого теста можно косвенно судить о присутствии на поверхности лейкоцитов клеточно-фиксированных IgE-антител и о степени чувствительности больного к данному аллергену. Это имеет большое значение в клинике аллергических заболеваний, т. к. одной из причин возникновения атопического заболевания и его обострения является повышение количества клеточно-фиксированных IgE-антител.
Тест включает три основных этапа: получение отмытой суспензии функционально-активных лейкоцитов из крови больных, инкубацию суспензии лейкоцитов (в течение 1 часа при pH 7,35 и температуре 37°) с различными концентрациями аллергенов и определение флюориметрическим или изотопным методом концентрации Г. отдельно в надосадочной жидкости и в лейкоцитах. Экстракты используемых при этом аллергенов не должны содержать фенола, к-рый обладает неспецифическим гистаминвысвобождающим действием. Кроме того, неочищенные экстракты обладают неспецифической токсичностью, а употребление высоких концентраций нек-рых экстрактов вызывает неспецифическое высвобождение Г. из лейкоцитов. При этом каждый исследуемый антиген оттитровывают на лейкоцитах здоровых доноров. Для этого используют аллергены в убывающих разведениях. Аллергены в концентрациях, не вызывающих освобождение Г., могут быть использованы для теста с лейкоцитами больных. В качестве контроля на специфичность к суспензии лейкоцитов добавляют аллерген, к к-рому больной не обнаруживал сенсибилизации. Концентрацию высвобожденного Г. выражают в процентах от общего содержания Г. в пробе.
При инкубации со специфическим аллергеном лейкоцитов больных атоническим заболеванием отмечается дозозависимое высвобождение Г. При этом различают клеточную реактивность и клеточную чувствительность. Под клеточной реактивностью понимают максимальное освобождение Г. в зависимости от концентрации аллергена. Клеточная: чувствительность выражается количеством антигена, к-рое необходимо для высвобождения 50% гистамина из тучных клеток.
Тест является трудоемким; введение автоматического метода определения Г., а также употребление цельной крови вместо суспензии лейкоцитов позволит значительно упростить этот тест и сделать его более доступным для клин, лабораторий.
Библиография: Адо А. Д. Общая аллергология, М., 1970, библиогр.; Альперн Б. Аллергия, пер. с франц., М., 1973; Гущин И. С. Анафилаксия гладкой и сердечной мускулатуры, М., 1973, библиогр.; Дэгли С. и Никольсон Д. Метаболические пути, пер. с англ., с. 218, М., 1973; Успенский В. И. Гистамин, М., 1963, библиогр.; Чернух А. М. и Тимкина М. И. Динамика биоэлектрической активности терминальных сосудов брыжейки тонкого кишечника крысы под влиянием гистамина, Пат. физиол, и Эксперим, тер., т. 15, JSIa 3, с. 49, 1971, библиогр.; Goldstein Д., Aronow L. а. К a lma’n S. М. Principles of drug action, the basis of pharmacology, N. Y., 1974; G г u n J. P. Histamine, в кн. Handbook neurochem., ed. by A. Lajtha, v. 4, N. Y., 1970, bibliogr.; Histamine and antihistamines, ed.byZ. M. Bacq a. o., Oxford— N.Y., 1973; Kaliner M. a. Austen K.F. The hormonal control of the immunologic release of histamine and slow reating substance of anaphylaxis from human lung, в кн.; Cyclic nucleotides, immune responses a. tumor growths, ed. by W. Braun a. o., p. 128, N. Y., 1974; The pharmacological basis of therapeutics, ed. by L. S. Goodman a. A. Gilman, L., 1975; Stan wort h D.R. Immediate hypersensitivity, в кн.: North-Holland research monographs, Frontiers of biology, v. 28, p. 69, Amsterdam a. o., 1974; Tauber A. I. a, o. Immunologic release of histamine and slow reacting substance of anaphylaxis from human lung, J. Immunol., v. Ill, p. 27, 1973.; Орлов С. М. Высвобождение гистамина in vitro из лейкоцитов периферической крови больных с нейссериальной формой бронхиальной астмы, Иммунология, № 1, с. 90, 1980; Орлов С. М. и Шустова В. И. Тест освобождения гистамина в диагностике поллиноза, Клин, мед., т. 58, № 1, с. 88, 1980; Lichtenstein L. М. a. Osier A. G. Studies on the mechanisms of hypersensitivity phenomena, J. exp. Med., v. 120, p. 507, 1964; May Ch. a. o. Procedures for immunochemical study of histamine release from leukocytes with small volume of blood, J. Allergy, v. 46, p. 12, 1970.
Л. М. Ишимова; И. В. Комиссаров (фарм.), С. М. Орлов
Что такое гистамин, его влияние на организм человека, чем он опасен
Что такое гистамин и какова его роль в организме? Гистамин – слово, хорошо знакомое тем, кто обладает выраженной склонностью к аллергическим реакциям и вынужден либо вести образ жизни, исключающий аллергены, либо проходить курс лечения, то есть принимать антигистамины.
Гистамин запускает в нашем организме различные аллергические реакции – это благодаря ему происходит спазм бронхов, из-за которого наступает состояние похожее на удушье, это он вызывает отек тканей. Для чего же природа наделила человеческий организм этим странным помощником?
Что такое гистамин в организме?
Гистамин в чистом виде – это бесцветный кристалл, который легко растворяется в воде и этаноле. На языке биохимиков его название звучит так: 2-(4-имидазолил)этиламин.
В медицине же он известен как нейромедиатор аллергических реакций немедленного типа. И как любой другой нейромедиатор, гистамин помогает передавать электрические импульсы от нервной клетки к нейрону или от нейронов к тканям. Однако, в отличие от прочих биологически активных веществ, он вступает в действие тогда, когда требуется немедленная реакция нашего организма на проникновение чужеродного антигена.
Представьте два подразделения одной корпорации — одно в Японии, а второе — в Швеции. Общаться без переводчика они не могут. Таким переводчиком в организме и является любой нейромедиатор — он передает сигнал между двумя звеньями, чтобы они работали на благо всей системы.
Алёна Кротюк
Где вырабатывается гистамин?
Гистамин вырабатывается из гистидина который в разных количествах пребывает в гистиоцитах (тучных клетках) в тканях кожи, легких, кишечника.
По сути, гистидин — это аминокислота. Она входит в состав абсолютного большинства белков, которые мы едим каждый день. Вообще все огромные молекулы белков строятся из всего 20 разных аминокислот, а их свойства зависят от порядка, в котором эти аминокислоты выстроятся в цепочку.
Алёна Кротюк
Обычно гистидин находится в неактивной форме, но под воздействием ряда факторов гистамин начинает высвобождаться из тучных клеток, переходя в активную форму и провоцируя ряд вышеописанных реакций. Высвобождению свободного гистамина способствуют травматические и термические поражения, стрессовые реакции, ионизирующее излучение и, конечно, аллергические агенты пищевого и медикаментозного происхождения.
Впрочем, кроме гистамина эндогенного (то есть, вырабатываемого организмом), существует и экзогенный (приходящий извне). Этот нейромедиатор можно обнаружить в ряде пищевых продуктов, причем, чаще всего он встречается в тех, что предназначены для длительного хранения в холодильных камерах, — колбасах, сырах (твердые сорта). Кроме того, гистамин содержится в спиртных напитках, а также существует огромный список аллергенных продуктов, провоцирующих выработку гистамина в организме. Вывод прост: если вы склонны к аллергическим реакциям, вышеуказанных продуктов лучше всего избегать.
Чем опасен гистамин?
Гистамин воздействует на три группы H-рецепторов, вызывая три типа реакций.
У слова «рецептор» много разных реинкарнаций в организме, но суть всегда одна — это своего рода приёмник. Когда речь заходит о гистамине и других медиаторах, то мы говорим о клеточных рецепторах. На поверхности каждой клетки есть что-то вроде кодовых замков, открыть которые и запустить соответствующий процесс может только нужный медиатор. В данном случае аллергическую реакцию запускает гистамин. В самом простом исполнение это выглядит так:
- аллергик вдыхает пыльцу амброзии;
- чужеродный белок-аллерген запускает высвобождение гистамина;
- гистамин «набирает» свой код на клетках гладкой мускулатуры бронхов;
- клетки гладкой мускулатуры сокращаются, сужая просвет бронхов и вызывая удушье.
Алёна Кротюк
h2-рецепторы локализуются в гладких мышцах, эндотелии, центральной нервной системе. Воздействуя на них, гистамин провоцирует спазмы бронхов, кровеносных сосудов, стимулирует работу гипофиза.
h3-рецепторы располагаются в париетальных клетках и воздействие на них стимулирует выработку желудочного сока.
h4-рецепторы находятся в центральной и периферической нервной системе и воздействие на них подавляет высвобождение ГАМК, ацетилхолина, серотонина и норадреналина. Благодаря комплексному воздействию, гистамин стимулирует выработку адреналина, который, в свою очередь, воздействует на сердце, повышая частоту пульса и уровень давления.
Все это необходимо для того, чтобы блокировать распространение аллергена и как можно быстрее эвакуировать его из организма. Однако при постоянном контакте с антигеном защитный потенциал организма снижается и развиваются функционально-морфологические нарушения со стороны внутренних органов и существенно снижается качество жизни.
Аллергия — это как война с ветряными мельницами. Организм, иммунная система которого призвана сражаться с опасностями, живет в гораздо более благоприятных условиях, чем приходилось жить его предкам. Мы не встречаемся с огромных количеством вирусов, бактерий, паразитов. Иммунитет начинает «скучать», и на вполне безобидные вещества запускает ответ, достойный добротного змеиного яда. Так и появляются аллергии на арахис, пыльцу, кошачью шерсть и т. п. Если же избегать аллергена не удается, то могут начаться функционально-морфологические изменения — клетки начнут адаптироваться к этой постоянной «войне с мельницами», им придется работать для обеспечения иммунного ответа, что изменит и их функции (работу), и морфологию (форму). Так, например, при постоянной аллергии на бытовую химию последствием может стать так называемый «контактный дерматит». И даже если человек внезапно перестанет пользоваться своим личным аллергеном, дерматит (кожное воспаление) еще продержится полгода и более — боеспособная армия будет готова в любой момент нанести удар по непрошеному гостю.
Алёна Кротюк
Так, при контакте с пыльцой растений развивается отек слизистой и постоянная заложенность носа, при длительном контакте с пищевыми и бытовыми аллергенами могут возникать кожные аллергические заболевания, укусы пчел и других насекомых могут вызвать сильнейший отек.
А некоторые реакции вызываемые гистамином, сами по себе представляют угрозу для жизни. Например, анафилактический шок, при котором резко понижается давление, происходит потеря сознания и возможен даже летальный исход. И тогда организму уже требуется помощь в подавлении защитных реакций и, следовательно, блокирования выработки самого гистамина.
Статья написана совместно с Екатериной Сизовой и Алёной Кротюк.
Где вырабатывается гистамин в теле человека. Явление гистаминовой непереносимости. Биологическое действие вещества
Понятие «гистамин» хорошо знакомо тем людям, которым пришлось в своей жизни столкнуться с аллергической реакцией на что-либо и принимать антигистаминные препараты. Поэтому многие думают, что histamin– это сам . Тем не менее, это ошибочное мнение.
Что это такое
Впервые синтез гистамина был произведён в 1907 году. Если говорить о биологическом веществе в чистом виде, то это бесцветный кристалл, который может растворяться в воде или этаноле.
В целом же это медиатор аллергических реакций. Секреция этого биологически активного вещества – гистидин.
В обычном состоянии, в котором он всегда и находится в организме, этот компонент содержится практически во всех клетках. Наука назвала его – гистиоцит. Именно тогда он безопасен и никакого вреда не несёт. Если же на него оказывают влияние некоторые факторы, он способен активизироваться и концентрироваться в крови в больших количествах.
По своей сути это тканевый гормон. Основная его задача – сообщать о проблеме в организме, если есть угроза здоровью. Сам механизм защиты активизирует многие системы. Поэтому знание этой системы поможет разобраться в истинных причинах аллергии, вызванной нервозами, непереносимостью некоторых продуктов, реакции на стрессовые ситуации.
Сегодня причиной целого ряда проблем является чрезмерная активность этого биологического вещества, на фоне которого развиваются болезни, снижается иммунитет. При этом человек плохо себя чувствует, но видимых причин тому нет.
Гистамин проявляет свою активность, если есть катализаторы, провоцирующие его к действию. К таким факторам относят:
- травмы;
- ожоги;
- обморожение;
- стресс;
- облучение;
- побочная реакция от приема лекарств;
Наличие в крови синтезированного тканевого гормона может наблюдаться вследствие употребления в пищу некоторых продуктов. Также его много в замороженной еде. При низких температурах в продуктах питания возникает повышенное количество вещества.
Биологическое действие и функции в организме
Если вещество в активном состоянии попадает в кровь, то оно оказывает сильное влияние на все органы человека. Начинаются изменения от его переизбытка:
- затрудняется дыхание, возможны бронхиальные спазмы;
- появляется расстройство желудка;
- выделяется адреналин, из-за чего учащается сердцебиение;
- ускоряется процесс пищеварения;
- понижается давление, начинаются головные боли;
- при большой концентрации в крови может произойти анафилактический шок – резко снижается давление, человек теряет сознание, возможны судороги и рвота.
Основными функциями химического вещества, которое вступает во взаимодействие практически со всеми органами, является целый ряд важных жизненных процессов:
- Регулирует кровоснабжение в органах и тканях. Если человек физически тяжело работает, то в мышцах может возникнуть нехватка кислорода. Здесь начинает свою работу гистамин. Он заставляет капилляры расширяться, что приводит к увеличению притока крови и кислорода.
- Регулирует кислотность желудка, в слизистой которого он действует как медиатор. Стимулирует клетки, способные вырабатывать соляную кислоту.
- Регулирует воспаления в организме.
- Нервная регуляция. Гистамин поддерживает ЦНС в состояние бодрствования. В период расслабления или усталости активность гистаминовых нейронов снижается, а во время непродолжительного сна они и вовсе прекращают свою активность. Биологическое вещество также защищает клетки нервной системы, предотвращает судороги, ишемические повреждения, стрессовые ситуации в ЦНС и способствует забыванию ненужной информации.
- Регулирует репродуктивную функцию и половое влечение. Введение биологического вещества в тело мужчины, имеющего проблемы с эрекцией восстанавливало ее на три четверти. Поэтому если снижать, к примеру, с помощью антагонистов рецепторов кислотность и в желудке, то можно столкнуться с потерей либидо либо вообще импотенцией.
 Есть женщины, которые страдают непереносимостью этого тканевого гормона. Это обусловлено взаимодействием его с женскими гормонами и способностью гормона провоцировать сокращение матки.
Есть женщины, которые страдают непереносимостью этого тканевого гормона. Это обусловлено взаимодействием его с женскими гормонами и способностью гормона провоцировать сокращение матки.
Откуда он берётся в организме
Учёным давно известно, что гистамин вырабатывается из гистидина. Если говорить простым языком, гистидин – это аминокислота, которая находится практически во всех белковых продуктах. Их человек употребляет каждый день. Нужно понимать, что все молекулы белков строятся в определённом порядке из 20 разных аминокислот. А уже их свойства будут зависеть от того, в каком порядке они встали.
Стоит отметить, что гистамин пребывает в тучных клетках органов человека – кожи, кишечника и лёгких.
Гистамин и аллергия
Особую функцию гистамин выполняет при проявлении аллергии. Здесь ни в коем случае не обходится без двух веществ, вступающих в реакцию друг с другом.
Антиген – с ним организм человека уже когда-то встречался. Он его запомнил и сохранил информацию о его «пребывании». Это вещество уже поступало в ткани и вызывало определённую раздражительность в клетках. Вся информация в клетках уже есть, но тут в реакцию вступают антитела. И нужно понимать, что это становится главным катализатором появления аллергии.
Теперь, когда организм знак

 (
(