XuMuK.ru — D-Фруктоза, или плодовый сахар
является наиболее важным представителем кетоз. Вследствие левого вращения она долгое время называлась левулозой.
D-Фруктоза содержится во многих сладких плодах вместе с D-глюкозой. Смесь равных количеств фруктозы и глюкозы образуется при гидролизе тростникового сахара; такая же смесь составляет главную часть меда. Легче всего получить D-фруктозу гидролизом полисахарида инулина. D-Фруктоза кристаллизуется (очень трудно) в кристаллах, имеющих состав 2C6H12O6 ∙ H2O, плавящихся около 100° С. Она вращает плоскость поляризации влево сильнее, чем D-глюкоза вправо, и обладает слабой мутаротацией (конечное вращение [α]D =—93°). В водных растворах фруктоза весьма сильно дециклизована; в значительных количествах содержится в растворах и фруктофураноза.
О реакциях, доказывающих строение фруктозы, было указано выше. Фруктоза дает тот же озазон, что и глюкоза и манноза. Это доказывает, что конфигурация асимметрических углеродных атомов фруктозы тождественна конфигурации асимметрических атомов в глюкозе и маннозе.
При восстановлении фруктозы в гексит возникает новый асимметрический углеродный атом, который может дать две различные конфигурации по отношению к остальным асимметрическим атомам углерода. Соответственно этому при восстановлении фруктозы получается два гексита, а именно: маннит и сорбит, т. е, те же спирты, что и при восстановлении маннозы и глюкозы. Из маннита и сорбита фруктоза может быть получена окислением, особенно легко при помощи сорбозной бактерии.
D-Фруктоза обладает значительно более сладким вкусом, чем тростниковый сахар; наличием фруктозы вызвана сильная сладость меда.
За последние 10 лет в различных природных источниках обнаружено большое число новых сахаров. Особенно много новых моносахаридов (около 20) найдено в микроорганизмах. К ним относятся 3,6-дидезоксигексозы, альдо- и кетогептозы и др.
Фруктоза — Википедия
| Фруктоза[1][2] | |
|---|---|
| Систематическое наименование | (3S,4R,5R)-1,3,4,5,6-пентагидроксигексан-2-он (D-фруктоза), (3R,4S,5S)-1,3,4,5,6-пентагидроксигексан-2-он (L-фруктоза) |
| Традиционные названия | Фруктоза, фруктовый сахар, плодовый сахар, левулоза, арабино-гексулоза |
| Хим. формула | C6H12O6 |
| Состояние | бесцветные кристаллы |
| Молярная масса | 180,159 г/моль |
| Плотность | 1,598 г/см³ |
| Т. плав. | β-D-фруктоза: 102–104 °C |
| Т. кип. | 440 °C |
| 219 °C | |
| Энтальпия плавления | 33,0 кДж/моль |
| Энтальпия растворения | –37,69 кДж/кг |
| pKa | 11,90 |
| Растворимость в воде | 400 г/100 мл |
| Растворимость в этаноле | 6,7118 °C г/100 мл |
| Вращение [α]D | α-D-фруктоза: –133,5° → –92° β-D-фруктоза: –63,6° → –92° |
| Показатель преломления | 1,617 |
| Дипольный момент | 15,0 Д |
| Рег. номер CAS | 57-48-7 |
| PubChem | 5984 |
| Рег. номер EINECS | 200-333-3 |
| SMILES | |
| InChI | |
| Рег. номер EC | 200-333-3 |
| ChEBI | 48095 |
| ChemSpider | 5764 |
| ЛД50 | 15 г/кг (кролики, внутривенно)[3] |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Фруктоза (левулоза, фруктовый сахар), C6H12O6 — моносахарид из класса кетогексоз, изомер глюкозы. Один из наиболее распространённых в природе сахаров: встречается как в индивидуальном состоянии, так и в составе дисахаридов (сахарозы) и полисахаридов (инулина). Широко применяется в пищевой промышленности как подсластитель. Выполняет важные биохимические функции в организме человека.
История
Фруктоза была открыта Дюбрунфо в 1847 г. в ходе сравнительного исследования молочнокислого и спиртового брожения сахара, полученного из сахарозы сахарного тростника. Дюбрунфо обнаружил, что в ходе молочнокислого брожения в ферментационной жидкости присутствует сахар, угол вращения которого отличается от уже известной в то время глюкозы
В 1861 году Бутлеров синтезировал смесь сахаров — «формозу» — конденсацией формальдегида (муравьиного альдегида) в присутствии катализаторов: Ba(OH)2 и Ca(OH)2, одним из компонентов этой смеси является фруктоза[5].
Строение молекулы
Фруктоза является моносахаридом и принадлежит к классу кетогексоз. Это полигидроксикетон с кетогруппой при атоме C-2 и пятью гидроксильными группами. В структуре фруктозы есть три хиральных атома углерода, поэтому такой структуре соответствует восемь стереоизомеров (четыре пары энантиомеров): сама фруктоза, а также её стереоизомеры сорбоза, тагатоза и псикоза[6].
В твёрдом состоянии и в растворах фруктоза существует не в линейной форме, а в виде циклического полуацеталя, образованного в результате присоединения ОН-групп при атоме С-5 или С-6 к кетогруппе. Этот полуацеталь устойчив: в растворе доля открытоцепной формы составляет лишь 0,5 %, тогда как остальные 99,5 % приходятся на циклические формы. Если в циклизации участвует гидроксильная группа при С-5, образуется пятичленный цикл, который называется фуранозным (от названия фурана — пятичленного гетероцикла с одним атомом кислорода), а циклическую D-фруктозу называют D-фруктофуранозой. Если циклизация происходит за счёт гидроксильной группы при C-6, образуется шестичленный, пиранозный цикл (от названия пирана), а такая циклическая D-фруктоза называется D-фруктопиранозой[6].
Циклизация D-фруктозы в фуранозный и пиранозный циклПри описанной циклизации возникает новый стереоцентр при полуацетальном атоме углерода С-2, поэтому фуранозная и пиранозная формы D-фруктозы могут дополнительно существовать в виде двух диастереомеров, называемых аномерами: α-D-фруктофуранозы и β-D-фруктофуранозы; α-D-фруктопиранозы и β-D-фруктопиранозы. Обычно циклические формы
Более точно структуру аномеров D-фруктозы изображают в виде конформации «кресло», которая является наиболее устойчивой для пиранозного цикла, и в виде конформаций «конверт» и «твист» для фуранозного цикла. Точная конформация для фураноз неизвестна[6].
В растворе эти формы D-фруктозы находятся в равновесии. Среди них преобладает пиранозная форма, но при повышении температуры её доля немного уменьшается[7]. Преобладание β-D-фруктопиранозы объясняют наличием водородной связи между гидроксильными группами при С-1 и С-3. В 10%-ом растворе при комнатной температуре D-фруктоза имеет следующее распределение циклических форм:
- α-D-фруктофураноза — 5,5 %;
- β-D-фруктофураноза — 22,3 %;
- α-D-фруктопираноза — 0,5 %;
- β-D-фруктопираноза — 71,4 %[6].
Кристаллическая D-фруктоза представляет собой β-D-фруктопиранозу; другие циклические изомеры выделены только в виде производных. В таких соединениях, как сахароза, рафиноза и инулин, D-фруктоза находится в виде β-D-фруктофуранозы[6].
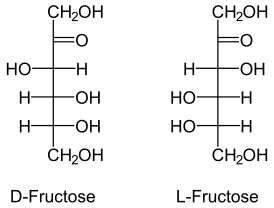
L-Фруктоза не встречается в природе, но её можно синтезировать химически либо получить микробиологически из L-маннозы или L-маннита[6].
Физические свойства
D-Фруктоза представляет собой бесцветные кристаллы в виде призм или игл с температурой плавления 103—105 °С. Обычно кристаллизуется в безводном виде, но ниже 20 °С устойчивы также полугидрат и дигидрат[8].
D-Фруктоза растворима в воде, пиридине, хинолине, ацетоне, метаноле, этаноле, ледяной уксусной кислоте. Её растворимость в воде выше, чем у других сахаров и составляет 4 г на 1 г воды при 25 °С. Доля сухого вещества в насыщенном растворе фруктозы при 20 °С составляет 78,9 %, а при 55 °С — 88,1 %. Из-за такой высокой растворимости при промышленной кристаллизации фруктозы из растворов возникают проблемы с высокой вязкостью этих растворов: при 50 °С динамическая вязкость насыщенного раствора фруктозы составляет 1630 мПа·с, тогда как для сахарозы она равна всего 96,5 мПа·с
Фруктоза — самый сладкий из природных сахаров. Кристаллическая фруктоза в 1,8 раза слаще кристаллической сахарозы. Это позволяет рассматривать фруктозу как перспективный подсластитель, который обеспечивает такую же сладость, как сахароза, но при этом имеет более низкую пищевую ценность. Сладость фруктозы в растворах зависит от температуры, pH и концентрации: она повышается при охлаждении раствора (это объясняют повышением доли более сладких пиранозных форм[9]
) и при подкислении раствора[2].Получение
Сырьё для производства
Фруктоза широко представлена в природе как в индивидуальном виде, так и в составе сахарозы (в которую наряду с D-фруктозой входит остаток D-глюкозы). Во многих растениях встречаются полимеры D-фруктозы — фруктаны. Больше всего фруктозы содержится в мёде (40 г в 100 г), яблоках (6-8 г), грушах (5-9 г), черносливе (15 г)[10].
Наиболее экономически целесообразно в качестве сырья для производства фруктозы использовать крахмал, сахарозу и инулин. Крахмал производят преимущественно из кукурузы. Это полисахарид, который состоит из звеньев D-глюкозы. Поскольку фруктоза в крахмале не содержится, необходимо подобрать такой процесс, в котором глюкоза будет легко превращаться во фруктозу. Сахароза — это крупнотоннажный промышленный продукт, являющийся практически идеальным сырьём для производства фруктозы за счёт очень хорошей доступности, высокой чистоты и высокого изначального содержания фруктозы. Инулин — это фруктан, который получают из корней цикория (15-20 % от общей массы) и клубней артишока
Производство из крахмала
Структура крахмалаФруктозу получают из крахмала в несколько стадий: крахмал разжижают (при этом происходит его частичный гидролиз), затем разлагают его до глюкозы, полученную глюкозу изомеризуют во фруктозу, фруктозу выделяют из раствора. Разработаны ферментативные способы этих преобразований. Например, крахмал превращают в глюкозу под действием α-амилазы и глюкоамилазы, а глюкозу во фруктозу — под действием глюкозоизомеразы. Глюкозоизомераза на самом деле называется ксилозоизомеразой, поскольку она также превращает D-ксилозу в D-ксилулозу, а D-рибозу — в D-рибулозу. Способ получения фруктозы из крахмала был разработан в 1966 году. С 1968 года так получают 42%-ый фруктозный сироп. Хроматографическая очистка позволяет повысить чистоту фруктозы до 90 %[10].
Производство из сахарозы
Структура сахарозыНа основе сахарозы был создан первый коммерческий способ получения фруктозы: сахарозу гидролизовали, после чего полученные фруктозу и глюкозу разделяли хроматографически. Современные методы позволяют проводить гидролиз сахарозы высокоселективным ферментативным способом (под действием β-фруктофуранозидазы из Saccharomyces cerevisea) либо минеральными кислотами (соляной или серной). Недостатком первого способа является высокая цена фермента и невозможность проводить непрерывный процесс. С другой стороны, при гидролизе минеральными кислотами образуются нежелательные побочные продукты. Наиболее продвинутым способом является гидролиз иммобилизованными сильнокислыми катионитами: он позволяет гидролизовать 50-60%-ые растворы сахарозы при температуре 30-45 °С практически без образования побочных продуктов. Полученные сахара разделяют хроматографией, получая две фракции с чистотой выше 95 %[11].
Производство из инулина
Структура инулинаПроизводство фруктозы из инулина, который в свою очередь получается из цикория, было организовано в середине 1990-х годов. В основе этого метода также лежит гидролиз, который можно реализовать ферментативно или под действием кислот. Кислотный гидролиз представляет лишь научный интерес, поскольку различные испытанные кислоты (серная, соляная, фосфорная, лимонная, щавелевая, винная) приводили к разложению фруктозы и образованию побочных продуктов. Ведётся поиск других кислотных катализаторов, среди которых более мягкими показали себя цеолиты[12].
Среди ферментов выгодно отличаются экзоинулиназа и эндоинулиназа из Aspergillus niger, смесь которых позволяет превратить инулин во фруктозу в одну стадию. Производство фруктозы из крахмала требует гораздо больше ферментативных стадий и даёт выход фруктозы лишь в 45 %. Гидролиз проводится в нейтральной или слабокислой среде при 60 °С и занимает 12-24 ч. Содержание фруктозы в сиропе составляет 85-95 %; остальное приходится на глюкозу (3-13 %) и олигосахариды (1-2 %). Полученный сироп очищают от неорганических примесей, обесцвечивают и концентрируют[12].
Получение кристаллической фруктозы
Кристаллическая фруктозаКристаллизация фруктозы после синтеза является сложной стадией, поэтому необходимо, чтобы раствор содержал минимум 90 % фруктозы от общей массы растворённых веществ. Применяют различные комбинации условий, включая кристаллизацию при атмосферном либо пониженном давлении, различные режимы охлаждения, непрерывные или периодические процессы, однако в качестве растворителя всегда используется вода, поскольку отделение и регенерация растворителя требует слишком много усилий. Кристаллический продукт отделяют от маточного раствора в центрифугах, а затем сушат. Кристаллизации мешает примесь глюкозы: она повышает растворимость фруктозы в воде и снижает пересыщенность раствора. Также в процессе кристаллизации образуются димеры фруктозы, которые сокристаллизуются с фруктозой и мешают росту кристаллов[13].
Химические свойства
Фруктоза вступает в химические реакции, типичные для моносахаридов, образуя простые и сложные эфиры, а также ацетали и гликозиды. За счёт наличия карбонильной группы она даёт продукты присоединения нуклеофильных реагентов: аминов, аминокислот, пептидов и др. С фенилгидразином она даёт озазон, идентичный озазону глюкозы или маннозы[14][8].
Фруктозу можно восстановить, в том числе ферментативно, до маннита или сорбита. На каталитическом гидрировании карбонильной группы фруктозы в присутствии никелевого или медного катализатора основан промышленный способ получения маннита. В промышленности также проводят каталитическое окисление фруктозы воздухом или кислородом в присутствии катализаторов на основе благородных металлов. При этом образуются два основных продукта: 2-кето-D-глюконовая кислота и 5-кетофруктоза[14].
В отличие от глюкозы и других альдоз, фруктоза неустойчива как в щелочных, так и кислых растворах. В щелочной среде фруктоза через ендиольную форму изомеризуется в глюкозу и маннозу с небольшой примесью псикозы (перегруппировка Лобри де Брюина — Ван Экенштейна). При нагревании в щелочных условиях фруктоза фрагментируется, давая глицеральдегиды, молочную кислоту, метилглиоксаль и другие продукты разложения[14][8]}.
При нагревании твёрдой фруктозы или её насыщенного раствора приводит к дегидратации и образованию продуктов конденсации. Нагревание в присутствии аминокислот приводит к окрашенным и пахучим продуктам реакции Майяра. При нагревании в присутствии кислоты также происходит дегидратация и образуется 5-гидроксиметилфурфурол. Это свойство является основой для качественной реакции на фруктозу — пробы Селиванова[14].
Доступность D-фруктозы и её низкая стоимость обуславливают её использование в стереоселективном синтезе в качестве хирального исходного соединения. В частности, из неё получают такие редкие сахара, как D-псикозу[14].
Применение
Благодаря некоторым особенным свойствам фруктоза широко используется как подсластитель. Её повышенная сладость и синергетическое действие с другими подсластителями позволяет добавлять в продукты меньше сахара, поэтому её часто используют в низкокалорийной пище. Также она способна усиливать фруктовые вкусы. Фруктоза обладает высокой растворимостью при низких температурах и сильно понижает температуру плавления своих растворов, поэтому её использование представляет интерес в производстве мороженого, где эти свойства важны для текстуры продукта[15].
Фруктоза широко применяется в напитках (газированных, спортивных, низкокалорийных и т. д.), замороженных десертах, выпечке, консервированных фруктах, шоколаде, конфетах и молочных продуктах. Благодаря хорошей растворимости в этаноле она применяется в сладких ликёрах[15].
Биологическая роль
Всасывание фруктозы происходит в тонкой кишке за счёт облегчённой диффузии под действием белка-переносчика Glut5. В кровь фруктоза попадает через воротную вену, а затем переносится в печень, где преимущественно и накапливается. При повышенном потреблении она частично метаболизируется до лактата уже в слизистой кишечника, который затем в печени превращается в глюкозу. Фруктоза метаболизируется в организме путём фосфорилирования под действием фруктокиназы до фруктозо-1-фосфата. Он затем разлагается на дигидроксиацетонфосфат и D-глицериновый альдегид. Триозокиназа затем превращает последний в глицеральдегид-3-фосфат. Таким образом, при метаболизме фруктоза даёт преимущественно глюкозу, гликоген и лактат[16].
Влияние фруктозы на уровень глюкозы в крови очень маленькое. Её гликемический индекс равен 32, что объясняется её частичным превращением в глюкозу в печени. Фруктоза слабо стимулирует секрецию инсулина и может проникать в клетки без его участия, поэтому она рекомендована как подсластитель для диабетиков[16].
В литературе широко обсуждается влияние фруктозы на липидный состав сыворотки крови, в частности на уровень триглицеридов. Дискуссия возникла в связи с изменениями концентрации липидов в плазме при длительном чрезмерном употреблении углеводов[16].
С потреблением фруктозы связано такое редкое генетическое заболевание, как наследственная непереносимость фруктозы. Оно связано с отсутствием фермента, разлагающего фруктозо-1-фосфат, из-за чего происходит накопление последнего в печени. Это ведёт к блокировке гликолиза и глюконеогенеза, а затем к гипогликемии[16].
Примечания
- ↑ Рабинович В. А., Хавин З. Я. Краткий химический справочник. — 2-е издание. — Химия, 1978.
- ↑ 1 2 3 Ullmann, 2004, p. 104–106.
- ↑ D-(–)-Fructose (неопр.). Sigma-Aldrich. Дата обращения 16 апреля 2019.
- ↑ «Sur une propriété analytique des fermentations alcoolique et lactique, et sur leur application à l’étude des sucres» Архивировано 27 июня 2014 года. Annales de Chimie et de Physique, 21: 169—178.]
- ↑ Орлов Н.А. А. М. Бутлеров и его значение в современной химии. // Природа. — 1928. — № 12.
- ↑ 1 2 3 4 5 6 7 Ullmann, 2004, p. 103–104.
- ↑ Cockman M., Kubler D. G., Oswald A. S., Wilson L. The Mutarotation of Fructose and the Invertase Hydrolysis of Sucrose : [англ.] // Journal of Carbohydrate Chemistry. — 1987. — Vol. 6, no. 2. — P. 181–201. — DOI:10.1080/07328308708058870.
- ↑ 1 2 3 Химическая энциклопедия, 1998.
- ↑ Fontvieille A. M., Faurion A., Helal I., Rizkalla S. W., Falgon S., Letanoux M., Tchobroutsky G., Slama G. Relative Sweetness of Fructose Compared With Sucrose in Healthy and Diabetic Subjects : [англ.] // Diabetes Care. — 1989. — Vol. 12, no. 7. — P. 481–486. — DOI:10.2337/diacare.12.7.481.
- ↑ 1 2 3 Ullmann, 2004, p. 107.
- ↑ Ullmann, 2004, p. 108–109.
- ↑ 1 2 Ullmann, 2004, p. 109–110.
- ↑ Ullmann, 2004, p. 110.
- ↑ 1 2 3 4 5 Ullmann, 2004, p. 106–107.
- ↑ 1 2 Ullmann, 2004, p. 111.
- ↑ 1 2 3 4 Ullmann, 2004, p. 114–115.
Литература
Ссылки
См. также
| Общие: | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Геометрия | |||||||||||||||
| Моносахариды |
| ||||||||||||||
| Мультисахариды | |||||||||||||||
| Производные углеводов | |||||||||||||||
Фруктоза — Википедия
| Фруктоза | |
| Общие | |
|---|---|
| Систематическое наименование | (3S,4R,5R)-1,3,4,5,6-пентагидроксигексан-2-он (D-фруктоза), (3R,4S,5S)-1,3,4,5,6-пентагидроксигексан-2-он (L-фруктоза) |
| Традиционные названия | Фруктоза, фруктовый сахар, левулеза, арабино-гексулоза |
| Хим. формула | C6H12O6 |
| Физические свойства | |
| Состояние | Твёрдое |
| Молярная масса | 180,16 г/моль |
| Плотность | 1,695 г/см³ |
| Термические свойства | |
| Т. плав. | 103 °C |
| Т. кип. | 440 °C |
| Т. воспл. | 219 °C |
| Оптические свойства | |
| Показатель преломления | 1,617 |
| Классификация | |
| Рег. номер CAS | 57-48-7 |
| PubChem | 5984 |
| Рег. номер EINECS | 200-333-3 |
| SMILES | |
| InChI | |
| ChEBI | 48095 |
| ChemSpider | 5764 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Фруктоза (фруктовый сахар), C6H12O6 — моносахарид, кетоноспирт, кетогексоза, изомер глюкозы.
История
Фруктоза была открыта Дюбрунфо в 1847 г. в ходе сравнительного исследования молочнокислого и спиртового брожения инвертного сахара, полученного из сахарозы сахарного тростника. Дюбрунфо обнаружил, что в ходе молочнокислого брожения в ферментационной жидкости присутствует сахар, угол вращения которого отличается от уже известной в то время глюкозы.[1]
В 1861 году Бутлеров синтезировал смесь сахаров — «формозу» — конденсацией формальдегида (муравьиного альдегида) в присутствии катализаторов: Ba(OH)2 и Ca(OH)2, одним из компонентов этой смеси является фруктоза[2].
Физические свойства
Белое кристаллическое вещество, хорошо растворимое в воде. Температура плавления фруктозы ниже температуры плавления глюкозы. В 2 раза слаще глюкозы и в 4-5 раз слаще лактозы.
Химические свойства
В водных растворах фруктоза существует в виде смеси таутомеров, в которой преобладает β-D-Фруктопираноза, и содержится, при 20 °C, около 20 % β-D-Фруктофуранозы и около 5 % α-D-Фруктофуранозы[3]:
α-D-фруктофураноза — (2R,3S,4R,5R)-2,5-бис(гидроксиметил)оксолан-2,3,4-триол
α-L-фруктофураноза — (2S,3R,4S,5S)-2,5-бис(гидроксиметил)оксолан-2,3,4-триол
β-D-фруктофураноза — (2S,3S,4R,5R)-2,5-бис(гидроксиметил)оксолан-2,3,4-триол
β-L-фруктофураноза — (2R,3R,4S,5S)-2,5-бис(гидроксиметил)оксолан-2,3,4-триол
α-D-фруктопираноза — (2R,3S,4R,5R)-2-(гидроксиметил)-оксан-2,3,4,5-тетраол
α-L-фруктопираноза — (2S,3R,4S,5S)-2-(гидроксиметил)-оксан-2,3,4,5-тетраол
β-D-фруктопираноза — (2S,3S,4R,5R)-2-(гидроксиметил)-оксан-2,3,4,5-тетраол
β-L-фруктопираноза — (2R,3R,4S,5S)-2-(гидроксиметил)-оксан-2,3,4,5-тетраол
Из водных растворов D-фруктоза кристаллизуется в пиранозной форме (D-фpyктoпиpaнозa) — бесцветных кристаллов, хорошо растворимых в воде, при низких температурах — в виде моно- и полугидратов, выше 21,4 °C — в безводной форме.
По своим химическим свойствам фруктоза является типичной кетозой; восстанавливается с образованием смеси маннита и сорбита; с фенилгидразином она образует фенилозазон, идентичный фенилозазонам глюкозы и маннозы.
В отличие от глюкозы и других альдоз, фруктоза неустойчива как в щелочных, так и кислых растворах; разлагается в условиях кислотного гидролиза полисахаридов или гликозидов. Начальной стадией разложения фруктозы в присутствии кислот является дегидратация её фуранозной формы с образованием 5-метилолфурфурола, на чём основана качественная реакция на фруктозу в присутствии резорцина — проба Селиванова:
- Фруктоза окисляется KMnO4 в кислой среде, образуя щавелевую кислоту и винную кислоту.
Фруктоза и пищевой сахар
Молекула сахарозы (пищевого сахара) состоит из двух простых сахаридов: глюкозы и фруктозы, связаных α-1,2-гликозидной связью[4]. В организме сахароза расщепляется на глюкозу и фруктозу. Поэтому по своему действию сахароза эквивалентна смеси 50 % глюкозы и 50 % фруктозы.
Нахождение
В живых организмах обнаружен исключительно D-изомер фруктозы. В свободном виде фруктоза присутствует почти во всех сладких плодах, а также составляет до 80 % мёда, в качестве моносахаридного звена входит в состав сахарозы, которая в наибольшем количестве содержится в сахарной свекле и тростнике, моркови, ананасах, сорго.
Примечания
Ссылки
См. также
| Общие: | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Геометрия | |||||||||||||||
| Моносахариды |
| ||||||||||||||
| Мультисахариды | |||||||||||||||
| Производные углеводов | |||||||||||||||
Фруктоза — WiKi
Фруктоза (левулоза, фруктовый сахар), C6H12O6 — моносахарид из класса кетогексоз, изомер глюкозы. Один из наиболее распространённых в природе сахаров: встречается как в индивидуальном состоянии, так и в составе дисахаридов (сахарозы) и полисахаридов (инулина). Широко применяется в пищевой промышленности как подсластитель. Выполняет важные биохимические функции в организме человека.
| Фруктоза[1][2] | |
|---|---|
| ( {{{картинка}}}) | |
| Систематическое наименование | (3S,4R,5R)-1,3,4,5,6-пентагидроксигексан-2-он (D-фруктоза), (3R,4S,5S)-1,3,4,5,6-пентагидроксигексан-2-он (L-фруктоза) |
| Традиционные названия | Фруктоза, фруктовый сахар, плодовый сахар, левулоза, арабино-гексулоза |
| Хим. формула | C6H12O6 |
| Состояние | бесцветные кристаллы |
| Молярная масса | 180,159 г/моль |
| Плотность | 1,598 г/см³ |
| Температура | |
| • плавления | β-D-фруктоза: 102–104 °C |
| • кипения | 440 °C |
| • воспламенения | 219 °C |
| Энтальпия | |
| • плавления | 33,0 кДж/моль |
| • растворения | –37,69 кДж/кг |
| Константа диссоциации кислоты pKa{\displaystyle pK_{a}} | 11,90 |
| Растворимость | |
| • в воде | 400 г/100 мл |
| • в этаноле | 6,7118 °C г/100 мл |
| Вращение [α]D{\displaystyle [\alpha ]_{D}} | α-D-фруктоза: –133,5° → –92° β-D-фруктоза: –63,6° → –92° |
| Показатель преломления | 1,617 |
| Дипольный момент | 15,0 Д |
| Рег. номер CAS | 57-48-7 |
| PubChem | 5984 |
| Рег. номер EINECS | 200-333-3 |
| SMILES | |
| InChI | |
| ChEBI | 48095 |
| ChemSpider | 5764 |
| ЛД50 | 15 г/кг (кролики, внутривенно)[3] |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
| Медиафайлы на Викискладе | |
История
Фруктоза была открыта Дюбрунфо в 1847 г. в ходе сравнительного исследования молочнокислого и спиртового брожения сахара, полученного из сахарозы сахарного тростника. Дюбрунфо обнаружил, что в ходе молочнокислого брожения в ферментационной жидкости присутствует сахар, угол вращения которого отличается от уже известной в то время глюкозы[4].
В 1861 году Бутлеров синтезировал смесь сахаров — «формозу» — конденсацией формальдегида (муравьиного альдегида) в присутствии катализаторов: Ba(OH)2 и Ca(OH)2, одним из компонентов этой смеси является фруктоза[5].
Строение молекулы
Фруктоза является моносахаридом и принадлежит к классу кетогексоз. Это полигидроксикетон с кетогруппой при атоме C-2 и пятью гидроксильными группами. В структуре фруктозы есть три хиральных атома углерода, поэтому такой структуре соответствует восемь стереоизомеров (четыре пары энантиомеров): сама фруктоза, а также её стереоизомеры сорбоза, тагатоза и псикоза[6].
В твёрдом состоянии и в растворах фруктоза существует не в линейной форме, а в виде циклического полуацеталя, образованного в результате присоединения ОН-групп при атоме С-5 или С-6 к кетогруппе. Этот полуацеталь устойчив: в растворе доля открытоцепной формы составляет лишь 0,5 %, тогда как остальные 99,5 % приходятся на циклические формы. Если в циклизации участвует гидроксильная группа при С-5, образуется пятичленный цикл, который называется фуранозным (от названия фурана — пятичленного гетероцикла с одним атомом кислорода), а циклическую D-фруктозу называют D-фруктофуранозой. Если циклизация происходит за счёт гидроксильной группы при C-6, образуется шестичленный, пиранозный цикл (от названия пирана), а такая циклическая D-фруктоза называется D-фруктопиранозой[6].
Циклизация D-фруктозы в фуранозный и пиранозный циклПри описанной циклизации возникает новый стереоцентр при полуацетальном атоме углерода С-2, поэтому фуранозная и пиранозная формы D-фруктозы могут дополнительно существовать в виде двух диастереомеров, называемых аномерами: α-D-фруктофуранозы и β-D-фруктофуранозы; α-D-фруктопиранозы и β-D-фруктопиранозы. Обычно циклические формы D-фруктозы изображают при помощи проекций Хеуорса — идеализированных шестичленных циклов с заместителями над и под плоскостью цикла[6].
Более точно структуру аномеров D-фруктозы изображают в виде конформации «кресло», которая является наиболее устойчивой для пиранозного цикла, и в виде конформаций «конверт» и «твист» для фуранозного цикла. Точная конформация для фураноз неизвестна[6].
В растворе эти формы D-фруктозы находятся в равновесии. Среди них преобладает пиранозная форма, но при повышении температуры её доля немного уменьшается[7]. Преобладание β-D-фруктопиранозы объясняют наличием водородной связи между гидроксильными группами при С-1 и С-3. В 10%-ом растворе при комнатной температуре D-фруктоза имеет следующее распределение циклических форм:
- α-D-фруктофураноза — 5,5 %;
- β-D-фруктофураноза — 22,3 %;
- α-D-фруктопираноза — 0,5 %;
- β-D-фруктопираноза — 71,4 %[6].
Кристаллическая D-фруктоза представляет собой β-D-фруктопиранозу; другие циклические изомеры выделены только в виде производных. В таких соединениях, как сахароза, рафиноза и инулин, D-фруктоза находится в виде β-D-фруктофуранозы[6].
L-Фруктоза не встречается в природе, но её можно синтезировать химически либо получить микробиологически из L-маннозы или L-маннита[6].
Физические свойства
D-Фруктоза представляет собой бесцветные кристаллы в виде призм или игл с температурой плавления 103—105 °С. Обычно кристаллизуется в безводном виде, но ниже 20 °С устойчивы также полугидрат и дигидрат[8].
D-Фруктоза растворима в воде, пиридине, хинолине, ацетоне, метаноле, этаноле, ледяной уксусной кислоте. Её растворимость в воде выше, чем у других сахаров и составляет 4 г на 1 г воды при 25 °С. Доля сухого вещества в насыщенном растворе фруктозы при 20 °С составляет 78,9 %, а при 55 °С — 88,1 %. Из-за такой высокой растворимости при промышленной кристаллизации фруктозы из растворов возникают проблемы с высокой вязкостью этих растворов: при 50 °С динамическая вязкость насыщенного раствора фруктозы составляет 1630 мПа·с, тогда как для сахарозы она равна всего 96,5 мПа·с[2].
Фруктоза — самый сладкий из природных сахаров. Кристаллическая фруктоза в 1,8 раза слаще кристаллической сахарозы. Это позволяет рассматривать фруктозу как перспективный подсластитель, который обеспечивает такую же сладость, как сахароза, но при этом имеет более низкую пищевую ценность. Сладость фруктозы в растворах зависит от температуры, pH и концентрации: она повышается при охлаждении раствора (это объясняют повышением доли более сладких пиранозных форм[9]) и при подкислении раствора[2].
Получение
Сырьё для производства
Фруктоза широко представлена в природе как в индивидуальном виде, так и в составе сахарозы (в которую наряду с D-фруктозой входит остаток D-глюкозы). Во многих растениях встречаются полимеры D-фруктозы — фруктаны. Больше всего фруктозы содержится в мёде (40 г в 100 г), яблоках (6-8 г), грушах (5-9 г), черносливе (15 г)[10].
Наиболее экономически целесообразно в качестве сырья для производства фруктозы использовать крахмал, сахарозу и инулин. Крахмал производят преимущественно из кукурузы. Это полисахарид, который состоит из звеньев D-глюкозы. Поскольку фруктоза в крахмале не содержится, необходимо подобрать такой процесс, в котором глюкоза будет легко превращаться во фруктозу. Сахароза — это крупнотоннажный промышленный продукт, являющийся практически идеальным сырьём для производства фруктозы за счёт очень хорошей доступности, высокой чистоты и высокого изначального содержания фруктозы. Инулин — это фруктан, который получают из корней цикория (15-20 % от общей массы) и клубней артишока[10].
Производство из крахмала
Структура крахмалаФруктозу получают из крахмала в несколько стадий: крахмал разжижают (при этом происходит его частичный гидролиз), затем разлагают его до глюкозы, полученную глюкозу изомеризуют во фруктозу, фруктозу выделяют из раствора. Разработаны ферментативные способы этих преобразований. Например, крахмал превращают в глюкозу под действием α-амилазы и глюкоамилазы, а глюкозу во фруктозу — под действием глюкозоизомеразы. Глюкозоизомераза на самом деле называется ксилозоизомеразой, поскольку она также превращает D-ксилозу в D-ксилулозу, а D-рибозу — в D-рибулозу. Способ получения фруктозы из крахмала был разработан в 1966 году. С 1968 года так получают 42%-ый фруктозный сироп. Хроматографическая очистка позволяет повысить чистоту фруктозы до 90 %[10].
Производство из сахарозы
Структура сахарозыНа основе сахарозы был создан первый коммерческий способ получения фруктозы: сахарозу гидролизовали, после чего полученные фруктозу и глюкозу разделяли хроматографически. Современные методы позволяют проводить гидролиз сахарозы высокоселективным ферментативным способом (под действием β-фруктофуранозидазы из Saccharomyces cerevisea) либо минеральными кислотами (соляной или серной). Недостатком первого способа является высокая цена фермента и невозможность проводить непрерывный процесс. С другой стороны, при гидролизе минеральными кислотами образуются нежелательные побочные продукты. Наиболее продвинутым способом является гидролиз иммобилизованными сильнокислыми катионитами: он позволяет гидролизовать 50-60%-ые растворы сахарозы при температуре 30-45 °С практически без образования побочных продуктов. Полученные сахара разделяют хроматографией, получая две фракции с чистотой выше 95 %[11].
Производство из инулина
Структура инулинаПроизводство фруктозы из инулина, который в свою очередь получается из цикория, было организовано в середине 1990-х годов. В основе этого метода также лежит гидролиз, который можно реализовать ферментативно или под действием кислот. Кислотный гидролиз представляет лишь научный интерес, поскольку различные испытанные кислоты (серная, соляная, фосфорная, лимонная, щавелевая, винная) приводили к разложению фруктозы и образованию побочных продуктов. Ведётся поиск других кислотных катализаторов, среди которых более мягкими показали себя цеолиты[12].
Среди ферментов выгодно отличаются экзоинулиназа и эндоинулиназа из Aspergillus niger, смесь которых позволяет превратить инулин во фруктозу в одну стадию. Производство фруктозы из крахмала требует гораздо больше ферментативных стадий и даёт выход фруктозы лишь в 45 %. Гидролиз проводится в нейтральной или слабокислой среде при 60 °С и занимает 12-24 ч. Содержание фруктозы в сиропе составляет 85-95 %; остальное приходится на глюкозу (3-13 %) и олигосахариды (1-2 %). Полученный сироп очищают от неорганических примесей, обесцвечивают и концентрируют[12].
Получение кристаллической фруктозы
Кристаллическая фруктозаКристаллизация фруктозы после синтеза является сложной стадией, поэтому необходимо, чтобы раствор содержал минимум 90 % фруктозы от общей массы растворённых веществ. Применяют различные комбинации условий, включая кристаллизацию при атмосферном либо пониженном давлении, различные режимы охлаждения, непрерывные или периодические процессы, однако в качестве растворителя всегда используется вода, поскольку отделение и регенерация растворителя требует слишком много усилий. Кристаллический продукт отделяют от маточного раствора в центрифугах, а затем сушат. Кристаллизации мешает примесь глюкозы: она повышает растворимость фруктозы в воде и снижает пересыщенность раствора. Также в процессе кристаллизации образуются димеры фруктозы, которые сокристаллизуются с фруктозой и мешают росту кристаллов[13].
Химические свойства
Фруктоза вступает в химические реакции, типичные для моносахаридов, образуя простые и сложные эфиры, а также ацетали и гликозиды. За счёт наличия карбонильной группы она даёт продукты присоединения нуклеофильных реагентов: аминов, аминокислот, пептидов и др. С фенилгидразином она даёт озазон, идентичный озазону глюкозы или маннозы[14][8].
Фруктозу можно восстановить, в том числе ферментативно, до маннита или сорбита. На каталитическом гидрировании карбонильной группы фруктозы в присутствии никелевого или медного катализатора основан промышленный способ получения маннита. В промышленности также проводят каталитическое окисление фруктозы воздухом или кислородом в присутствии катализаторов на основе благородных металлов. При этом образуются два основных продукта: 2-кето-D-глюконовая кислота и 5-кетофруктоза[14].
В отличие от глюкозы и других альдоз, фруктоза неустойчива как в щелочных, так и кислых растворах. В щелочной среде фруктоза через ендиольную форму изомеризуется в глюкозу и маннозу с небольшой примесью псикозы (перегруппировка Лобри де Брюина — Ван Экенштейна). При нагревании в щелочных условиях фруктоза фрагментируется, давая глицеральдегиды, молочную кислоту, метилглиоксаль и другие продукты разложения[14][8]}.
При нагревании твёрдой фруктозы или её насыщенного раствора приводит к дегидратации и образованию продуктов конденсации. Нагревание в присутствии аминокислот приводит к окрашенным и пахучим продуктам реакции Майяра. При нагревании в присутствии кислоты также происходит дегидратация и образуется 5-гидроксиметилфурфурол. Это свойство является основой для качественной реакции на фруктозу — пробы Селиванова[14].
Доступность D-фруктозы и её низкая стоимость обуславливают её использование в стереоселективном синтезе в качестве хирального исходного соединения. В частности, из неё получают такие редкие сахара, как D-псикозу[14].
Применение
Благодаря некоторым особенным свойствам фруктоза широко используется как подсластитель. Её повышенная сладость и синергетическое действие с другими подсластителями позволяет добавлять в продукты меньше сахара, поэтому её часто используют в низкокалорийной пище. Также она способна усиливать фруктовые вкусы. Фруктоза обладает высокой растворимостью при низких температурах и сильно понижает температуру плавления своих растворов, поэтому её использование представляет интерес в производстве мороженого, где эти свойства важны для текстуры продукта[15].
Фруктоза широко применяется в напитках (газированных, спортивных, низкокалорийных и т. д.), замороженных десертах, выпечке, консервированных фруктах, шоколаде, конфетах и молочных продуктах. Благодаря хорошей растворимости в этаноле она применяется в сладких ликёрах[15].
Биологическая роль
Всасывание фруктозы происходит в тонкой кишке за счёт облегчённой диффузии под действием белка-переносчика Glut5. В кровь фруктоза попадает через воротную вену, а затем переносится в печень, где преимущественно и накапливается. При повышенном потреблении она частично метаболизируется до лактата уже в слизистой кишечника, который затем в печени превращается в глюкозу. Фруктоза метаболизируется в организме путём фосфорилирования под действием фруктокиназы до фруктозо-1-фосфата. Он затем разлагается на дигидроксиацетонфосфат и D-глицериновый альдегид. Триозокиназа затем превращает последний в глицеральдегид-3-фосфат. Таким образом, при метаболизме фруктоза даёт преимущественно глюкозу, гликоген и лактат[16].
Влияние фруктозы на уровень глюкозы в крови очень маленькое. Её гликемический индекс равен 32, что объясняется её частичным превращением в глюкозу в печени. Фруктоза слабо стимулирует секрецию инсулина и может проникать в клетки без его участия, поэтому она рекомендована как подсластитель для диабетиков[16].
В литературе широко обсуждается влияние фруктозы на липидный состав сыворотки крови, в частности на уровень триглицеридов. Дискуссия возникла в связи с изменениями концентрации липидов в плазме при длительном чрезмерном употреблении углеводов[16].
С потреблением фруктозы связано такое редкое генетическое заболевание, как наследственная непереносимость фруктозы. Оно связано с отсутствием фермента, разлагающего фруктозо-1-фосфат, из-за чего происходит накопление последнего в печени. Это ведёт к блокировке гликолиза и глюконеогенеза, а затем к гипогликемии[16].
Примечания
- ↑ Рабинович В. А., Хавин З. Я. Краткий химический справочник. — 2-е издание. — Химия, 1978.
- ↑ 1 2 3 Ullmann, 2004, p. 104–106.
- ↑ D-(–)-Fructose (неопр.). Sigma-Aldrich. Дата обращения 16 апреля 2019.
- ↑ «Sur une propriété analytique des fermentations alcoolique et lactique, et sur leur application à l’étude des sucres» Архивировано 27 июня 2014 года. Annales de Chimie et de Physique, 21: 169—178.]
- ↑ Орлов Н.А. А. М. Бутлеров и его значение в современной химии. // Природа. — 1928. — № 12.
- ↑ 1 2 3 4 5 6 7 Ullmann, 2004, p. 103–104.
- ↑ Cockman M., Kubler D. G., Oswald A. S., Wilson L. The Mutarotation of Fructose and the Invertase Hydrolysis of Sucrose : [англ.] // Journal of Carbohydrate Chemistry. — 1987. — Vol. 6, no. 2. — P. 181–201. — DOI:10.1080/07328308708058870.
- ↑ 1 2 3 Химическая энциклопедия, 1998.
- ↑ Fontvieille A. M., Faurion A., Helal I., Rizkalla S. W., Falgon S., Letanoux M., Tchobroutsky G., Slama G. Relative Sweetness of Fructose Compared With Sucrose in Healthy and Diabetic Subjects : [англ.] // Diabetes Care. — 1989. — Vol. 12, no. 7. — P. 481–486. — DOI:10.2337/diacare.12.7.481.
- ↑ 1 2 3 Ullmann, 2004, p. 107.
- ↑ Ullmann, 2004, p. 108–109.
- ↑ 1 2 Ullmann, 2004, p. 109–110.
- ↑ Ullmann, 2004, p. 110.
- ↑ 1 2 3 4 5 Ullmann, 2004, p. 106–107.
- ↑ 1 2 Ullmann, 2004, p. 111.
- ↑ 1 2 3 4 Ullmann, 2004, p. 114–115.
Литература
Ссылки
См. также
Фруктоза — Gpedia, Your Encyclopedia
| Фруктоза[1][2] | |
|---|---|
 ( {{{картинка}}}) | |
| Систематическое наименование | (3S,4R,5R)-1,3,4,5,6-пентагидроксигексан-2-он (D-фруктоза), (3R,4S,5S)-1,3,4,5,6-пентагидроксигексан-2-он (L-фруктоза) |
| Традиционные названия | Фруктоза, фруктовый сахар, плодовый сахар, левулоза, арабино-гексулоза |
| Хим. формула | C6H12O6 |
| Состояние | бесцветные кристаллы |
| Молярная масса | 180,159 г/моль |
| Плотность | 1,598 г/см³ |
| Температура | |
| • плавления | β-D-фруктоза: 102–104 °C |
| • кипения | 440 °C |
| • воспламенения | 219 °C |
| Энтальпия | |
| • плавления | 33,0 кДж/моль |
| • растворения | –37,69 кДж/кг |
| Константа диссоциации кислоты pKa{\displaystyle pK_{a}} | 11,90 |
| Растворимость | |
| • в воде | 400 г/100 мл |
| • в этаноле | 6,7118 °C г/100 мл |
| Вращение [α]D{\displaystyle [\alpha ]_{D}} | α-D-фруктоза: –133,5° → –92° β-D-фруктоза: –63,6° → –92° |
| Показатель преломления | 1,617 |
| Дипольный момент | 15,0 Д |
| Рег. номер CAS | 57-48-7 |
| PubChem | 5984 |
| Рег. номер EINECS | 200-333-3 |
| SMILES | |
| InChI | |
| ChEBI | 48095 |
| ChemSpider | 5764 |
| ЛД50 | 15 г/кг (кролики, внутривенно)[3] |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |
Фруктоза (левулоза, фруктовый сахар), C6H12O6 — моносахарид из класса кетогексоз, изомер глюкозы. Один из наиболее распространённых в природе сахаров: встречается как в индивидуальном состоянии, так и в составе дисахаридов (сахарозы) и полисахаридов (инулина). Широко применяется в пищевой промышленности как подсластитель. Выполняет важные биохимические функции в организме человека.
История
Фруктоза была открыта Дюбрунфо в 1847 г. в ходе сравнительного исследования молочнокислого и спиртового брожения сахара, полученного из сахарозы сахарного тростника. Дюбрунфо обнаружил, что в ходе молочнокислого брожения в ферментационной жидкости присутствует сахар, угол вращения которого отличается от уже известной в то время глюкозы[4].
В 1861 году Бутлеров синтезировал смесь сахаров — «формозу» — конденсацией формальдегида (муравьиного альдегида) в присутствии катализаторов: Ba(OH)2 и Ca(OH)2, одним из компонентов этой смеси является фруктоза[5].
Строение молекулы
Фруктоза является моносахаридом и принадлежит к классу кетогексоз. Это полигидроксикетон с кетогруппой при атоме C-2 и пятью гидроксильными группами. В структуре фруктозы есть три хиральных атома углерода, поэтому такой структуре соответствует восемь стереоизомеров (четыре пары энантиомеров): сама фруктоза, а также её стереоизомеры сорбоза, тагатоза и псикоза[6].
В твёрдом состоянии и в растворах фруктоза существует не в линейной форме, а в виде циклического полуацеталя, образованного в результате присоединения ОН-групп при атоме С-5 или С-6 к кетогруппе. Этот полуацеталь устойчив: в растворе доля открытоцепной формы составляет лишь 0,5 %, тогда как остальные 99,5 % приходятся на циклические формы. Если в циклизации участвует гидроксильная группа при С-5, образуется пятичленный цикл, который называется фуранозным (от названия фурана — пятичленного гетероцикла с одним атомом кислорода), а циклическую D-фруктозу называют D-фруктофуранозой. Если циклизация происходит за счёт гидроксильной группы при C-6, образуется шестичленный, пиранозный цикл (от названия пирана), а такая циклическая D-фруктоза называется D-фруктопиранозой[6].
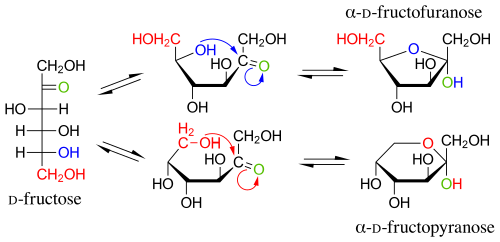 Циклизация D-фруктозы в фуранозный и пиранозный цикл
Циклизация D-фруктозы в фуранозный и пиранозный циклПри описанной циклизации возникает новый стереоцентр при полуацетальном атоме углерода С-2, поэтому фуранозная и пиранозная формы D-фруктозы могут дополнительно существовать в виде двух диастереомеров, называемых аномерами: α-D-фруктофуранозы и β-D-фруктофуранозы; α-D-фруктопиранозы и β-D-фруктопиранозы. Обычно циклические формы D-фруктозы изображают при помощи проекций Хеуорса — идеализированных шестичленных циклов с заместителями над и под плоскостью цикла[6].
Более точно структуру аномеров D-фруктозы изображают в виде конформации «кресло», которая является наиболее устойчивой для пиранозного цикла, и в виде конформаций «конверт» и «твист» для фуранозного цикла. Точная конформация для фураноз неизвестна[6].
В растворе эти формы D-фруктозы находятся в равновесии. Среди них преобладает пиранозная форма, но при повышении температуры её доля немного уменьшается[7]. Преобладание β-D-фруктопиранозы объясняют наличием водородной связи между гидроксильными группами при С-1 и С-3. В 10%-ом растворе при комнатной температуре D-фруктоза имеет следующее распределение циклических форм:
- α-D-фруктофураноза — 5,5 %;
- β-D-фруктофураноза — 22,3 %;
- α-D-фруктопираноза — 0,5 %;
- β-D-фруктопираноза — 71,4 %[6].
Кристаллическая D-фруктоза представляет собой β-D-фруктопиранозу; другие циклические изомеры выделены только в виде производных. В таких соединениях, как сахароза, рафиноза и инулин, D-фруктоза находится в виде β-D-фруктофуранозы[6].
L-Фруктоза не встречается в природе, но её можно синтезировать химически либо получить микробиологически из L-маннозы или L-маннита[6].
Физические свойства
D-Фруктоза представляет собой бесцветные кристаллы в виде призм или игл с температурой плавления 103—105 °С. Обычно кристаллизуется в безводном виде, но ниже 20 °С устойчивы также полугидрат и дигидрат[8].
D-Фруктоза растворима в воде, пиридине, хинолине, ацетоне, метаноле, этаноле, ледяной уксусной кислоте. Её растворимость в воде выше, чем у других сахаров и составляет 4 г на 1 г воды при 25 °С. Доля сухого вещества в насыщенном растворе фруктозы при 20 °С составляет 78,9 %, а при 55 °С — 88,1 %. Из-за такой высокой растворимости при промышленной кристаллизации фруктозы из растворов возникают проблемы с высокой вязкостью этих растворов: при 50 °С динамическая вязкость насыщенного раствора фруктозы составляет 1630 мПа·с, тогда как для сахарозы она равна всего 96,5 мПа·с[2].
Фруктоза — самый сладкий из природных сахаров. Кристаллическая фруктоза в 1,8 раза слаще кристаллической сахарозы. Это позволяет рассматривать фруктозу как перспективный подсластитель, который обеспечивает такую же сладость, как сахароза, но при этом имеет более низкую пищевую ценность. Сладость фруктозы в растворах зависит от температуры, pH и концентрации: она повышается при охлаждении раствора (это объясняют повышением доли более сладких пиранозных форм[9]) и при подкислении раствора[2].
Получение
Сырьё для производства
Фруктоза широко представлена в природе как в индивидуальном виде, так и в составе сахарозы (в которую наряду с D-фруктозой входит остаток D-глюкозы). Во многих растениях встречаются полимеры D-фруктозы — фруктаны. Больше всего фруктозы содержится в мёде (40 г в 100 г), яблоках (6-8 г), грушах (5-9 г), черносливе (15 г)[10].
Наиболее экономически целесообразно в качестве сырья для производства фруктозы использовать крахмал, сахарозу и инулин. Крахмал производят преимущественно из кукурузы. Это полисахарид, который состоит из звеньев D-глюкозы. Поскольку фруктоза в крахмале не содержится, необходимо подобрать такой процесс, в котором глюкоза будет легко превращаться во фруктозу. Сахароза — это крупнотоннажный промышленный продукт, являющийся практически идеальным сырьём для производства фруктозы за счёт очень хорошей доступности, высокой чистоты и высокого изначального содержания фруктозы. Инулин — это фруктан, который получают из корней цикория (15-20 % от общей массы) и клубней артишока[10].
Производство из крахмала
 Структура крахмала
Структура крахмалаФруктозу получают из крахмала в несколько стадий: крахмал разжижают (при этом происходит его частичный гидролиз), затем разлагают его до глюкозы, полученную глюкозу изомеризуют во фруктозу, фруктозу выделяют из раствора. Разработаны ферментативные способы этих преобразований. Например, крахмал превращают в глюкозу под действием α-амилазы и глюкоамилазы, а глюкозу во фруктозу — под действием глюкозоизомеразы. Глюкозоизомераза на самом деле называется ксилозоизомеразой, поскольку она также превращает D-ксилозу в D-ксилулозу, а D-рибозу — в D-рибулозу. Способ получения фруктозы из крахмала был разработан в 1966 году. С 1968 года так получают 42%-ый фруктозный сироп. Хроматографическая очистка позволяет повысить чистоту фруктозы до 90 %[10].
Производство из сахарозы
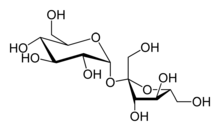 Структура сахарозы
Структура сахарозыНа основе сахарозы был создан первый коммерческий способ получения фруктозы: сахарозу гидролизовали, после чего полученные фруктозу и глюкозу разделяли хроматографически. Современные методы позволяют проводить гидролиз сахарозы высокоселективным ферментативным способом (под действием β-фруктофуранозидазы из Saccharomyces cerevisea) либо минеральными кислотами (соляной или серной). Недостатком первого способа является высокая цена фермента и невозможность проводить непрерывный процесс. С другой стороны, при гидролизе минеральными кислотами образуются нежелательные побочные продукты. Наиболее продвинутым способом является гидролиз иммобилизованными сильнокислыми катионитами: он позволяет гидролизовать 50-60%-ые растворы сахарозы при температуре 30-45 °С практически без образования побочных продуктов. Полученные сахара разделяют хроматографией, получая две фракции с чистотой выше 95 %[11].
Производство из инулина
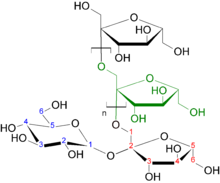 Структура инулина
Структура инулинаПроизводство фруктозы из инулина, который в свою очередь получается из цикория, было организовано в середине 1990-х годов. В основе этого метода также лежит гидролиз, который можно реализовать ферментативно или под действием кислот. Кислотный гидролиз представляет лишь научный интерес, поскольку различные испытанные кислоты (серная, соляная, фосфорная, лимонная, щавелевая, винная) приводили к разложению фруктозы и образованию побочных продуктов. Ведётся поиск других кислотных катализаторов, среди которых более мягкими показали себя цеолиты[12].
Среди ферментов выгодно отличаются экзоинулиназа и эндоинулиназа из Aspergillus niger, смесь которых позволяет превратить инулин во фруктозу в одну стадию. Производство фруктозы из крахмала требует гораздо больше ферментативных стадий и даёт выход фруктозы лишь в 45 %. Гидролиз проводится в нейтральной или слабокислой среде при 60 °С и занимает 12-24 ч. Содержание фруктозы в сиропе составляет 85-95 %; остальное приходится на глюкозу (3-13 %) и олигосахариды (1-2 %). Полученный сироп очищают от неорганических примесей, обесцвечивают и концентрируют[12].
Получение кристаллической фруктозы
Кристаллическая фруктозаКристаллизация фруктозы после синтеза является сложной стадией, поэтому необходимо, чтобы раствор содержал минимум 90 % фруктозы от общей массы растворённых веществ. Применяют различные комбинации условий, включая кристаллизацию при атмосферном либо пониженном давлении, различные режимы охлаждения, непрерывные или периодические процессы, однако в качестве растворителя всегда используется вода, поскольку отделение и регенерация растворителя требует слишком много усилий. Кристаллический продукт отделяют от маточного раствора в центрифугах, а затем сушат. Кристаллизации мешает примесь глюкозы: она повышает растворимость фруктозы в воде и снижает пересыщенность раствора. Также в процессе кристаллизации образуются димеры фруктозы, которые сокристаллизуются с фруктозой и мешают росту кристаллов[13].
Химические свойства
Фруктоза вступает в химические реакции, типичные для моносахаридов, образуя простые и сложные эфиры, а также ацетали и гликозиды. За счёт наличия карбонильной группы она даёт продукты присоединения нуклеофильных реагентов: аминов, аминокислот, пептидов и др. С фенилгидразином она даёт озазон, идентичный озазону глюкозы или маннозы[14][8].
Фруктозу можно восстановить, в том числе ферментативно, до маннита или сорбита. На каталитическом гидрировании карбонильной группы фруктозы в присутствии никелевого или медного катализатора основан промышленный способ получения маннита. В промышленности также проводят каталитическое окисление фруктозы воздухом или кислородом в присутствии катализаторов на основе благородных металлов. При этом образуются два основных продукта: 2-кето-D-глюконовая кислота и 5-кетофруктоза[14].
В отличие от глюкозы и других альдоз, фруктоза неустойчива как в щелочных, так и кислых растворах. В щелочной среде фруктоза через ендиольную форму изомеризуется в глюкозу и маннозу с небольшой примесью псикозы (перегруппировка Лобри де Брюина — Ван Экенштейна). При нагревании в щелочных условиях фруктоза фрагментируется, давая глицеральдегиды, молочную кислоту, метилглиоксаль и другие продукты разложения[14][8]}.
При нагревании твёрдой фруктозы или её насыщенного раствора приводит к дегидратации и образованию продуктов конденсации. Нагревание в присутствии аминокислот приводит к окрашенным и пахучим продуктам реакции Майяра. При нагревании в присутствии кислоты также происходит дегидратация и образуется 5-гидроксиметилфурфурол. Это свойство является основой для качественной реакции на фруктозу — пробы Селиванова[14].

Доступность D-фруктозы и её низкая стоимость обуславливают её использование в стереоселективном синтезе в качестве хирального исходного соединения. В частности, из неё получают такие редкие сахара, как D-псикозу[14].
Применение
Благодаря некоторым особенным свойствам фруктоза широко используется как подсластитель. Её повышенная сладость и синергетическое действие с другими подсластителями позволяет добавлять в продукты меньше сахара, поэтому её часто используют в низкокалорийной пище. Также она способна усиливать фруктовые вкусы. Фруктоза обладает высокой растворимостью при низких температурах и сильно понижает температуру плавления своих растворов, поэтому её использование представляет интерес в производстве мороженого, где эти свойства важны для текстуры продукта[15].
Фруктоза широко применяется в напитках (газированных, спортивных, низкокалорийных и т. д.), замороженных десертах, выпечке, консервированных фруктах, шоколаде, конфетах и молочных продуктах. Благодаря хорошей растворимости в этаноле она применяется в сладких ликёрах[15].
Биологическая роль
Всасывание фруктозы происходит в тонкой кишке за счёт облегчённой диффузии под действием белка-переносчика Glut5. В кровь фруктоза попадает через воротную вену, а затем переносится в печень, где преимущественно и накапливается. При повышенном потреблении она частично метаболизируется до лактата уже в слизистой кишечника, который затем в печени превращается в глюкозу. Фруктоза метаболизируется в организме путём фосфорилирования под действием фруктокиназы до фруктозо-1-фосфата. Он затем разлагается на дигидроксиацетонфосфат и D-глицериновый альдегид. Триозокиназа затем превращает последний в глицеральдегид-3-фосфат. Таким образом, при метаболизме фруктоза даёт преимущественно глюкозу, гликоген и лактат[16].
Влияние фруктозы на уровень глюкозы в крови очень маленькое. Её гликемический индекс равен 32, что объясняется её частичным превращением в глюкозу в печени. Фруктоза слабо стимулирует секрецию инсулина и может проникать в клетки без его участия, поэтому она рекомендована как подсластитель для диабетиков[16].
В литературе широко обсуждается влияние фруктозы на липидный состав сыворотки крови, в частности на уровень триглицеридов. Дискуссия возникла в связи с изменениями концентрации липидов в плазме при длительном чрезмерном употреблении углеводов[16].
С потреблением фруктозы связано такое редкое генетическое заболевание, как наследственная непереносимость фруктозы. Оно связано с отсутствием фермента, разлагающего фруктозо-1-фосфат, из-за чего происходит накопление последнего в печени. Это ведёт к блокировке гликолиза и глюконеогенеза, а затем к гипогликемии[16].
Примечания
- ↑ Рабинович В. А., Хавин З. Я. Краткий химический справочник. — 2-е издание. — Химия, 1978.
- ↑ 1 2 3 Ullmann, 2004, p. 104–106.
- ↑ D-(–)-Fructose (неопр.). Sigma-Aldrich. Дата обращения 16 апреля 2019.
- ↑ «Sur une propriété analytique des fermentations alcoolique et lactique, et sur leur application à l’étude des sucres» Архивировано 27 июня 2014 года. Annales de Chimie et de Physique, 21: 169—178.]
- ↑ Орлов Н.А. А. М. Бутлеров и его значение в современной химии. // Природа. — 1928. — № 12.
- ↑ 1 2 3 4 5 6 7 Ullmann, 2004, p. 103–104.
- ↑ Cockman M., Kubler D. G., Oswald A. S., Wilson L. The Mutarotation of Fructose and the Invertase Hydrolysis of Sucrose : [англ.] // Journal of Carbohydrate Chemistry. — 1987. — Vol. 6, no. 2. — P. 181–201. — DOI:10.1080/07328308708058870.
- ↑ 1 2 3 Химическая энциклопедия, 1998.
- ↑ Fontvieille A. M., Faurion A., Helal I., Rizkalla S. W., Falgon S., Letanoux M., Tchobroutsky G., Slama G. Relative Sweetness of Fructose Compared With Sucrose in Healthy and Diabetic Subjects : [англ.] // Diabetes Care. — 1989. — Vol. 12, no. 7. — P. 481–486. — DOI:10.2337/diacare.12.7.481.
- ↑ 1 2 3 Ullmann, 2004, p. 107.
- ↑ Ullmann, 2004, p. 108–109.
- ↑ 1 2 Ullmann, 2004, p. 109–110.
- ↑ Ullmann, 2004, p. 110.
- ↑ 1 2 3 4 5 Ullmann, 2004, p. 106–107.
- ↑ 1 2 Ullmann, 2004, p. 111.
- ↑ 1 2 3 4 Ullmann, 2004, p. 114–115.
Литература
Ссылки
См. также
| Общие: | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Геометрия | |||||||||||||||
| Моносахариды |
| ||||||||||||||
| Мультисахариды | |||||||||||||||
| Производные углеводов | |||||||||||||||
Фруктозо-1,6-бисфосфат — Википедия
Материал из Википедии — свободной энциклопедии
| Фруктозо-1,6-бисфосфат | |
|---|---|
| ( {{{картинка}}}) | |
| Хим. формула | C6H14O12P2 |
| Молярная масса | 340.116 г/моль г/моль |
| Рег. номер CAS | 488-69-7 |
| PubChem | 445557 |
| Рег. номер EINECS | 207-683-6 |
| SMILES | |
| InChI | 1S/C6h24O12P2/c7-4-3(1-16-19(10,11)12)18-6(9,5(4)8)2-17-20(13,14)15/h4-5,7-9H,1-2h3,(h3,10,11,12)(h3,13,14,15)/t3-,4-,5+,6-/m1/s1 |
| ChEBI | 40595 |
| ChemSpider | 393165 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |
Фруктозо-1,6-бисфосфат — органическое соединение, сложный эфир фруктозы и ортофосфорной кислоты, продукт ферментативного окисления глюкозы, важнейший интермедиат (промежуточное соединение) гликолиза. Образуется в ходе фосфофруктокиназной реакции из фруктозо-6-фосфата с использованием энергии аденозинтрифосфорной кислоты (АТФ). Фактически эта реакция является лимитирующей в скорости протекания гликолиза и её регуляция определяет интенсивность гликолиза в целом. Способность к образованию и метаболизму фруктозо-1,6-бисфосфата различна в разных органах млекопитающих. В живых организмах присутствует единственная биологически активная форма этого соединения — β-D изомер[1].
Введенная извне обладает мощным органопротективным действием при различных патологических состояниях, связанных с дефицитом кислорода. Основной механизм действия экзогенного фруктозо-1,6-бисфосфата связан с субстратной активацией фосфофруктокиназы, пируваткиназы и лактаткиназы и, в конечном итоге, с увеличением внутриклеточного высокоэнергетического фосфатного пула. Его внутриклеточная концентрация варьирует в зависимости от «специализации» клетки. Концентрация фруктозо-1,6-бисфосфата внутри человеческих эритроцитов составляет 6-10 мг/л клеток. Фруктозо-1,6-бисфосфат показывает значительную протективную активность при геморрагическом и травматическом шоках и содействует успешной реанимации. Также это соединение обладает выраженным защитным эффектом на ткань головного мозга, снижая последствия гипоксического стресса. Нейропротекторное действие фруктозо-1,6-бисфосфата против различных нейротоксических факторов связано с тороможением синтеза бета-амилоида. При этом играет роль не только стимулирование энергетических ресурсов, а также возможность фруктозо-1,6-бисфосфата выступать в качестве модулятора сигнальных систем (протеинкиназ и фосфолипаз) PLC и MEK/ERK в регуляции гомеостаза кальция внутри митохондрий. Доказаное антиконвульсивное (противоэпилептическое) действие ФДФ, по-видимому, связано со способностью нормализовать уровень кальция в нейронах. Эффекты фруктозо-1,6-бисфосфата усиливаются другими макроэргическими соединеними однонаправленного действия (фосфокреатином, 2,3-фосфоглицератом).
В последнее время установлен существенный антиагрегантный эффект ФДФ, связанный с блокадой АДФ-рецепторов тромбоцитов, что может иметь важное клиническое значение в профилактике кардио-васкулярных событий. Кроме того, в ходе рандомизированных контролированных исследований установлен[2] кардиозащитный эффект фруктозо-1,6-бисфосфата при передозировке сердечных гликозидов.
В последнее время с помощью применения фруктозо-1,6-бисфосфата связывают надежды в профилактике ряда заболеваний сердечно-сосудистой системы, таких как метаболический синдром, сахарный диабет, атеросклероз. Предложены подходы по влиянию на новые факторы риска[3], где гипофосфатемия рассматривается[4] как независимый фактор риска.
Последние исследования показали способность фруктозо-1,6-бисфосфата хелатировать ионы Fe2+, стабилизируя их. В физиологических условиях ионы Fe2+ могут окислятся в Fe3+, что способствует образованию активных форм кислорода. Накопление ионов железа связывают с такими заболеваниями, как болезнь Альцгеймера и болезнь Паркинсона, однако до сих пор доподлинно не известно, является ли избыток железа важным фактором в развитии этих заболеваний и может ли фруктозо-1,6-бисфосфат помочь нивелировать этот эффект[5].
- В. П. Комов, В. Н. Шведова. Биохимия. — «Дрофа», 2004. — 638 с.
| Условия поставки | DDP клиент, склады: г. Иркутск, г. Красноярск, г. Новосибирск, г. Дзержинск, г. Екатеринбург, г. Москва, г. Санкт-Петербург |
Фруктоза применяется как заменитель сахара, консервант и усилитель ягодного аромата при производстве: продуктов с пониженной калорийностью; Общеупотребительные названия продукта: арабино-гексулоза, левулёза, фруктовый сахар, плодовый сахар, d(-)-фруктоза, D-Фруктоза, fructose
|
