Глюкоза — Википедия
Материал из Википедии — свободной энциклопедии
| Глюкоза | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | (2R,3S,4R,5R)-2,3,4,5,6-пентагидроксигексаналь (D-глюкоза), (2S,3R,4S,5S)-2,3,4,5,6-пентагидроксигексаналь (L-глюкоза) |
| Традиционные названия | Глюкоза, глюкогексоза |
| Хим. формула | С6H12O6 |
| Физические свойства | |
| Молярная масса | 180,16 г/моль |
| Плотность | 1.54-1,60 г/см³ |
| Термические свойства | |
| Т. плав. | α—D-глюкоза: 146 °C β—D-глюкоза: 150 °C |
| Классификация | |
| Рег. номер CAS | 50-99-7 (D-глюкоза) 921-60-8 (L-глюкоза) |
| Рег. номер EINECS | 200-075-1 |
| RTECS | LZ6600000 |
| ChEBI | 17234 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Глюко́за, или виноградный сахар, или декстроза (D-глюкоза), С6H12O6 — органическое соединение, моносахарид (шестиатомный гидроксиальдегид, гексоза), один из самых распространённых источников энергии в живых организмах на планете[1]. Встречается в соке многих фруктов и ягод, в том числе и винограда, от чего и произошло название этого вида сахара. Глюкозное звено входит в состав полисахаридов (целлюлоза, крахмал, гликоген) и ряда дисахаридов (мальтозы, лактозы и сахарозы), которые, например, в пищеварительном тракте быстро расщепляются на глюкозу и фруктозу.
Физические свойства
Бесцветное кристаллическое вещество без запаха. Обладает сладким вкусом, растворимо в воде, в реактиве Швейцера (аммиачном растворе гидроксида меди [Cu(NH3)4](OH)2), в концентрированном растворе хлорида цинка и концентрированном растворе серной кислоты.
В 2 раза менее сладкая, чем сахароза.
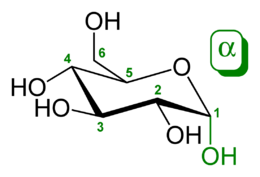
Строение молекулы
Глюкоза может существовать в виде циклов (α- и β-глюкозы) и в виде линейной формы (D-глюкоза).
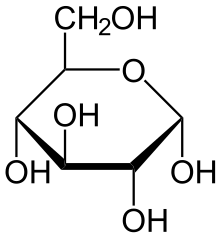
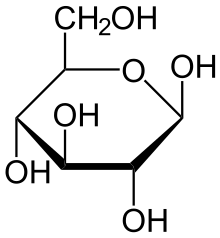
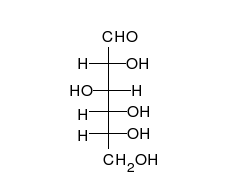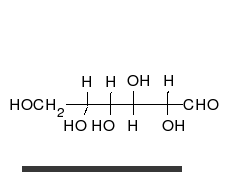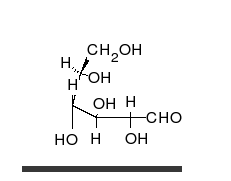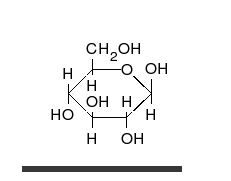
Глюкоза — конечный продукт гидролиза большинства дисахаридов и полисахаридов.
Получение
В промышленности глюкозу получают гидролизом крахмала и целлюлозы.
В природе глюкоза образуется растениями в процессе фотосинтеза.
Химические свойства
Глюкоза может восстанавливаться в шестиатомный спирт (сорбит). Глюкоза легко окисляется. Она восстанавливает серебро из аммиачного раствора оксида серебра и медь(II) до меди(I).
Проявляет восстановительные свойства. В частности, в реакции растворов сульфата меди(II) с глюкозой и гидроксидом натрия. При нагревании эта смесь реагирует с обесцвечением (сульфат меди сине-голубой) и образованием красного осадка оксида меди(I).
Образует оксимы с гидроксиламином, озазоны с производными гидразина.
Легко алкилируется и ацилируется.
При окислении образует глюконовую кислоту, если воздействовать сильными окислителями на её гликозиды, и гидролизовав полученный продукт можно получить глюкуроновую кислоту, при дальнейшем окислении образуется глюкаровая кислота.
Биологическая роль
Глюкоза — основной продукт фотосинтеза, образуется в цикле Кальвина.
В организме человека и животных глюкоза является основным и наиболее универсальным источником энергии для обеспечения метаболических процессов. Глюкоза является субстратом гликолиза, в ходе которого она может окислиться либо до пирувата в аэробных условиях, либо до лактата в случае анаэробных условий. Пируват, полученный таким образом в гликолизе, далее декарбоксилируется, превращаясь в ацетил-КоА (ацетилкоэнзим А). Также в ходе окислительного декарбоксилирования пирувата восстанавливается кофермент НАД+. Ацетил-КоА далее используется в цикле Кребса, а восстановленный кофермент используется в дыхательной цепи.
Глюкоза депонируется у животных в виде гликогена, у растений — в виде крахмала, полимер глюкозы — целлюлоза является основной составляющей клеточных оболочек всех высших растений. У животных глюкоза помогает пережить заморозки. Так, у некоторых видов лягушек перед зимой повышается уровень глюкозы в крови, за счет чего их тела способны выдержать заморозку во льду.
Применение
Глюкозу используют при интоксикации (например, при пищевом отравлении или деятельности инфекции), вводят внутривенно струйно и капельно, так как она является универсальным антитоксическим средством. Также препараты на основе глюкозы и сама глюкоза используются эндокринологами при определении наличия и типа сахарного диабета у человека (в виде стресс-теста на ввод повышенного количества глюкозы в организм).
Ссылки
Примечания
| Общие: | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Геометрия | |||||||||||||||
| Моносахариды |
| ||||||||||||||
| Мультисахариды | |||||||||||||||
| Производные углеводов | |||||||||||||||
Целлюлоза — Википедия
Целлюло́за, клетчáтка (фр. cellulose от лат. cellula — «клетка») — органическое соединение, углевод, полисахарид с формулой (C
Целлюлоза была обнаружена и описана французским химиком Ансельмом Пайеном в 1838 году.[2]
Целлюлоза представляет собой линейный гомополимер из сотен или десятков тысяч остатков D-глюкозы. Соединение фрагментов глюкозы обеспечивается β(1→4)-гликозидной связью. Такое соединение мономерных звеньев отличает целлюлозу от α(1→4)-гликозидных связей характерных для других гомополимеров глюкозы: крахмала и гликогена. В отличие от амилозы крахмала, молекулы которой сворачиваются в спираль, макромолекула целлюлозы склонна принимать вытянутую стержневую конформацию.
Целлюлоза — белое твёрдое, стойкое вещество, не разрушается при нагревании (до 200 °C). Является горючим веществом, температура воспламенения — 275 °С, температура самовоспламенения — 420 °С (хлопковая целлюлоза). В 2016 году экспериментально показано плавление целлюлозы при 467 °C. [3]
Нерастворима в воде, слабых кислотах и большинстве органических растворителей. Однако благодаря большому числу гидроксильных групп является гидрофильной (краевой угол смачивания составляет 20 — 30 градусов).[4]
Целлюлоза не имеет вкуса и запаха. Зарегистрирована в качестве пищевой добавки E460.
Целлюлоза подвергается биодеградации при участии многих микроорганизмов.
Целлюлоза состоит из остатков молекул глюкозы, которая и образуется при гидролизе целлюлозы:
- (C6H10O5)n + nH2O

Серная кислота с йодом, благодаря гидролизу, окрашивают целлюлозу в синий цвет.
При реакции с азотной кислотой образуется нитроцеллюлоза (тринитрат целлюлозы):
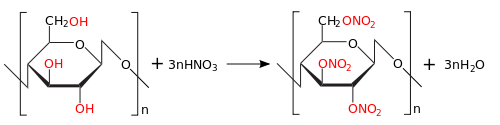
В процессе этерификации целлюлозы уксусной кислотой получается триацетат целлюлозы:

Целлюлозу крайне сложно растворить и подвергнуть дальнейшим химическим превращениям, однако в среде подходящего растворителя, например, в ионной жидкости, такой процесс можно осуществить эффективно.[5]
Промышленным методом целлюлозу получают методом варки щепы на целлюлозных заводах, входящих в промышленные комплексы (комбинаты). По типу применяемых реагентов различают следующие способы варки целлюлозы:
- Кислые:
- Щелочные:
- Натронный. Используется раствор гидроксида натрия. Натронным способом можно получать целлюлозу из лиственных пород древесины и однолетних растений. Преимущество данного метода — отсутствие неприятного запаха соединений серы, недостатки — высокая стоимость получаемой целлюлозы.
- Сульфатный. Наиболее распространённый метод на сегодняшний день. В качестве реагента используют раствор, содержащий гидроксид и сульфид натрия, и называемый белым щёлоком. Своё название метод получил от сульфата натрия, из которого на целлюлозных комбинатах получают сульфид для белого щёлока. Метод пригоден для получения целлюлозы из любого вида растительного сырья. Недостатком его является выделение большого количества дурно пахнущих сернистых соединений: метилмеркаптана, диметилсульфида и др. в результате побочных реакций.
Получаемая после варки техническая целлюлоза содержит различные примеси: лигнин, гемицеллюлозы. Если целлюлоза предназначена для химической переработки (например, для получения искусственных волокон), то она подвергается облагораживанию — обработке холодным или горячим раствором щелочи для удаления гемицеллюлоз.
Для удаления остаточного лигнина и придания целлюлозе белизны проводится её отбелка. Традиционная для XX века хлорная отбелка включала в себя две ступени:
- обработка хлором — для разрушения макромолекул лигнина;
- обработка щелочью — для экстракции образовавшихся продуктов разрушения лигнина.
С 1970-х годов в практику вошла также отбелка озоном. В начале 1980-х годов появились сведения об образовании в процессе хлорной отбелки чрезвычайно опасных веществ — диоксинов. Это привело к необходимости замены хлора на другие реагенты. В настоящее время технологии отбелки подразделяются на:
Используется в качестве наполнителя в таблетках в фармацевтике. Целлюлозу и её эфиры используют для получения искусственного волокна (вискозного, ацетатного, медно-аммиачного шёлка, искусственного меха). Хлопок, состоящий большей частью из целлюлозы (до 99,5 %), идёт на изготовление тканей.
Древесная целлюлоза используется для производства бумаги, пластмасс, кино- и фотоплёнок, лаков, бездымного пороха и т. д.[6]
Целлюлоза является одним из основных компонентов клеточных стенок растений, хотя её содержание в различных клетках или даже частях стенки одной клетки сильно варьирует. Так, например, стенки клеток эндосперма злаков содержат всего около 2 % целлюлозы, в то же время хлопковые волокна, окружающие семена хлопчатника, состоят из целлюлозы более чем на 90 %. Клеточные стенки в области кончика удлинённых клеток, характеризующихся полярным ростом (пыльцевая трубка, корневой волосок), практически не содержат целлюлозы и состоят в основном из пектинов, в то время как базальные части этих клеток содержат значительные количества целлюлозы. Кроме того, содержание целлюлозы в клеточной стенке изменяется в ходе онтогенеза, обычно вторичные клеточные стенки содержат больше целлюлозы, чем первичные.
Организация и функция в клеточных стенках[править | править код]
Отдельные макромолекулы целлюлозы включают от 2 до 25 тысяч остатков D-глюкозы. Целлюлоза в клеточных стенках организована в микрофибриллы, представляющие собой паракристаллические ансамбли из нескольких отдельных макромолекул (у сосудистых растений около 36)[7], связанных между собой водородными связями и силами Ван-дер-Ваальса.
Макромолекулы, находящиеся в одной плоскости и связанные между собой водородными связями, формируют лист в пределах микрофибриллы. Между собой листы макромолекул также связаны большим числом водородных связей. Хотя водородные связи довольно слабые, благодаря их большому количеству микрофибриллы целлюлозы обладают высокой механической прочностью и устойчивостью к действию ферментов.
Индивидуальные макромолекулы в микрофибрилле начинаются и заканчиваются в разных местах, поэтому длина микрофибриллы превышает длину отдельных макромолекул целлюлозы. Следует отметить, что макромолекулы в микрофибрилле ориентированы одинаково, то есть редуцирующие концы (концы со свободной, аномерной OH-группой при атоме C1) расположены с одной стороны.
Современные модели организации микрофибрилл целлюлозы предполагают, что в центральной области она имеет высокоорганизованную структуру, а к периферии расположение макромолекул становится более хаотичным. Так, в центре микрофибриллы высших растений располагается ядро из 24 молекул. Ещё 12 молекул расположены по периферии фибриллы. Теоретически диаметр такой микрофибриллы составляет 3,8 нм, однако, данные рентгеноструктурного анализа показывают, что это значение несколько меньше — 3,3 нм, что соответствуют 24 молекулам.[7] По-другим оценкам размеры фибрилл значительно больше: 5 — 9 нм в поперечном сечении (более 50 отдельных макромолекул).[8]
Между собой микрофибриллы связаны сшивочными гликанами (гемицеллюлозы) и, в меньшей степени, пектинами. Целлюлозные микрофибриллы, связанные сшивочными гликанами, формируют трёхмерную сеть, погружённую в гелеобразный матрикс из пектинов и обеспечивающую высокую прочность клеточных стенок.
Во вторичных клеточных стенках микрофибриллы могут быть ассоциированы в пучки, которые называют макрофибриллами. Подобная организация дополнительно увеличивает прочность клеточной стенки.
Биосинтез[править | править код]
Образование макромолекул целлюлозы клеточных стенок высших растений катализирует мультисубъединичный мембранный целлюлозосинтазный комплекс, расположенный на конце удлиняющихся микрофибрилл. Полный комплекс целлюлозосинтазы состоит из каталитической, поровой и кристаллизационной субъединиц. Каталитическая субъединица целлюлозосинтазы кодируется мультигенным семейством CesA (cellulose synthase A), которое входит в суперсемейство Csl (cellulose synthase-like), включающее также гены CslA, CslF, CslH и CslC, ответственные за синтез других полисахаридов.
При изучении поверхности плазмалеммы растительных клеток методом замораживания-скалывания в основании целлюлозных микрофибрилл можно наблюдать так называемые розетки или терминальные комплексы размером около 30 нм и состоящие из 6 субъединиц. Каждая такая субъединица розетки является в свою очередь суперкомплексом, образованным из 6 целлюлозосинтаз. Таким образом, в результате работы подобной розетки формируется микрофибрилла, содержащая на поперечном срезе около 36 макромолекул целлюлозы. У некоторых водорослей суперкомплексы синтеза целлюлозы организованы линейно.
Интересно, что роль затравки для начала синтеза целлюлозы играет гликозилированный ситостерин. Непосредственным субстратом для синтеза целлюлозы является UDP-глюкоза. За образование UDP-глюкозы отвечает сахарозосинтаза, ассоциированная с целлюлозосинтазой и осуществляющая реакцию:
- Сахароза + UDP ⇌{\displaystyle \rightleftharpoons } UDP-глюкоза + D-фруктоза
Кроме того, UDP-глюкоза, может образовываться из пула гексозофосфатов в результате работы УДФ-глюкозопирофосфорилазы:
- Глюкозо-1-фосфат + UTP ⇌{\displaystyle \rightleftharpoons } UDP-глюкоза + PPi
Направление синтеза микрофибрилл целлюлозы обеспечивается за счёт движения целлюлозосинтазных комплексов по микротрубочкам, прилежащим со внутренней стороны к плазмалемме. У модельного растения резуховидка Таля обнаружен белок CSI1, отвечающий за закрепление и движение целлюлозосинтазных комплексов по кортикальным микротрубочкам.
У млекопитающих (как и большинства других животных) нет ферментов, способных расщеплять целлюлозу. Однако многие травоядные животные (например, жвачные) имеют в пищеварительном тракте бактерии-симбионты, которые расщепляют и помогают хозяевам усваивать этот полисахарид. Расщепление целлюлозы связано с действием в расщепляющих организмах фермента целлюлазы. Бактерии, расщепляющие целлюлозу, называемые целлюлозоразрушающими (англ. cellulolytic bacteria), это часто актинобактерии рода Cellulomonas, являющиеся факультативными анаэробами[9][10], аэробные бактерии рода Cellvibrio[11]. Однако, например, для бумажных книг они представляют опасность только при их намокании, когда кожа и клей начинают разрушаться гнилостными бактериями, а бумага и ткани — целлюлозоразрушающими[12]. Очень опасны для бумажных книг плесневые грибы, разрушающие целлюлозу. За три месяца они могут разрушить 10—60 % волокон бумаги, благоприятные условия для их развития — влага и воздух повышенной влажности, наиболее благоприятная температура — от 22 до 27 градусов Цельсия, они могут распространяться от поражённых ими книг на другие[12]. Активно расщепляющие целлюлозу плесневые грибы — это, например, Chaetomium globosum, Stachybotrys echinata[13].
- ↑ 1 2 3 http://www.cdc.gov/niosh/npg/npgd0110.html
- ↑ Никитин Н.И. Химия древесины и целлюлозы. — М.: Наука (издательство), 1962. — С. 427. — 713 с.
- ↑ Dauenhauer, Paul; Krumm, Christoph; Pfaendtner, Jim. Millisecond Pulsed Films Unify the Mechanisms of Cellulose Fragmentation (англ.) // Chemistry of Materials (англ.)русск. : journal. — 2016. — Vol. 28, no. 1. — P. 0001. — DOI:10.1021/acs.chemmater.6b00580.
- ↑ Vacuum deposition onto webs, films, and foils (англ.) / Bishop, Charles A.. — 2007. — P. 165. — ISBN 0-8155-1535-9.
- ↑ Ignatyev, Igor; Charlie Van Doorslaer, Pascal G.N. Mertens, Koen Binnemans, Dirk. E. de Vos. Synthesis of glucose esters from cellulose in ionic liquids (англ.) // Holzforschung : journal. — 2011. — Vol. 66, no. 4. — P. 417—425. — DOI:10.1515/hf.2011.161.
- ↑ Глинка Н.Л. Общая химия. — 22 изд., испр. — Ленинград: Химия, 1977. — 719 с.
- ↑ 1 2 Biochemistry & molecular biology of plants. — Second edition. — Chichester, West Sussex. — xv, 1264 pages с. — ISBN 9780470714225.
- ↑ Nobel, Park S. Physicochemical and environmental plant physiology. — 4th ed. — Amsterdam: Academic Press, 2009. — 1 online resource (xxi, 582 pages) с. — ISBN 9780123741431.
- ↑ Melissa R. Christopherson, et al. The Genome Sequences of Cellulomonas fimi and “Cellvibrio gilvus” Reveal the Cellulolytic Strategies of Two Facultative Anaerobes, Transfer of “Cellvibrio gilvus” to the Genus Cellulomonas, and Proposal of Cellulomonas gilvus sp. nov (англ.) : journal. — 2013. — DOI:10.1371/journal.pone.0053954.
- ↑ Muhammad Irfan, et al. Isolation and screening of cellulolytic bacteria from soil and optimization of cellulase production and activity (англ.) // Turkish Journal of Biochemistry : journal. — 2012. — Vol. 37, no. 3. — P. 287—293. — DOI:10.5505/tjb.2012.09709.
- ↑ Don J. Brenner, Noel R. Krieg, James R. Staley. Part B: The Gammaproteobacteria // Bergey’s Manual of Systematic Bacteriology (болг.). — Springer Science & Business Media, 2007. — Т. 2. The Proteobacteria. — С. 402—403.
- ↑ 1 2 И. К. Белая. Гигиена и реставрация библиотечных фондов. — Рипол Классик, 2013. — С. 13—21.
- ↑ Brian Flannigan, Robert A. Samson, J. David Miller. Microorganisms in Home and Indoor Work Environments: Diversity, Health Impacts, Investigation and Control (англ.). — 2nd ed. — CRC Press, 2016. — P. 77.
Ответы@Mail.Ru: из чего делают глюкозу?
Глюкоза образуется в растениях за счёт фотосинтеза. Затем она преобразуется в крахмал и целлюлозу. Эти вещества содержат ВСЕ растения. Поэтому, глюкозу (для медицинских целей) получают из крахмала, а для непищевых — из целлюлозы путём их гидролиза. Наш организм ежесекундно получает глюкозу из сахара и других углеводов, а также из аминокислот. Глюкоза — единственный источник энергии для нашего мозга и ПОСТОЯННО находится в нашей крови (сахар крови).
глюкоза — это вещество. Его обычно получают из фруктов или химпутем
из крови так-же как и шоколадки (гемотоген из бычьей крови) а из чьей крови делают глюкозу не знаю может быть из наших братьев.!!!
ГЛЮКОЗА (от греч. glykys — сладкий) (виноградный сахар) , углевод из группы моносахаридов. Хорошо растворима в воде, имеет сладкий вкус. В значительных количествах содержится в плодах винограда, меде. Входит в состав сахарозы, лактозы; образует крахмал и гликоген, а также целлюлозу. Глюкоза — один из ключевых продуктов обмена веществ, обеспечивающий живые клетки энергией (в процессах дыхания, гликолиза, брожения) , исходный продукт биосинтеза многих веществ. У человека и животных постоянный уровень глюкозы в крови (ок. 100 мг%) поддерживается путем синтеза и распада гликогена. В промышленности глюкозу получают гидролизом крахмала. Применяется в кондитерской промышленности, в медицине.
Глюкозный транспортёр — Википедия
Материал из Википедии — свободной энциклопедии
Глюкозные транспортёры (англ. Glucose transporter, сокр. GLUT или ГЛЮТ) — большая группа мембранных белков, отвечающих за перенос глюкозы через клеточную мембрану. Поскольку глюкоза является жизненно важным источником энергии, эти белки присутствуют у всех типов живых организмов.
Отдельно выделяют GLUT (ГЛЮТ), или SLC2A — семейство белков-переносчиков глюкозы, встречающихся в большинстве клеток млекопитающих. Так, в человеческом геноме закодировано двенадцать белков семейства GLUT. Они представляют собой транспортные белки-унипортеры.

Большинство не автотрофных организмов неспособны производить свободную глюкозу, поскольку у них отсутствует экспрессия фермента глюкозо-6-фосфатазы. Таким образом, они способны осуществлять только поглощение и катаболизм глюкозы. Однако, в условиях голодания некоторые ткани и органы, такие как гепатоциты, кишечник, мышцы, мозг и почки, способны осуществлять синтез глюкозы, вследствие активации процесса глюконеогенеза.
В клетках модельного организма Saccharomyces cerevisiae транспорт глюкозы происходит путём облегчённой диффузии[en][1]. Большинство транспортных белков этого организма относятся к семейству Hxt, но есть и множество белков транспортёров из других семейств[2].
| Название | Характеристики | Описание |
| Snf3 | высокое сродство к глюкозе; подавляется глюкозой; низкий уровень экспресси; подавляет синтез Hxt6 | |
| Rgt2 | низкое сродство к глюкозе; низкий уровень экспресси | |
| Hxt1 | Km: 100 мM[3], 129 — 107 мM[1] | низкое сродство к глюкозе; синтез индуцируется высоким уровнем глюкозы |
| Hxt2 | Km = 1.5[1] — 10 мM[3] | высокое/среднее сродство к глюкозе; синтез индуцируется низким уровнем глюкозы[3] |
| Hxt3 | Vm = 18.5, Kd = 0.078, Km = 28.6/34.2[1] — 60 мM[3] | низкое сродство к глюкозе[3] |
| Hxt4 | Vm = 12.0, Kd = 0.049, Km = 6.2[1] | среднее сродство к глюкозе[3] |
| Hxt5 | Km = 10 мM[4] | Среднее сродство к глюкозе. Сильная экспрессия в фазе стационарного роста, при образовании спор и в условиях низкой концентрации глюкозы. Транскрипция подавляется глюкозой[4]. |
| Hxt6 | Vm = 11.4, Kd = 0.029, Km = 0.9/14[1], 1.5 mM[3] | высокое сродство к глюкозе[3] |
| Hxt7 | Vm = 11.7, Kd = 0.039, Km = 1.3, 1.9,[1] 1.5 mM[3] | высокое сродство к глюкозе[3] |
| Hxt8 | низкий уровень экспрессии[3] | |
| Hxt9 | участвует в множественной лекарственной устойчивости[3] | |
| Hxt11 | участвует в множественной лекарственной устойчивости[3] | |
| Gal2 | Vm = 17.5, Kd = 0.043, Km = 1.5, 1.6[1] | высокое сродство к галактозе[3] |
GLUT (ГЛЮТ) — интегральные мембранные белки, содержащие 12 пересекающих клеточную мембрану спиралей, при этом амино- (N-конец) и карбоксильный (C-конец) концы выходят со стороны клеточной мембраны, обращенной к цитоплазме. ГЛЮТ переносят глюкозу и связанные гексозы в соответствии с моделью альтернативных конформаций[5][6][7], которая предсказывает, что транспортёр выставляет свой единственный участок связывания субстрата либо внутрь, либо наружу клетки. Связывание глюкозы с участком провоцирует конформационное изменение, связанное с транспортом, и приводит к высвобождению глюкозы с противоположной стороны клеточной мембраны. Внутренние и внешние участки связывания глюкозы, как считается, расположены на трансмембранных сегментах 9, 10 и 11[8]. Мотив QLS на седьмом трансмембранном сегменте возможно может определять селективность и аффинность транспорта[9][10].
Типы[править | править код]
Каждая изоформа глюкозного транспортёра играет определенную роль в метаболизме глюкозы, в зависимости от её тканевой экспрессии, субстратной специфичности, кинетики транспорта и регуляции экспрессии в различных физиологических условиях[11]. На данный момент обнаружено тринадцать белков-транспортёров семейства GLUT/SLC2[12]. На основании сходства аминокислотных последовательностей они разделены на три подкласса.
Класс I[править | править код]
К классу I относятся транспортёры GLUT1-GLUT4[13].
| Название | Распространение | Описание |
| GLUT1 | Широко распространён в зародышевых тканях. У взрослых сильнее всего экспрессируется в эритроцитах и эндотелиальных клетках барьерных тканей, например в гемато-энцефалическом барьере. Помимо этого, он ответственен за минимальный базальный уровень поглощения глюкозы всеми клетками организма, необходимый для поддержания клеточного дыхания. | Уровень GLUT1 в клеточной мембране повышается при снижении уровня глюкозы и уменьшается при его повышении. |
| GLUT2 | Это транспортёр глюкозы, работающий в двух направлениях. Экспрессируется клетками почечных канальцев, печени и бета-клетками поджелудочной железы. Также его можно обнаружить в базолатеральной мембране эпителия тонкой кишки. Двунаправленный транспортёр необходим клеткам печени для поглощения глюкозы в процессе гликолиза, и её высвобождения в процессе глюконеогенеза. В бета-клетках поджелудочной железы, свободная глюкоза необходима для того, что бы клетки могли точно измерить уровень глюкозы в сыворотке крови. Кроме этого GLUT2 осуществляет транспорт глюкозы, галактозы и фруктозы из клеток слизистой кишечника в просвет кровеносных сосудов. | Это изоформа с низким сродством. Существуют данные, что основными транспортёрами глюкозы в бета-клетки на самом деле являются GLUT1 и GLUT3. |
| GLUT3 | В основном экспрессируется в нейронах (где, как полагают, он является главной изоформой глюкозного транспортёра) и плаценте. | Это изоформа с высоким сродством к глюкозе, что позволяет ей осуществлять транспорт при низких концентрациях глюкозы. |
| GLUT4 | Обнаружен в жировой ткани, а также в скелетных мышцах и миокарде. | Этот транспортёр регулируется инсулином. Осуществляет инсулин-зависимое поглощение глюкозы. |
Классы II/III[править | править код]
К классу II относятся:
К классу III относятся:
Большинство транспортёров классов II/III было обнаружено относительно недавно в результате деятельности различных геномных проектов.
Функции данных изоформ на данный момент неясны. Некоторые из них (GLUT6, GLUT8) состоят из мотивов, которые способствуют сохранению транспортёров внутри клетки, и таким образом предотвращают транспорт глюкозы. Существуют ли механизмы, способствующие транслокации этих транспортёров на клеточную поверхность, неизвестно, но было выяснено, что инсулин не способствует такой транслокации.
Открытие натрий-глюкозного ко-транспортёра[править | править код]
В августе 1960 года, в Праге, Роберт К. Крэйн представил общественности своё открытие: механизм вторично-активного транспорта глюкозы в сопряжении с натрием в клетках кишечника[16]. Открытие Крэйном вторично-активного транспорта было первым открытием, показавшим значимость сопряжения потоков в биологии[17][18].
- ↑ 1 2 3 4 5 6 7 8 Maier A., Asano T., Volker A., Boles E., Fuhrmann G F. Characterisation of glucose transport in Saccharomyces cerevisiae with plasma membrane vesicles (countertransport) and intact cells (initial uptake) with single Hxt1, Hxt2, Hxt3, Hxt4, Hxt6, Hxt7 or Gal2 transporters (англ.) // FEMS Yeast Research : journal. — 2002. — Vol. 2, no. 4. — P. 539—550. — DOI:10.1111/j.1567-1364.2002.tb00121.x. — PMID 12702270.
- ↑ uniprot list of possible glucose transporters in S. cerevisiae
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 Boles E., Hollenberg C P. The molecular genetics of hexose transport in yeasts (англ.) // FEMS Microbiology Reviews : journal. — 1997. — Vol. 21, no. 1. — P. 85—111. — DOI:10.1111/j.1574-6976.1997.tb00346.x. — PMID 9299703.
- ↑ 1 2 Diderich J A., Schuurmans J M., Gaalen M C., Kruckeberg A L., Van Dam K. Functional analysis of the hexose transporter homologue HXT5 in Saccharomyces cerevisiae (англ.) // Yeast : journal. — 2001. — Vol. 18, no. 16. — P. 1515—1524. — DOI:10.1002/yea.779. — PMID 11748728.
- ↑ Oka Y., Asano T., Shibasaki Y., Lin J., Tsukuda K., Katagiri H., Akanuma Y., Takaku F. C-terminal truncated glucose transporter is locked into an inward-facing form without transport activity (англ.) // Nature : journal. — 1990. — Vol. 345, no. 6275. — P. 550—553. — DOI:10.1038/345550a0. — PMID 2348864.
- ↑ Hebert D., Carruthers A. Glucose transporter oligomeric structure determines transporter function. Reversible redox-dependent interconversions of tetrameric and dimeric GLUT1 (англ.) // J. Biol. Chem. : journal. — 1992. — Vol. 267, no. 33. — P. 23829—23838. — PMID 1429721.
- ↑ Cloherty E., Sultzman L., Zottola R., Carruthers A. Net sugar transport is a multistep process. Evidence for cytosolic sugar binding sites in erythrocytes (англ.) // Biochemistry : journal. — 1995. — Vol. 34, no. 47. — P. 15395—15406. — DOI:10.1021/bi00047a002. — PMID 7492539.
- ↑ Hruz P., Mueckler M. Structural analysis of the GLUT1 facilitative glucose transporter (review) (англ.) // Mol. Membr. Biol. (англ.)русск. : journal. — 2001. — Vol. 18, no. 3. — P. 183—193. — DOI:10.1080/09687680110072140. — PMID 11681785.
- ↑ Seatter M., De la Rue S., Porter L., Gould G. QLS motif in transmembrane helix VII of the glucose transporter family interacts with the C-1 position of D-glucose and is involved in substrate selection at the exofacial binding site (англ.) // Biochemistry : journal. — 1998. — Vol. 37, no. 5. — P. 1322—1326. — DOI:10.1021/bi972322u. — PMID 9477959.
- ↑ Hruz P., Mueckler M. Cysteine-scanning mutagenesis of transmembrane segment 7 of the GLUT1 glucose transporter (англ.) // J. Biol. Chem. : journal. — 1999. — Vol. 274, no. 51. — P. 36176—36180. — DOI:10.1074/jbc.274.51.36176. — PMID 10593902.
- ↑ Thorens B. Glucose transporters in the regulation of intestinal, renal, and liver glucose fluxes (англ.) // American Physiological Society (англ.)русск. : journal. — 1996. — Vol. 270, no. 4 Pt 1. — P. G541—53. — PMID 8928783.
- ↑ Joost H., Thorens B. The extended GLUT-family of sugar/polyol transport facilitators: nomenclature, sequence characteristics, and potential function of its novel members (review) (англ.) // Mol. Membr. Biol. (англ.)русск. : journal. — 2001. — Vol. 18, no. 4. — P. 247—256. — DOI:10.1080/09687680110090456. — PMID 11780753.
- ↑ Bell G., Kayano T., Buse J., Burant C., Takeda J., Lin D., Fukumoto H., Seino S. Molecular biology of mammalian glucose transporters (англ.) // Diabetes Care (англ.)русск. : journal. — 1990. — Vol. 13, no. 3. — P. 198—208. — DOI:10.2337/diacare.13.3.198. — PMID 2407475.
- ↑ Page 995 in: Walter F., PhD. Boron. Medical Physiology: A Cellular And Molecular Approaoch (англ.). — Elsevier/Saunders (англ.)русск., 2003. — P. 1300. — ISBN 1-4160-2328-3.
- ↑ Uldry M., Thorens B. The SLC2 family of facilitated hexose and polyol transporters (англ.) // Pflugers Arch. (англ.)русск. : journal. — 2004. — Vol. 447, no. 5. — P. 480—489. — DOI:10.1007/s00424-003-1085-0. — PMID 12750891.
- ↑ Robert K. Crane, D. Miller and I. Bihler. “The restrictions on possible mechanisms of intestinal transport of sugars”. In: Membrane Transport and Metabolism. Proceedings of a Symposium held in Prague, August 22–27, 1960. Edited by A. Kleinzeller and A. Kotyk. Czech Academy of Sciences, Prague, 1961, pp. 439-449.
- ↑ Ernest M. Wright and Eric Turk. “The sodium glucose cotransport family SLC5”. Pflügers Arch 447, 2004, p. 510. “Crane in 1961 was the first to formulate the cotransport concept to explain active transport [7]. Specifically, he proposed that the accumulation of glucose in the intestinal epithelium across the brush border membrane was [is] coupled to downhill Na+ transport cross the brush border. This hypothesis was rapidly tested, refined, and extended [to] encompass the active transport of a diverse range of molecules and ions into virtually every cell type.”
- ↑ Boyd, C A R. “Facts, fantasies and fun in epithelial physiology”. Архивировано 10 декабря 2012 года. Experimental Physiology, Vol. 93, Issue 3, 2008, p. 304. “the insight from this time that remains in all current text books is the notion of Robert Crane published originally as an appendix to a symposium paper published in 1960 (Crane et al. 1960). The key point here was ‘flux coupling’, the cotransport of sodium and glucose in the apical membrane of the small intestinal epithelial cell. Half a century later this idea has turned into one of the most studied of all transporter proteins (SGLT1), the sodium–glucose cotransporter.”
Лактоза — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 11 августа 2013; проверки требуют 35 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 11 августа 2013; проверки требуют 35 правок.| Лактоза | |
|---|---|
 ( {{{картинка}}})( {{{картинка3D}}}) | |
| Систематическое наименование | 4-О-β-D-галактопиранозил-D-глюкоза, β-D-галактопиранозил-(1,4)-α-D-глюкопираноза (α-лактоза) β-D-галактопиранозил-(1,4)-β-D-глюкопираноза (β-лактоза) |
| Традиционные названия | Лактоза, лактобиоза, таблеттоза, молочный сахар |
| Хим. формула | С12H22O11 |
| Состояние | Твёрдое кристаллическое вещество, белого цвета |
| Молярная масса | 342,2965 ± 0,0144 г/моль |
| Плотность | 1,525 г/см³ |
| Температура | |
| • плавления | 202,8 °C |
| • кипения | 668,9 °C |
| Растворимость | |
| • в воде | 21,6 г/100 мл |
| Рег. номер CAS | 63-42-3 |
| PubChem | 6134 |
| Рег. номер EINECS | 200-559-2 |
| SMILES | |
| InChI | 1S/C12h32O11/c13-1-3-5(15)6(16)9(19)12(22-3)23-10-4(2-14)21-11(20)8(18)7(10)17/h4-20H,1-2h3/t3-,4-,5+,6+,7-,8-,9-,10-,11-,12+/m1/s1 |
| ChEBI | 36218 |
| ChemSpider | 5904 |
| NFPA 704 |  |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |
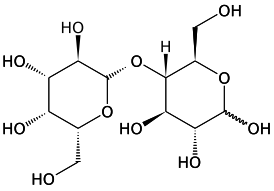
Лакто́за или молочный сахар (от лат. lac «молоко») С12H22O11 — углевод группы дисахаридов, содержится в молоке и молочных продуктах. Молекула лактозы состоит из остатков молекул глюкозы и галактозы.
Получают лактозу из молочной сыворотки.
Применяют для приготовления питательных сред, например при производстве пенициллина. Используют в качестве вспомогательного вещества (наполнителя) в фармацевтической промышленности.
Из лактозы путём изомеризации получают лактулозу — ценный препарат для лечения кишечных расстройств — запоров, дисбактериозов и других нарушений работы ЖКТ. Свойства лактулозы определяются отсутствием в двенадцатиперстной кишке человека ферментов, расщепляющих лактулозу, вследствие чего она в неизменном виде достигает толстой кишки.
Большое количество лактозы (около 85 %) содержится в детских молочных смесях.
Несмотря на употребление лактозы в лечебных целях, у некоторых людей лактоза не усваивается[2] и вызывает нарушения в работе пищеварительной системы, в том числе диарею, боли и вздутие живота, тошноту и рвоту после употребления молочных продуктов. У этих людей отсутствует или производится в недостаточном количестве фермент лактаза. Назначение лактазы — расщепление лактозы на её части: глюкозу и галактозу, которые должны затем абсорбироваться тонкой кишкой. При недостаточной функции лактазы, лактоза остаётся в кишечнике в исходном виде и связывает воду, что вызывает диарею. Кроме того, кишечные бактерии вызывают брожение молочного сахара, в результате чего происходит вздутие живота.
Непереносимость молочного сахара довольно распространена. Так, в Швеции и Дании непереносимость лактозы встречается примерно у 3 % взрослых лиц, в Финляндии и Швейцарии — у 16 %, в Англии — у 20—30 %, во Франции — у 42 %, а в странах Юго-Восточной Азии и у афроамериканцев в США — почти у 100 %.[3] Непереносимость лактозы часто встречается среди коренного населения Африки, Америки и ряда стран Азии. Она связана с отсутствием в этих регионах традиционного молочного животноводства. Например, в племенах масаев, фулани и тасси в Африке выращивают молочный скот, и у взрослых представителей этих племен непереносимость лактозы встречается относительно редко. Частота этого явления в России составляет в среднем около 16—18 %.[3]
Лактозный оперон — последовательность генов у многих бактерий, которая кодирует ферменты, необходимые для расщепления лактозы до глюкозы и галактозы, то есть для утилизации сахара. Исследования этого оперона сыграли важную роль в развитии молекулярной генетики.

