Способ оперативного лечения кардиоэзофагеального рака
Изобретение относится к медицине, а именно к хирургии пищевода и желудка. Сущность: диафрагмотомию проводят от пищеводного отверстия диафрагмы с перечислением левой ножки диафрагмы под углом 70° к реберной дуге слева с дренированием дренажом, уложенным по задней поверхности до верхушки легкого, что позволяет создать возможность к более оптимальному доступу к органам брюшной и плевральной полости слева, что обеспечивает сохранение принципов радикальности операции, техническую простоту наложения внутриплевральных пищеводных соустий и делает его эффективным при использовании у пожилых и ослабленных больных с сопутствующей патологией.
Изобретение относится к медицине, а именно к хирургии, и может быть использовано при оперативном лечении кардиоэзофагеального рака (КЭР) II, III типа (по Зиверту).
Хирургическое лечение рака кардиоэзофагеальной области продолжает оставаться одной из наиболее сложных проблем современной клинической онкологии. Рак проксимального отдела желудка с переходом на пищевод характеризуется как высокозлокачественная опухоль с лимфогенным метастазированием в лимфоколлекторы как брюшной полости, так и средостения. В литературе до настоящего времени нет единого подхода в выборе наиболее рационального доступа и соответственно объема оперативного вмешательства при лечении больных раком кардиоэзофагеальной области. Хирургический доступ в значительной степени определяет эффективность операции. Особенно актуальным становится вопрос о хирургическом доступе при раке кардиального отдела у пожилых и ослабленных больных с сопутствующими кардиореспираторными заболеваниями.
Известен способ оперативного лечения кардиоэзофагеального рака, заключающийся в осуществлении комбинированного торакоабдоминального доступа в VII межреберье слева по Осава-Гэрлоку (М.И.Давыдов, И.Н.Туркин, И.С.Стилиди и др. Кардиоэзофагеальный рак: классификация, хирургическая тактика, основные факторы прогноза. //Вестник РОНЦ им. Н.Н.Блохина РАМН. — №1. — 2003. — С.82-88), при котором выполняют гастрэктомию из единого левостороннего абдомино-торакального доступа, проксимальную резекцию желудка с резекцией нижнегрудного отдела пищевода. Известный способ позволяет под визуальным контролем мобилизовать пищевод до уровня дуги аорты, выполнить лимфодиссекцию до уровня бифуркации трахеи и сформировать высокий анастомоз.
Однако недостатком известного способа является сложность в исполнении, травматичность, значительная кровопотеря и большое количество легочных осложнений.
Известен способ оперативного лечения кардиоэзофагеального рака путем торакофренотомии слева (операция Sweet) (Д.Г.Мустафин, М.Р.Панькова, П.Н.Злыгостев и др. Чресплевральные операции при кардиоэзофагеальном раке. // Вопросы онкологии: Хирургия пищевода и кардиального отдела желудка. — 1995. — С.55-57).
Несмотря на хороший подход к пораженному отрезку пищевода, удобство наложения пищеводно-желудочного анастомоза, полноценную ревизию грудной и брюшной полости, известный способ имеет недостаток, а именно — сложность в выполнении расширенных лимфодиссекций D2-D4 и комбинированных операций.
Наиболее близким по достигаемому положительному результату является способ оперативного лечения кардиоэзофагеального рака путем ляпаротомии с сагитальной диафрагмотомией по А.Г.Савиных (В.С.Рогачева, П.Д.Фомин. Хирургия пищевода (ошибки и опасности). — М., 1983. — С.29-31; А.Ф.Черноусов, В.С.Сильверстов, Ф.С.Курбанов. Пластика пищевода желудком при раке и доброкачественных структурах. — М.: Медицина, 1990. — С.68-78), заключающийся в том, что выполняют диссекцию наддиафрагмальных, нижних параэзофагеальных и бифуркационных лимфоузлов, резицируют дистальный отдел пищевода с формированием анастомоза до уровня нижней легочной вены.
Недостатком известного способа являются значительные трудности в формировании высокого соустья в заднем средостении при резекции нижней трети пищевода, а также при прорастании опухолью медиастинальной плевры, а в ряде наблюдений и легкого, невозможность соблюдения основных принципов радикальности операции. В группе больных, оперированных из доступа по Савиных, частота обнаружения элементов опухоли по линии резекции пищевода оказалась наиболее высокой (М.И.Давыдов, И.Н.Туркин, И.С.Стилиди и др. Кардиоэзофагеальный рак: классификация, хирургическая тактика, основные факторы прогноза. //Вестник РОНЦ им. Н.Н.Блохина РАМН. — №1. — 2003.)
Положительным результатом заявленного способа является снижение травматичности, повышение надежности формирования внутриплеврального соустья за счет оптимальной доступности в выполнении двухзональной абдомино-медиастинальной лимфодиссекции (D2, 2S) и возможности выполнения заявленного способа у пожилых и ослабленных больных с сопутствующей патологией.
Положительный результат заявленного способа (ляпарофренотомия слева) достигается тем, что выполняют диафрагмотомию со вскрытием плевральной полости слева после ляпаротомии под углом 70°, причем диафрагму вскрывают от диафрагмального отверстия пищевода до реберной дуги к VII межреберью, обеспечивая тем самым оптимальный доступ к органам брюшной и плевральной полости слева, с возможностью выполнения двухзональной абдомино-медиастинальной лимфодиссекции (D2 2S). В связи с тем, что реберную дугу не пересекают и истинную торакотомию в VII межреберье не проводят, обеспечивается меньшая травматичность способа, который позволяет свободно формировать пищеводные соустья в заднем средостении до дуги аорты, не используя специальный инструментарий, как в прототипе.
Способ осуществляют следующим образом.
Больного кладут на операционный стол. Стол наклоняют в сторону оперирующего хирурга под углом 20°, под спину на уровне мечевидного отростка подкладывают валик. Под общим обезболиванием операционное поле обрабатывают хлоргикседином дважды, выполняют верхнесрединную ляпаротомию, ревизию брюшной полости, затем производят мобилизацию абдоминального отрезка пищевода и ревизию задненижнего средостения. В случае резектабельности процесса производят диафрагмотомию от диафрагмального отверстия пищевода с пересечением левой ножки диафрагмы в косом направлении под углом 70° по направлению к реберной дуге слева к VII межреберью. Рану расширяют расширителями Сигала. Проводят мобилизацию желудка и пищевода с большим и малым сальником с выполнением двухзональной лимфодиссекции (2D 2S) с пересечением и перевязкой сосудов желудка. Производят субтотальную проксимальную резекцию желудка с резекцией нижней трети пищевода, формируют анастомоз внутриплеврально слева на уровне бифуркации трахеи или ниже. После ревизии брюшной и грудной полостей и дополнительного гемостаза диафрагму ушивают отдельными капроновыми швами от реберной дуги до культи желудка с подшиванием последней к диафрагме. В культю желудка трансназально для декомпрессии анастомоза вводят зонд на 2-3 суток. В плевральную полость устанавливают дренаж в VII межреберье по задней подмышечной линии с несколькими отверстиями для удаления остаточного воздуха и послеоперационного экссудата и укладывают его по задней поверхности до верхушки легкого. Ляпаротомную рану ушивают послойно.
Для анатомо-физиологического обоснования оперативного лечения кардиоэзофагеального рака по заявленному способу в анатомическом эксперименте в 10 наблюдениях выполнены антропометрические измерения с изучением параметров доступа. Выявлены оптимальные параметры: глубина раны — 16,2 см, наклонение операционного действия — 65°, угол операционного действия — 40°.
Клинический пример
Больной А., 63 года, поступил с жалобами на затруднение прохождения твердой, грубой пищи и потерю веса до 5 кг. Сопутствующая патология: ИБС — мерцательная аритмия, нормаформа, НIБ, гипертоническая болезнь II, средний риск осложнения. При эзофагогастроскопии пищевод свободно проходим. Начиная с 40 см, определяется язвенно-инфильтративный рак в кардиальном отделе желудка с переходом на зубчатую линию и малую кривизну тела желудка размером 2×2 см. Гистологический диагноз — аденокарцинома.
Проведена операция из доступа по предложенному способу (ляпарофренотомия слева). При ревизии выявлена опухоль в кардиоэзофагеальной области с переходом по малой кривизне на субкардию, плотная язвенно-инфильтративная форма 2×2 см. Отдаленных метастазов не выявлено. Произведена расширенная комбинированная субтотальная проксимальная резекция желудка с резекцией нижней трети пищевода, со спленэктомией и двухзональной абдоминомедиастинальной лимфодиссекцией (D2 2S). Сформирован погружной инвагинационный эзофагогастроанастомоз по М.И.Давыдову. Ближайшее послеоперационное течение гладкое. Релаксации диафрагмы и, в связи с этим, легочных осложнений не наблюдалось. Дренаж из плевральной полости удален на 4 сутки, назогастральный зонд — на 3 сутки.
Больной выписан на 14 сутки после операции в удовлетворительном состоянии. Осмотрен через 1, 3, 6 месяцев. Жалоб на дисфагию, жжение за грудиной, боли нет. При контрольной рентгеноскопии и ФГС слизистая пищевода на всем протяжении розовая, анастомоз хорошо проходим, признаков эзофагита нет; бариевая взвесь свободно порционно проходит и поступает в желудок. Диафрагма в полипозиционном исследовании стоя, лежа адекватно участвует в акте дыхания.
Таким образом, заявленный способ обеспечивает наиболее оптимальный объем операции, особенно при местнораспространенных кардиоэзофагеальных раках, с выполнением двухзональной абдоминомедиастинальной лимфодиссекции (D2 2S), техническую простоту выполнения более высоких пищеводных внутриплевральных соустий слева. Особенно актуально применение заявленного способа у пожилых и ослабленных больных с сопутствующей патологией.
Способ оперативного лечения кардиоэзофагиального рака, заключающийся в осуществлении лапаротомии с диафрагмотомией, отличающийся тем, что диафрагмотомию проводят от пищеводного отверстия диафрагмы с пересечением левой ножки диафрагмы под углом 70° к реберной дуге слева с последующим дренированием плевральной полости дренажом, который укладывают по задней поверхности до верхушки легкого.
findpatent.ru
Принципы хирургического лечения кардиоэзофагеального рака Текст научной статьи по специальности «Клиническая медицина»
Обзоры
© Коллектив авторов, 2009 УДК [616.33+616.329]-089
В.М.Седов, В.П.Морозов, О.Я.Порембская
ПРИНЦИПЫ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ КАРДИОЭЗОФАГЕАЛЬНОГО РАКА
Кафедра факультетской хирургии (зав. — проф. В.М.Седов) ГОУ ВПО «Санкт-Петербургский государственный медицинский университет им. акад. И.П.Павлова» Росздрава
Ключевые слова: аденокарцинома пищевода, рак проксимального отдела желудка, кардиоэзофагеаль-ный рак.
Начиная с 70-х годов ХХ в. в мировой литературе стали появляться сообщения о значительных изменениях в структуре заболеваемости злокачественными опухолями верхних отделов желудочно-кишечного тракта. Несмотря на снижение частоты диагностируемых опухолей желудка, отмечаемое всеми европейскими исследователями, наблюдается значительный рост случаев выявления рака кардии и дистального отдела пищевода. Так, по разным данным, аденокарцинома пищевода и проксимального отдела желудка составляет около 50-60% всех опухолей этих органов в настоящее время [1, 10, 12, 14].
Особенности локализации и течения заболевания позволили выделить опухоли кардиального отдела желудка и дистального отдела пищевода в отдельную группу опухолей кардиоэзофагеальной зоны. До создания единой классификации долгое время не существовало общих подходов к диагностике и лечению данного заболевания. В 1997 г. на конференции Международного общества по раку желудка (IGCA) и Международного общества заболеваний пищевода (ISDE) в г. Мюнхене была принята классификация опухолей области гастроэзофагеального перехода, предложенная J.R.Siewert [38]. Согласно этой классификации, опухоли разделены на три типа:
I тип опухоли — аденокарцинома дистального отдела пищевода, в пределах 5 см над Z-линией. Распространяясь в дистальном направлении, инфильтрирует зону кардиоэзофа-геального перехода. В 80% случаев развивается в слизистой оболочке на фоне пищевода Барретта, что является важным фактом для диагностики данного типа опухолей;
II тип опухоли — истинный рак кардии. Границы роста: 1 см проксимальнее и 2 см дистальнее Z-линии. Кишечная метаплазия выявляется в 10% случаев;
III тип опухоли — аденокарцинома субкардии. Эпицентр опухоли располагается на расстоянии от 2 до 5 см дистальнее Z-линии. Инфильтрирует зону кардиоэзофагеального перехода, распространяясь в проксимальном направлении.
В течение долгого времени не существовало единых подходов к лечению кардиоэзофагеального рака. В большинстве случаев при выявлении опухолей данной зоны операцией выбора считалась субтотальная резекция пище-
вода [2, 11]. Однако большое количество осложнений после данного оперативного вмешательства, высокая послеоперационная летальность в сочетании с низкими показателями безрецидивной и 5-летней выживаемости свидетельствовали о неоправданности в большинстве случаев подобного объема операции [11, 18, 29]. С появлением предложенной J.R.Siewert классификации [28], изучением особенностей опухолей каждого типа появилась возможность дифференцированного подхода к их лечению. Операциями выбора при опухолях II и III типа стала экстирпация желудка с резекцией дистального отдела пищевода. При этом большинство авторов, приводя данные отдаленных результатов лечения, утверждают, что в случае опухолей II и III типа это не сопровождается снижением радикальности вмешательства [1, 15, 20, 28, 29].
До сих пор нет единого мнения относительно уровней резекции пищевода и желудка. Различные авторы предлагают выполнять резекцию пищевода на уровне от 2 до 6 см от видимой и пальпируемой границ опухоли. В отличие от плоскоклеточного рака пищевода для аденокарциномы не характерно развитие интрамуральных метастазов. Поэтому уровень резекции в этих границах определяется только протяженностью опухолевой инфильтрации стенки пищевода. Появление же метастатических отсевов при аденокарцино-ме является признаком распространенности заболевания, сопровождается широкой лимфогенной диссеминацией или гематогенным метастазированием [16, 30].
Исследуя края резекции, F.Bozzetti и соавт. [5] выявили закономерность между распространением инфильтрации по стенке пищевода и стадией опухолевого процесса. Локализованная опухоль, ее экзофитный рост, стадия Т1-Т2, распространение вдоль стенки пищевода не более 2 см определяют возможность резекции пищевода в пределах 2 см от края опухоли. Такое расстояние считается достаточным при выполнении радикального вмешательства. Напротив, инфильтративный рост, размеры опухоли, превышающие 5 см в диаметре, III—IV тип по Borrmann, диффузный тип по Lauren, Т3-Т4, N1-N2 расширяют необходимые границы резекции до 4-6 см. Выполнение срочного гистологического исследования, по мнению многих хирургов, не должно являться рутинным методом. Связано это как с большим числом ложноотрицательных результатов, так и с неоправданным увеличением продолжительности операции [1, 4, 22, 28, 29, 31].
В.М.Седов, В.П.Морозов, О.Я.Порембская
«Вестник хирургии»^2009
Тем не менее, даже при соблюдении необходимого уровня резекции пищевода вероятность выявления опухолевых клеток в краях удаленного препарата (Ш) при гистологическом исследовании составляет 7-14% по данным разных авторов [4, 27, 34]. Подобная картина только редко является признаком неадекватного объема оперативного вмешательства. В абсолютном большинстве наблюдений выявление опухолевых клеток в краях резекции сочетается с распространенностью опухолевого процесса. По некоторым опубликованным данным [21], средняя продолжительность жизни больных при отсутствии опухолевых клеток в краях резекции составляет 19 мес, в то время как при резекции Шэти показатели снижаются до 7 мес.
Выполнение ререзекции пищевода, по мнению большинства хирургов [6, 19, 28], нецелесообразно. Анализ отдаленных результатов лечения свидетельствует, что развитие рецидива заболевания в зоне анастомоза происходит лишь в 15-20% случаев. При этом у большинства таких больных выявляются гематогенные метастазы или рецидив опухоли в лимфатических узлах.
Как уже упоминалось, не менее важным в определении объема оперативного вмешательства является дистальный уровень резекции желудка. На основании большого числа исследований удаленных препаратов, было выявлено, что опухолевая инфильтрация стенки желудка редко распространяется на расстояние более 5 см [4, 7]. Подобные сведения могли бы послужить основанием для выполнения проксимальных субтотальных резекций желудка при II и III типе опухолей. Однако отдаленные результаты лечения свидетельствуют о развитии рецидива заболевания в желудочном трансплантате и перигастральных лимфатических узлах у 50-60% больных. Связано это как с развитием интрамураль-ных метастазов в стенке желудка, признака распространенного заболевания, так и с особенностями лимфогенного метаста-зирования [7]. Дистальное направление лимфотока желудка определяет поражение лимфатических узлов, расположенных вдоль большой и малой кривизны желудка, после блока паракардиальных лимфатических коллекторов. Вероятно, этим объясняются данные, полученные R.Siewert при исследовании групп пораженных лимфатических узлов (ЛУ) опухолей II типа. Метастазы в ЛУ вдоль большой кривизны желудка выявлены им у 15-16% пациентов, вдоль малой кривизны — у 67,8% [28]. Лимфодиссекция предполагает в такой ситуации удаление перигастральных лимфатических узлов одновременно с выполнением гастрэктомии [21, 28].
Классификация ТЫМ и ее модификация
Классификация ТЫМ Глубина инвазии Классификация С.РеСганаш, О.МаптоП и в^адагСе [26]
Ив До базальной мембраны Т1в
Т1а До слизистой оболочки Т1а
Т1Ь До подслизистого слоя Т1Ь
Т2 До мышечного слоя Т2а
Т3 До жировой клетчатки/серозной оболочки Т2Ь
Т4 В окружающие ткани Т3
S.DeMeester [9] выявил следующую частоту появления лимфогенных метастазов в зависимости от глубины инвазии опухолью стенки органа: инвазия слизистой оболочки (при прорастании мышечной пластинки слизистой оболочки) (Т1а) — 3-6%; инвазия подслизистого слоя (Т1Ь) — 20-30%; инвазия мышечного слоя (Т2) — 45-75%; прорастание адвен-тиции (Т3) — 80-85%.
Глубина инвазии стенки опухолью и число пораженных ЛУ определяют прогноз заболевания. Этот факт учитывается при определении стадии опухолевого процесса. S.Lagarde [20], C.Pedrazzani и О.Мамош [26] предложили внести изменения в ТЫМ-классификацию кардиоэзофагеального рака (таблица). Основываясь на результатах многолетних наблюдений, они отметили одинаковый прогноз заболевания у больных с Т2 и Т3 стадиями [20, 21, 26].
Наравне с глубиной инвазии опухолью стенки пищевода факторами, определяющими объем оперативного вмешательства, являются области поражения ЛУ и число измененных ЛУ. От выполнения адекватной лимфодиссекции, предполагающей удаления всех групп ЛУ, в которые возможно лимфогенное метастазирование, зависит эффективность оперативного лечения, продолжительность жизни больного.
Все три типа кардиоэзофагеальных опухолей имеют особенности лимфогенного метастазирования. Метастатичское распространение опухолей I типа происходит в ЛУ средостения и верхнего этажа брюшной полости, поражая следующие группы ЛУ: средние и нижние параэзофагеальные, задние медиастинальные, пищеводного отверстия диафрагмы, наддиафрагмальные, бифуркационные, правые и левые трахеобронхиальные, ворот легких, левые и правые пара-кардиальные, малой кривизны желудка, левой желудочной артерии, чревного ствола [17].
В соответствии с этими данными при опухолях I типа производится стандартная 2-зональная лимфодиссекция (по классификации ISDE, 1994 г.). Этот объем операции предполагает удаление ЛУ средостения (медиастинальные ЛУ до уровня бифуркации трахеи) и лимфодиссекцию в объеме D2 брюшной полости (перигастральные, левой желудочной артерии, общей печеночной артерии, селезеночной артерии). Распространение опухоли на стенку желудка не влияет на направление путей лимфотока, дублируя таковые от его кардиального отдела. Подобный объем лимфодиссекции оказывается достаточным при выполнении радикальной операции [3, 13, 17, 28].
Предложенная японскими хирургами трехзональная лимфодиссекция не имеет практической значимости при выявлении аденокарциномы дистального отдела пищевода. Метастатическое поражение шейных ЛУ не характерно для опухолей данного типа. Поражение этой группы ЛУ является признаком генерализации опухолевого процесса. Оперативное вмешательство в такой ситуации носит заведомо паллиативный характер, и расширение зоны лим-фодиссекции оказывается неоправданным [18, 19, 23, 33].
Долгое время спорными оставались данные о зонах лим-фотока при опухолях II и III типа. Противоречивые сведения о группах пораженных ЛУ, отсутствие единого подхода к выполнению лимфодиссекции послужили поводом для более тщательного изучения путей оттока лимфы от кардиально-го отдела желудка. J.R. Siewert и соавт. [28] были одними из первых, кто опубликовал данные об особенностях лим-фогенного метастазирования опухолей II типа. Оказалось, что при раке кардиоэзофагеального перехода с опухолевой инфильтрацией стенки пищевода у 15% больных метастазы обнаруживаются в нижних параэзофагеальных ЛУ. Их результаты подтверждались данными S.M.Dresner и PJ.Lamb
Том 168 • № 6
Принципы хирургического лечения кардиоэзофагеального рака
[13], исследовавших особенности тока лимфы от кардиаль-ного отдела желудка и дистального отдела пищевода в норме и при опухолевом поражении [14]. Те же закономерности лимфогенного метастазирования относятся и к опухолям III типа при распространении их на стенку пищевода [3, 8, 24, 25, 32].
Для определения уровня поражения стенки пищевода, при котором отмечается лимфогенное метастазирование в ЛУ средостения, F.Bozzetti и P.Bignami [5] провели соответствующие гистологические исследования. Оказалось, что инфильтрации стенки пищевода протяженностью 3 см или прорастание опухолью всех его слоев при меньшей протяженности приводит к появлению тока лимфы в медиа-стинальные ЛУ.
Основываясь на полученные данные, J.R.Siewert и соавт. [28] и C.Pedrazzani и соавт. [25, 26] считают оптимальным видом операции при опухолях III типа и большинстве опухолей II типа расширенную гастрэктомию. Данный объем вмешательства включает выполнение экстирпации желудка с трансхиатальной резекцией дистального отдела пищевода и обязательным выполнением лимфодиссекции нижних параэзофагеальных ЛУ [21, 28]. Многими исследователями ставится под сомнение радикальность подобных оперативных вмешательств. Объясняют они это невозможностью выполнения адекватной лимфодиссекции при трансхиатальном выделении пищевода. При изучении отдаленных результатов операций Льюиса и трансмедиастинальных эзофагэктомий приводятся более низкие показатели 5-летней выживаемости после второго вида вмешательств [18]. Однако результаты исследований J.R.Siewert и соавт. [28] демонстрируют одинаковую продолжительность жизни больных, перенесших операцию Льюиса и расширенную гастрэктомию. Похожие результаты приводят М.И.Давыдов, М.Д.Тер-Ованесов [1]. Их анализ отдаленных результатов лечения опухолей II типа свидетельствует об улучшении продолжительности жизни больных после выполнения гастрэктомий с резекцией дистального отдела пищевода, удалением нижних околопищеводных ЛУ и лимфодиссекцией D2 в брюшной полости.
Значительное число пораженных ЛУ и их локализация являются признаком распространенности опухолевого процесса. C увеличением N-стадии уменьшаются показатели безрецидивной и 5-летней выживаемости. По некоторым опубликованным данным [21, 35] 5-летняя выживаемость больных с непораженными ЛУ составляет 50%, при наличии метастазов в ЛУ — снижается до 13%. Эта зависимость находит отражение при TNM-стадировании опухоли.
До сих пор не существует единого подхода к определению N-стадии (метастатическое поражение ЛУ) TNM-классификации кардиоэзофагеального рака. Для определения стадии опухолей II и III типа пользуются данными европейской и американской классификаций, основанных на числе метастатически измененных ЛУ (International union against cancer, 1997/American joint committee on cancer, 2002): N0 (отсутствие пораженных ЛУ), N1 (1-7 ЛУ), N2 (7-15 ЛУ), N3 (больше 15 ЛУ).
В настоящее время для определения N-стадии при кардиоэзофагеальном раке I типа используются критерии стадирования рака пищевода Американского совместного комитета по раку (American joint committee on cancer, 2002). Однако анализ данных по продолжительности жизни больных с аденокарциномой дистального отдела пищевода выявляет определенные закономерности, характерные для опухолей данной зоны. В использующейся классификации поражение ЛУ чревного ствола относится к стадии М1 а, отдаленным метастазам. При этом большинство исследований [17, 21]
не выявляют снижения продолжительности жизни при поражении ЛУ данной группы при сравнении с поражением регионарных ЛУ. Подобные результаты послужили основанием для C.Pedrazzani и соавт. [21] внести изменения в имеющуюся TNM-классификацию рака дистального отдела пищевода с более четким разделением N- и М-стадий.
Модификация TNM-классификации
Классификация ТЫМ Модификация [21]
N0 (отсутствие пораженных N0 (отсутствие пораженных
региональных ЛУ) региональных ЛУ)
N1 (поражение региональ- N1 (1-3 ЛУ, включая M1a)
ных ЛУ) N2 (больше 3 ЛУ, включая
M1a)
N3 (нерегиональные ЛУ)
М0 (отсутствие отдаленных M0 (отсутствие метастазов)
метастазов)
М1а (метастазы в чревные М1 (наличие отдаленных
ЛУ) метастазов)
М1Ь (поражение нерегио-
нальных ЛУ, отдаленные ме-
тастазы)
Кардиоэзофагеальный рак — особое заболевание, характеризующееся быстрым ростом, агрессивным течением, ранним метастазированием. Расположение опухоли на границе пищевода и желудка, лимфоток в ЛУ грудной и брюшной полости определяют сложность оперативного лечения данного заболевания. Несмотря на то, что хирургический метод лечения является единственным радикальным, показатели продолжительности жизни оперированных больных остаются достаточно низкими. Стадия опухолевого процесса, наличие сопутствующих заболеваний должны определять тактику лечения каждого конкретного больного. Индивидуальный подход к выбору метода лечения, вида операции определяет течение послеоперационного периода, продолжительность жизни больных и, что не менее важно, качество жизни пациентов.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Давыдов М.И., Тер-Ованесов М.Д. Рак проксимального отдела желудка: современная классификация, тактика хирургического лечения, факторы прогноза // РМЖ.—2008.—№ 13.— С. 914-920.
2. Азимов Р.Х., Кубышкин В.А. Рак кардии. Выбор хирургической тактики // Хирургия.—2004.—№ 8.—С. 66-71.
3. Aikou T., Shimazu H. Difference in main lymphatic pathways from the lower esophagus and gastric cardia // Jap. J. Surg.—1989.— Vol. 19, № 3.—P. 290-295.
4. Bozzetti F., Bonfanti G., Bufalino R. et al. Adequacy of margins of resection in gastrectomy for cancer // Ann. Surg.—1982.— Vol. 196, № 6.—P. 685-690.
5. Bozzetti F., Bignami P., Bertario L. et al. Surgical treatment of gastric cancer invading the oesophagus // Eur. J. Surg. Oncol.— 2000.—Vol. 26, № 8.—P. 810-814.
6. Cascinu S., Giordani P., Catalano V. et al. Resection-line involvement in gastric cancer patients undergoing curative resections: implications for clinical management // Jap. J. Clin. Oncol.— 1999.—Vol. 29, № 6.—P. 291-293.
7. Casson A.G., Darnton S.J., Subramanian S., Hiller L. What is the optimal distal resection margin for esophageal carcinoma? // Ann. Thorac. Surg.—2000.—Vol. 69, № 1.—P. 205-209.
cyberleninka.ru
Хирургическое лечение рецидивов кардиоэзофагеального рака —
М.Д. Тер-Ованесов, М.И. Давыдов, И.С. Стилиди, А.Н. Абдихакимов, В.А. Марчук
Российский онкологический научный центр им. Н.Н. Блохина РАМН, Москва
Несмотря на длительную историю развития онкохирургии, крайне актуальным, с точки зрения выбора тактики лечения, остается проблема лечения рецидивных опухолей. Особенно остро эта проблема стоит при рецидивах рака проксимального отдела желудка с переходом на пищевод, что обусловлено как особенностями роста и метастазирования первичной опухоли, так и характером выполненных ранее вмешательств. Опыт, накопленный отечественными и зарубежными авторами, свидетельствует о том, что при рецидивах кардиоэзофагеального рака именно хирургическое лечение является методом выбора.
Все вышеизложенное позволяет отметить высокую актуальность совершенствования методологии повторных операций с учетом технических особенностей резекционного и реконструктивного этапов.
По определению Н.Н. ПЕТРОВА, «рецидивы — это разрастания опухолевой ткани, возникающие на том самом месте, где располагалась первичная опухоль:из неудаленных или неразрушенных частиц опухолевой тканей, уцелевших на месте, в ближайших лимфопутях или лимфоузлах после удаления : первичного опухолевого очага». Таким образом, к рецидивам рака желудка следует относить все опухолевые узлы, выявляемые после выполнения радикальных вмешательств как в зоне реконструированного желудочно-кишечного тракта, так и в области ложа удаленного органа. Причем с учетом развития методологии «превентивной расширенной лимфодиссекции» возникновение рецидивной опухоли в регионарных лимфатических узлах, подлежащих удалению с учетом путей лимфооттока, следует рассматривать как «локорегионарный рецидив заболевания».
В основу исследования положены результаты лечения 144 пациентов, находившихся в торакоабдоминальном отделении РОНЦ РАМН за период с 1981 по 1995 гг. по поводу рецидива кардиоэзофагеального рака. Из общего числа наблюдений 28 пациентов были ранее оперированы в РОНЦ РАМН, 116 пациентам операции произведены в других лечебных учреждениях. Следует отметить, что частота рецидивов кардиоэзофагеального рака среди пациентов, ранее оперированных в РОНЦ РАМН, составила лишь 4%.
Среди пациентов преобладали мужчины — 104 (72,2%). Соотношение мужчин и женщин составило 2,6:1, что соответствует аналогичному показателю для первичного рака кардиоэзофагеальной зоны. Возраст пациентов — от 27 до 82 лет. Преобладал возрастной интервал от 50 до 59 лет. Средний возраст в мужской группе составил 59 лет, а в женской 57 лет.
При прочих равных условиях наибольшее значение в возникновении рецидива имеют объем оперативного вмешательства и хирургический доступ. Из всей группы 93 пациентам ранее были выполнены проксимальные резекции чрезбрюшинным доступом. Среди 43 больных с рецидивами в анастомозе после гастрэктомии у 34 операция была выполнена абдоминальным доступом, и лишь у 9 — чресплевральным. Следует отметить, что чрезбрюшинная проксимальная резекция была выполнена лишь пациентам, оперированным в других лечебных учреждениях, что, с учетом развития рецидива, свидетельствует о неадекватности объема хирургического вмешательства.
Таким образом, несмотря на то, что проксимальные резекции выполнялись при меньшем объеме органного поражения, чем гастрэктомии, рецидив в анастомозе после них встречался чаще.
Комбинированные вмешательства ранее были выполнены лишь у 33 пациентов (22,9%). Сравнительно небольшое количество больных с рецидивами после комбинированных вмешательств может быть связано с более широким объемом удаляемых тканей, особенно на путях лимфооттока.
С учетов данных рентгено-эндоскопического исследования мы разделяем тип роста рецидивной опухоли на экзофитную — 36 (25%) пациенток, эндофитную — 49 (34%) больных и смешанную 59 (41%) больных. Значительное преобладание эндофитных и смешанных опухолей, характеризующихся значительным распространением подслизистой инфильтрации, видимых шире границ опухоли, свидетельствует о высокой злокачественности процесса в этих наблюдениях и косвенно отражает характеристики рецидивной опухоли.
Максимальное количество рецидивов после гастрэктомии и проксимальной резекции желудка диагностировано в 1-ый год после операции — у 58 (40,3%) больных; в сроки от 1 года до 2 лет — у 35 (24,3%) пациентов, от 2 до 3 лет — у 22 (15,2%) больных, от 3 до 4 лет — у 14 (9,7%) больных, от 4 до 5 лет — у 6 (4,2%) больных, в сроки свыше 5 лет — у 9 (6,2%) больных. Таким образом, с учетом сроков возникновения рецидивов после хирургического лечения можно выделить две группы:
1) ранний рецидив (до трех лет) — 115 больных;
2) поздний рецидив (более трех лет) — 29 больных.
Основным методом лечения рецидива кардиоэзофагеального рака был хирургический: повторные операции выполнены у 102/144 (70,8%) больных, в том числе у 65 — радикальные. Резектабельность составила 45,1% по отношению ко всем госпитализированным и 63,7% по отношению к оперированным больным.
Паллиативные шунтирующие вмешательства были выполнены 15 (14,7%) пациентам, т.е. почти у каждого седьмого больного.
Эксплоративные вмешательства были произведены 22 (21,5%) пациентами и объяснялись либо распространенностью опухолевого процесса, либо тяжестью сопутствующей патологии.
При рассмотрении вопроса о локализации рецидивного злокачественного процесса необходимо учитывать объем ранее перенесенного вмешательства. С учетом особенностей местного роста и метастазирования мы различали следующие локализации опухолевого процесса:
1. После проксимальной резекции желудка:
а) поражение пищеводно-желудочного анастомоза с инфильтрацией или без инфильтрации пищевода;
б) субанастомотическое расположение опухоли без вовлечения пищеводно-желудочного анастомоза;
в) тотальное поражение оставшейся части желудка.
2.После гастрэктомии:
а) поражение пищеводно-кишечного анастомоза с инфильтрацией или без инфильтрации пищевода.
После проксимальной резекции желудка и гастрэктомии закономерным является поражение пищеводного анастомоза (пищеводно-желудочное соустье — 95 случаев, пищеводно-кишечное — 40 случаев), что в большинстве случаев, особенно при возникновении рецидива в ближайшие сроки после операции, следует объяснять неадекватностью объема вмешательства по поводу первичного заболевания. Лишь в 9 случаях имела место субанастомотическая локализация опухоли в дистальной культе желудка.
Особенности лимфогенного метастазирования рецидивов кардиоэзофагеального рака во многом определяются характером предшествующего вмешательства с учетом объема выполненной лимфодиссекции. Закономерным как для первичного кардиоэзофагеального рака, так и для рецидивов является метастазирование в лимфатические коллекторы по обе стороны диафрагмы.
Опыт торакоабдоминального отделения показывает, что принципиальное применение абдоминоторакального доступа при хирургическом лечении первичного кардиоэзофагеального рака с обязательной резекцией не менее 5-6 см непораженного пищевода от проксимальной границы опухоли и выполнение лимфодиссекции в объеме D4 достоверно уменьшает число местных рецидивов в 4 раза.
Морфологические характеристики рецидивов кардиоэзофагеального рака с поражением пищеводных соустий и распространением инфильтрации на пищевод свидетельствуют о том, что при планировании хирургического лечения оптимальным является комбинированный абдоминоторакальный доступ по VI или VII межреберью слева.
Комбинированный доступ из срединной лапаротомии и правосторонней торакотомии по V межреберью необходим при локализации и распространении рецидивной опухоли на среднюю треть пищевода с целью адекватной его резекции и выполнения верхнемедиастинальной лимфодиссекции.
Всем больным были выполнены повторные операции различного объема. Характер повторных вмешательств, главным образом, определяется вариантом первой операции и степенью распространенности опухолевого процесса. 50 больным выполнена экстирпация оставшейся части желудка с резекцией пищевода, 15 больным — экстирпация пищеводно-кишечного анастомоза.
Распространение опухолевой инфильтрации на прилегающие структуры не являлось сдерживающим моментом при решении вопроса о возможности выполнения атипичной операции: комбинированные резекции выполнены 59 из 65 больных, причем у 51 пациента (86,4%) возникла необходимость выполнения мультиорганных резекций.
Реконструктивный этап после повторных вмешательств с высокой резекцией пищевода характеризуется значительным разнообразием способов восстановления непрерывности пищеварительного тракта, однако, на наш взгляд, оптимальными являются три варианта, каждый из которых имеет свои четкие показания:
1) после экстирпации культи желудка и резекции пищевода у 31 пациента использовалась петлевая пластика тонкой кишкой, во второй группе у 9 больных применялась пластика Roux-en-Y, в третьей группе у 10 пациентов использовался изоперистальтический сегмент толстой кишки;
2) у пациентов с перенесенной ранее гастрэктомией в интересах реконструктивного этапа отмечались различия объема резекции анастомозированной петли тонкой кишки: у 9 из 15 пациентов пищевод анастомозировали с непересеченной петлей тонкой кишки, у 3 больных восстанавливали непрерывность пищеварительного тракта по Ру, и еще у 3 больных для пластики использовали сегмент толстой кишки.
Показатели операбельности и резектабельности в различные периоды деятельности отделения имели существенные отличия. Показатель операбельности за весь период с 1981 по 1995 гг. составил 70,2%. В группе оперированных больных резектабельность составила 63,7%. И если в первый период работы отделения этот показатель был равен 55,6% (25 из 45 больных), то во второй период он увеличился до 70,8% (40 из 57).
В группе больных, перенесших пробные и паллиативные хирургические вмешательства, наоборот, отмечается динамика в сторону уменьшения пробных и увеличения паллиативных шунтирующих операций, направленных в основном на купирование наиболее тягостного симптома — дисфагии и улучшение социально-психологического состояния пациентов.
Таким образом, отработка методологии выполнения повторных вмешательств по поводу рецидивов кардиоэзофагеального рака способствовала значительному смещению акцентов в течение второго периода хирургической деятельности с увеличением показателей операбельности и резектабельности.
Самые высокие показатели операбельности отмечены после операции чрезбрюшинной проксимальной резекции желудка. Они составили 80,6% (75 из 93 больных). Резектабельность после операции чрезбрюшинной гастрэктомии составила 72,2% (13 из 18 больных). При рецидивах опухоли после операции типа Гэрлока и чресплевральной гастрэктомии отмечена меньшая частота операбельности и резектабельности.
При раннем рецидиве кардиоэзофагеального рака возможности радикального хирургического лечения ограничены. Из 115 больных, госпитализированных в клинику, оперированы 76 (66,0%), из них только у 43 удалось выполнить радикальную операцию. Таким образом, резектабельность по отношению к госпитализированным больным составила лишь 37,4%, а по отношению к оперированным — 56,6%. Столь низкие показатели операбельности и резектабельности в этой группе связаны с биологическими особенностями опухоли, в частности выраженным инфильтративным ростом с вовлечением окружающих структур и ранним метастазированием.
При позднем рецидиве кардиоэзофагеального рака показатели хирургического лечения лучше. Так из 29 госпитализированных пациентов оперированы 26 (89,7%), причем у 22 человек удалось выполнить радикальную операцию. Показатели резектабельности составили 75,9% по отношению к госпитализированным и 84,7% — по отношению ко всем оперированным больным.
Самая высокая резектабельность отмечена при экзофитной форме роста рецидивной опухоли — 73,0% (19 из 26 больных). Самые низкие показатели отмечены при смешанной форме роста рецидивной опухоли. Хотя операбельность составила 71,2%, возможность выполнения радикальной операции была значительно ограничена, а резектабельность по отношению ко всем оперированным больным составила 57,1%, а по отношению к госпитализированным — лишь 40,7%.
Из 102 оперированных по поводу рецидива кардиоэзофагеального рака больных осложнения после операции возникли у 30 (29,4%) человек, из них умерли 10, что составило 9,5% к общему числу оперированных. Наиболее высокий процент послеоперационных осложнений (33,8%) отмечался после радикальных вмешательств. После паллиативных вмешательств частота осложнений составила 26,6%, а после пробных — 18,8%.
Анализ полученных результатов показал, что ведущее место в структуре послеоперационных осложнений заняли функциональные осложнения со стороны дыхательной и сердечно-сосудистой систем.
В серии операций по поводу рецидивных опухолей кардиоэзофагеальной зоны хирургические осложнения встречаются значительно реже, чем функциональные. Это связано с анатомичностью оперирования и детальной отработкой техники выполнения вмешательств.
Внедрение усовершенствованных погружных антирефлюксных пищеводных анастомозов, а также успехи анестезиологии и реаниматологии во второй период деятельности отделения (1988-1995 гг.) значительно уменьшили частоту послеоперационных осложнений и летальности. За этот период частота несостоятельности швов пищеводных соустий снизилась до 2,5%.
Из 65 больных, которым были произведены повторные радикальные вмешательства, в послеоперационном периоде от различных осложнений умерли 7 человек (10,7%).
Из 58 пациентов, переживших радикальные вмешательства различного объема, 31 пациент умер в различные сроки от прогрессирования основного заболевания или от других соматических заболеваний. Одногодичный рубеж пережили 53 пациента. Средняя продолжительность жизни радикально оперированных пациентов составила 32,8 месяцев. Самый длительный срок наблюдения за больной после повторной операции — 10 лет. 5-летняя актуариальная выживаемость среди 65 оперированных больных, рассчитанная по таблицам дожития Cutler-Ederer, составила 24,6%.
При анализе отдаленных результатов радикального хирургического лечения в зависимости от сроков развития рецидива опухоли получены следующие данные: 44 больных имели ранний и 21 — поздний рецидив. Один больной из первой группы выбыл из-под наблюдения через 11 месяцев. Из 43 больных с ранними рецидивами до одного года умерли 7 человек. Среди больных с поздними рецидивами после радикальных операций до одного года умерли 5 из 21 больного.
Из 31 больного с ранним рецидивом опухоли трехлетний период прожили 7 пациентов (32,1%). Из 16 больных с поздним рецидивом 3 года пережили 9 пациентов (55,4%). В этом промежутке времени отмечается более благоприятное течение заболевания у пациентов с поздним появлением рецидива, хотя эти различия статистически недостоверны. Результаты 5-летней выживаемости не зависят от времени возникновения рецидива и составляют приблизительно одинаковое количество больных: 23,6% при раннем рецидиве и 25,6% — при позднем.
Из 15 больных, которым была выполнена паллиативная операция, в послеоперационном периоде умер 1 больной. Причиной смерти была тромбоэмболия легочной артерии. Из оставшихся 14 больных дальнейшая судьба 2 больных неизвестна. Остальные пациенты умерли от прогрессирования опухолевого процесса в сроки до 2 лет. Средняя продолжительность жизни у больных с паллиативными операциями составила 7 месяцев.
Улучшение качества жизни убедительно свидетельствует о целесообразности применения шунтирующих операций у больных с нерезектабельной формой рецидива кардиоэзофагеального рака и является альтернативой наложению кишечных свищей. В связи со сложностью выполнения шунтирующих операций, требующих навыка формирования высокого пищеводного соустья, часто выше дуги аорты, выполнение этих операций оправдано только в условиях специализированных клиник, располагающих опытом подобных вмешательств. Средняя продолжительность жизни после эксплоративных вмешательств равна 3,4 месяца.
Таким образом, радикальные операции при рецидиве кардиоэзофагеального рака позволяют не только избавить больных от тяжелых проявлений заболевания, но и увеличить продолжительность жизни. В ряде случаев возможно полное излечение больных. В целом, после отработки показаний и методологии выполнения повторных вмешательств отдаленные результаты приближаются к результатам хирургического лечения первичных опухолей кардиоэзофагеальной зоны.
Паллиативные шунтирующие операции обеспечивают лучшее качество жизни по сравнению с гастро-(еюно-)стомией и являются операциями выбора при технически неудалимых и диссеминированных рецидивных опухолях.
(Visited 21 times, 1 visits today)
medport.info
Комбинированное лечение кардиоэзофагеального рака —
В С. Мазурин
МОНИКИ, Москва
Каким образом можно улучшить непосредственные и отдаленные результаты лечения кардиоэзофагельного рака, какие есть для этого резервы? Мы полагаем, что резервы для этого следующие:
ранняя диагностика и раннее оперирование этой категории больных;
строгое соблюдение и выполнение разработанных методик оперативных вмешательств;
обязательное выполнение расширенной лимфаденэктомии при радикальных хирургических вмешательствах;
обеспечение адекватного послеоперационного периода;
концентрация больных раком кардиоэзофагеальной области в специализированных клиниках;
подготовка высококвалифицированных хирургов, способных выполнять сложные хирургические вмешательства в такой трудной для оперирования анатомической области, как кардиоэзофагеальная зона.
При правильном подходе к данной проблеме и учете всех перечисленных факторов, эффективность хирургического лечения больных раком кардиоэзофагеальной области может быть значительно повышена.
Хирургия кардиоэзофагеального рака прошла долгий путь в своем развитии и достигла высот, и мы не согласны с мнением тех специалистов, которые считают, что хирургический метод лечения достиг своего «потолка». Не следует забывать о том, что общий прогноз хирургического лечения не должен служить индивидуальным прогнозом в каждом конкретном случае.
Мы глубоко убеждены, что улучшение результатов хирургического лечения рака пищевода и желудка в целом и в частности кардиоэзофагеального рака связано с дальнейшим развитием, усовершенствованием и оптимизацией хирургического метода лечения, в котором до окончательного совершенства еще очень далеко. И в этом свою роль должны сыграть отказ от консервативных традиций, принятых в ряде клиник, постоянная переоценка и переосмысление существующих способов и методов лечения и неустанный творческий поиск новых, более эффективных средств и путей их лечения.
Несомненно и то, что перспектива улучшения отдаленных результатов лечения кардиоэзофагеального рака связана с развитием методов комбинированного лечения. Хирургический метод, оставаясь основным, должен быть совершенен, ибо никакое комбинирование не сможет исправить дефекты хирургии. Задача комбинирования — дополнить диапазон хирургического метода системным воздействием для того, чтобы нивелировать реализацию отдаленных метастазов, являющихся основной причиной гибели больных в отдаленные сроки.
Учитывая локальный характер лечебного воздействия при применении гипоксирадиотерапии, мы рассчитывали на уменьшение числа местных рецидивов, но полученные результаты не подтвердили эти предположения. Повлиять же на отдаленные результаты с помощью сочетания двух локальных методов лечения (хирургического и лучевого), которые после 1,5-2 лет в основном являются результатом реализации отдаленных метастазов, не представляется возможным. Эти соображения и полученные результаты заставили нас искать более перспективные и эффективные варианты комбинированного лечения. Таковыми нам представляются комбинации из локального (хирургического) и системного (химиотерапии) методов лечения.
Несмотря на предполагаемую высокую эффективность адъювантной химиотерапии, получить этому подтверждение не удалось; данные других авторов также не позволяют сделать однозначных выводов. На наш взгляд, более перспективным является применение предоперационной (неоадъювантной) химиотерапии. При этом можно достичь девитализации опухоли, разрушения мигрирующих раковых клеток, уменьшения массы основной опухоли до операции. Следовательно, к моменту операции возможно создание наиболее благоприятных условий для удаления опухоли.
При применении неоадъювантной полихимиотерапии во всех случаях кардиоэзофагеального рака мы наблюдали выраженные в той или иной степени изменения в морфологической структуре опухоли, обусловленные предоперационной регионарной химиотерапией: I степень патоморфоза получена у 38,5% больных; II степень — у 36,5%; III степень — у 19,2%; IV степень — у 5,8% пациентов.
К настоящему времени мы имеем результаты 5-летней выживаемости в группе комбинированного лечения с предоперационной регионарной химиотерапией:
1 год прожили 85,7% (42/49) больных;
2 года прожили 77,6% (38/49) больных;
3 года прожили 53,1% (26/49) больных;
5 лет прожили 49,8% (20/49) больных.
В группе чисто хирургического лечения 3-летний показатель равен 34,6% (без лимфодиссекции) и 41,1% (с лимфодиссекцией).
Перспективу эффективного комбинированного лечения мы связываем не только с системными методами лечения (химиотерапией и иммунотерапией), но и с дальнейшим совершенствованием техники абластичного выполнения оперативных вмешательств. Добиться значимых результатов от применения комбинированного лечения возможно лишь при совершенстве всех составляющих комбинацию методов. Такова наша основная позиция в оценке перспектив лечения кардиоэзофагеального рака.
(Visited 23 times, 1 visits today)
medport.info
Гастроэзофагеальный рак желудка — Про изжогу
Рак желудка считается распространенной патологией. Средний коэффициент людей, у которых диагностируют рак кардиального отдела желудка, составляет 15% от основной массы онкобольных с желудочной карциномой. Часто такой тип онкологии развивается не 1 год и протекает безболезненно. Боли появляются лишь на последних стадиях рака. Поэтому человек может и не подозревать, о своем недуге, что приводит к позднему выявлению заболевания.
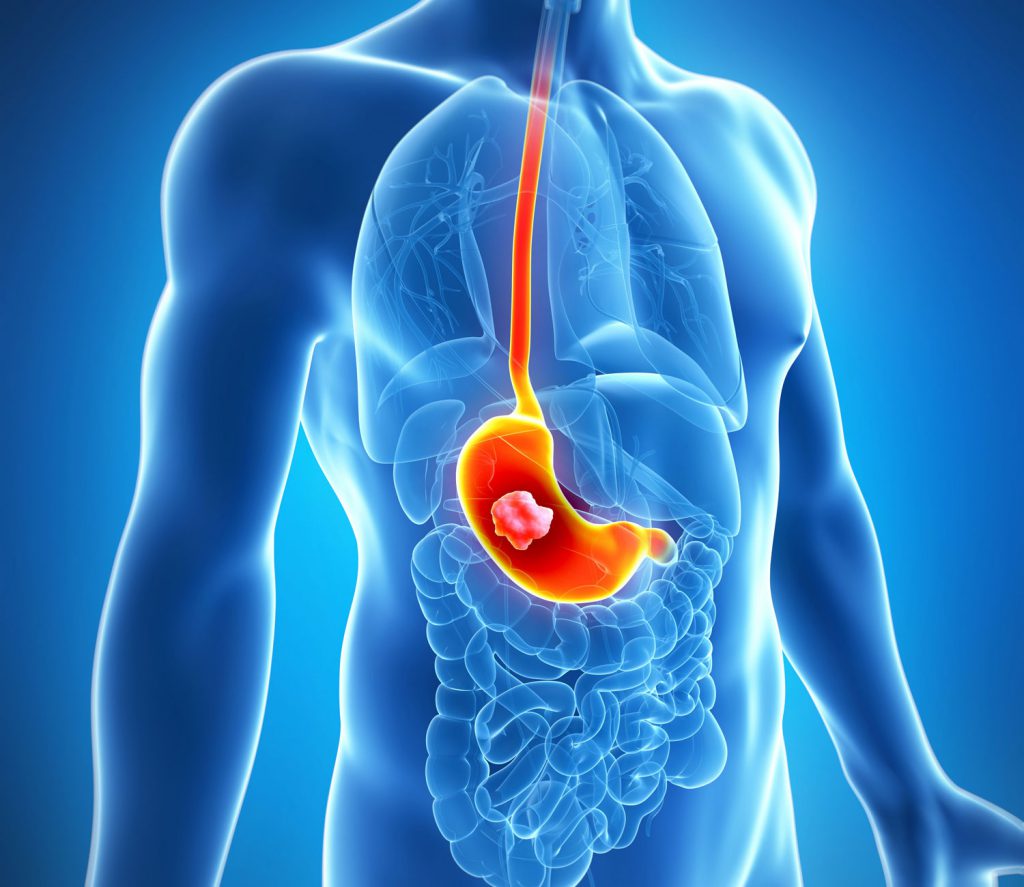
Что собой представляет?
Кардиоэзофагеальный тип рака представляет собой опухоль злокачественного характера, которая развивается на соустье желудка, захватывая его кардиальный отдел, и нижней части пищевода. Подобную форму желудочного рака называют комбинированной, так как опухоль охватывает сразу два органа. Такое размещение злокачественного образования не всегда поддается диагностике, что является еще одной причиной позднего обнаружения болезни.
Вернуться к оглавлениюСимптомы рака кардиального отдела желудка
 Частое присутствие изжоги может быть симптомом рака.
Частое присутствие изжоги может быть симптомом рака.Для карциномы, локализующейся в кардиальной части желудка и затрагивающей ближайший кусочек пищевода, характерны следующие симптомы, которые может чувствовать больной:
- болезненные ощущения в эпигастральной области;
- спазмирующие приступы сразу после трапезы;
- боли в ночное время суток;
- частое присутствие изжоги;
- неприятный привкус при отрыжке;
- тошнота и рвота с примесью крови;
- ухудшение аппетита;
- антипатия к некоторым блюдам;
- тяжесть в желудке;
- почерневший кал.
Причины развития
Основную причину развития кардиоэзофагеальной опухоли обуславливает гастроэзофагеальная рефлюксная болезнь. При этом недуге кислый желудочный сок забрасывается в пищеварительный канал и раздражает его стенки. Со временем внутренняя часть пищевода деформируется, образуя предраковое состояние, когда ткани воспаляются, приобретают цилиндрическую форму. Второй причиной роста опухли в кардии желудка является неправильное питание. Сюда можно отнести такие моменты:
- постоянное употребление горячей пищи, особенно это касается жителей севера, у которых частота развития подобной патологии в разы превышает случаи у южан;
- пристрастие к острым приправам, соусам, чесноку, луку;
- частое потребление кислых, жареных консервированных блюд, копченостей, солений;
- несоблюдение режима питания, большие разрывы между приемами пищи.
К третьей причине относят курение и чрезмерное употребление крепких спиртных напитков. Конечно, прямое воздействие на рост злокачественного образования в кардиальной области плохое питание, курение и алкоголь не оказывают. Но они благотворно влияют на развитие патогенных состояний (той же рефлюксной болезни), которые предшествуют раку подобного типа. Немаловажную роль в данном аспекте играет генетическая наследственность.
Вернуться к оглавлениюУ людей, в роду которых встречались случаи развития кардиоэзофагеального рака, риск заболеть тем же недугом возрастает в несколько раз.
Диагностика
 Диагностика подобной онкологической патологии позволяет определить место размещения опухоли, ее размеры, степень развития недуга, выявить наличие метастазов и, исходя из полученных сведений, определиться с методикой лечения, плюс спрогнозировать результат. При карциноме кардиальной области желудка применяются такие методы исследований:
Диагностика подобной онкологической патологии позволяет определить место размещения опухоли, ее размеры, степень развития недуга, выявить наличие метастазов и, исходя из полученных сведений, определиться с методикой лечения, плюс спрогнозировать результат. При карциноме кардиальной области желудка применяются такие методы исследований:
- Общий анализ крови. По этому исследованию смотрят количество гемоглобина и определяют, не страдает ли человек анемией, что свойственно при подобном онкологическом заболевании.
- Анализ крови на онкомаркеры. Число онкомаркеров позволяет не только выявить наличие рака, но и оценить, насколько активно ведет себя болезнь.
- Эзофагогастродуоденоскопия (глотание зонда) позволяет обследовать пищеварительный канал, желудок, двенадцатиперстную кишку, оценить их работоспособность, увидеть патологические изменения на тканях этих органов.
- УЗИ. Ультразвуковое исследование помогает увидеть состояние органов брюшины, проверить их на наличие опухоли.
- Биопсия проводится во время гастроскопии, обуславливает взятие пораженной ткани на анализ. Исследование этих тканей поможет выяснить характер опухоли, стадию ее роста.
- Эзофагогастрография подразумевает под собой рентгенологическую диагностику с использованием контрастного вещества. Показывает состояние органа, присутствие в нем опухоли в виде разросшихся тканей.
- Суточная рН-метрия. Данное обследование направлено на диагностику патологий, предшествующих раку желудка (гастрита, язвы, рефлюксной болезни), что, в свою очередь, помогает вовремя исправить ситуацию и предотвратить пагубные последствия.
- Манометрия позволяет увидеть состояние и оценить уровень работоспособности клапана, размещенного на границе пищеварительного тракта и желудка. Этот клапан пропускает пищу из пищевода в желудок, но препятствует забросу содержимого желудка обратно в пищеварительный канал.
- КТ и МРТ. Эти два исследования при кардиальной карциноме направлены на определение границ разрастания опухоли, плюс на выявление метастазов в других органах и частях организма.
- Сцинтиграфия являет собой радиоизотопное исследование, которое помогает увидеть распространение онкоклеток в костную ткань.
Методы лечения
 Лучевая терапия при раке желудка.
Лучевая терапия при раке желудка.Комбинированная форма рака лечится сложнее. Чем меньше стадия заболевания и чем меньше пораженных тканей, тем больше шансов получить хороший результат и благоприятный исход лечения. Методы:
- В основе борьбы с карциномой кардиальной части желудка стоит оперативный метод. Он обуславливает частичное либо полное удаление желудка вместе с пораженной частью пищеварительного канала. Если желудок нужно удалять полностью, что бывает на 2 или 3 стадии рака, то в таком случае остаток пищевода соединяется с тонкой либо толстой кишкой. Если требуется резекция большей части пищеварительного канала, то в этой ситуации проводится пластика с использованием части кишечника. При диагностировании 4 стадии комбинированной кардиальной карциномы оперативное вмешательство практически не имеет смысла. В таком случае пациентам назначаются спазмолитические и поддерживающие препараты.
- Лучевая терапия применяется как перед оперативным вмешательством, так и в послеоперационный период. Предоперационное облучение направлено на замедление роста опухоли и распространения метастазов. Лучевая терапия, применяемая после операции и удаления пораженных тканей, убивает остатки злокачественных клеток, сокращая тем самым вероятность рецидивов болезни.
- Химиотерапия подразумевает под собой употребление цитостатических препаратов, которые подавляют увеличение как самой опухоли, так и метастатических процессов. Применяется сей метод в комплексе с другими.
Прогноз на выздоровление
Люди с кардиоэзофагеальным раком, которых оперировать уже невозможно, живут от 3 месяцев до года. После проведения операции при таком диагнозе 5-летняя выживаемость составляет у 20−30% людей. Это при условии своевременного удаления пораженных тканей и отсутствия метастазов, что возможно лишь на начальных стадиях рака. Прогноз результата борьбы с карциномой желудка зависит от многих факторов. К ним относят:
- стадию развития болезни;
- тип злокачественного образования, его активность в плане роста;
- своевременное обнаружение недуга;
- разрастание метастазов;
- верно подобранные методы лечения.
worldwantedperfume.com
МАТЕРИАЛЫ КОНГРЕССОВ И КОНФЕРЕНЦИЙ: V РОССИЙСКАЯ ОНКОЛОГИЧЕСКАЯ КОНФЕРЕНЦИЯ
V РОССИЙСКАЯ ОНКОЛОГИЧЕСКАЯ КОНФЕРЕНЦИЯ
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ РЕЦИДИВОВ КАРДИОЭЗОФАГЕАЛЬНОГО РАКА
Тер-Ованесов М.Д., М.И. Давыдов, Стилиди И.С., А.Н. Абдихакимов, В.А. Марчук
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
Несмотря на длительную историю развития онкохирургии, крайне актуальным, с точки зрения выбора тактики лечения, остается проблема лечения рецидивных опухолей. Особенно остро эта проблема стоит при рецидивах рака проксимального отдела желудка с переходом на пищевод, что обусловлено как особенностями роста и метастазирования первичной опухоли, так и характером выполненных ранее вмешательств. Опыт, накопленный отечественными и зарубежными авторами, свидетельствует о том, что при рецидивах кардиоэзофагеального рака именно хирургическое лечение является методом выбора.
Все вышеизложенное позволяет отметить высокую актуальность совершенствования методологии повторных операций с учетом технических особенностей резекционного и реконструктивного этапов.
По определению Н.Н. ПЕТРОВА, «рецидивы — это разрастания опухолевой ткани, возникающие на том самом месте, где располагалась первичная опухоль…из неудаленных или неразрушенных частиц опухолевой тканей, уцелевших на месте, в ближайших лимфопутях или лимфоузлах после удаления … первичного опухолевого очага». Таким образом, к рецидивам рака желудка следует относить все опухолевые узлы, выявляемые после выполнения радикальных вмешательств как в зоне реконструированного желудочно-кишечного тракта, так и в области ложа удаленного органа. Причем с учетом развития методологии «превентивной расширенной лимфодиссекции» возникновение рецидивной опухоли в регионарных лимфатических узлах, подлежащих удалению с учетом путей лимфооттока, следует рассматривать как «локорегионарный рецидив заболевания».
В основу исследования положены результаты лечения 144 пациентов, находившихся в торакоабдоминальном отделении ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России за период с 1981 по 1995 гг. по поводу рецидива кардиоэзофагеального рака. Из общего числа наблюдений 28 пациентов были ранее оперированы в ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, 116 пациентам операции произведены в других лечебных учреждениях. Следует отметить, что частота рецидивов кардиоэзофагеального рака среди пациентов, ранее оперированных в ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, составила лишь 4%.
Среди пациентов преобладали мужчины — 104 (72,2%). Соотношение мужчин и женщин составило 2,6:1, что соответствует аналогичному показателю для первичного рака кардиоэзофагеальной зоны. Возраст пациентов — от 27 до 82 лет. Преобладал возрастной интервал от 50 до 59 лет. Средний возраст в мужской группе составил 59 лет, а в женской 57 лет.
При прочих равных условиях наибольшее значение в возникновении рецидива имеют объем оперативного вмешательства и хирургический доступ. Из всей группы 93 пациентам ранее были выполнены проксимальные резекции чрезбрюшинным доступом. Среди 43 больных с рецидивами в анастомозе после гастрэктомии у 34 операция была выполнена абдоминальным доступом, и лишь у 9 — чресплевральным. Следует отметить, что чрезбрюшинная проксимальная резекция была выполнена лишь пациентам, оперированным в других лечебных учреждениях, что, с учетом развития рецидива, свидетельствует о неадекватности объема хирургического вмешательства.
Таким образом, несмотря на то, что проксимальные резекции выполнялись при меньшем объеме органного поражения, чем гастрэктомии, рецидив в анастомозе после них встречался чаще.
Комбинированные вмешательства ранее были выполнены лишь у 33 пациентов (22,9%). Сравнительно небольшое количество больных с рецидивами после комбинированных вмешательств может быть связано с более широким объемом удаляемых тканей, особенно на путях лимфооттока.
С учетов данных рентгено-эндоскопического исследования мы разделяем тип роста рецидивной опухоли на экзофитную — 36 (25%) пациенток, эндофитную — 49 (34%) больных и смешанную 59 (41%) больных. Значительное преобладание эндофитных и смешанных опухолей, характеризующихся значительным распространением подслизистой инфильтрации, видимых шире границ опухоли, свидетельствует о высокой злокачественности процесса в этих наблюдениях и косвенно отражает характеристики рецидивной опухоли.
Максимальное количество рецидивов после гастрэктомии и проксимальной резекции желудка диагностировано в 1-ый год после операции — у 58 (40,3%) больных; в сроки от 1 года до 2 лет — у 35 (24,3%) пациентов, от 2 до 3 лет — у 22 (15,2%) больных, от 3 до 4 лет — у 14 (9,7%) больных, от 4 до 5 лет — у 6 (4,2%) больных, в сроки свыше 5 лет — у 9 (6,2%) больных. Таким образом, с учетом сроков возникновения рецидивов после хирургического лечения можно выделить две группы:
-
1) ранний рецидив (до трех лет) — 115 больных;
2) поздний рецидив (более трех лет) — 29 больных.
Основным методом лечения рецидива кардиоэзофагеального рака был хирургический: повторные операции выполнены у 102/144 (70,8%) больных, в том числе у 65 — радикальные. Резектабельность составила 45,1% по отношению ко всем госпитализированным и 63,7% по отношению к оперированным больным.
Паллиативные шунтирующие вмешательства были выполнены 15 (14,7%) пациентам, т.е. почти у каждого седьмого больного.
Эксплоративные вмешательства были произведены 22 (21,5%) пациентами и объяснялись либо распространенностью опухолевого процесса, либо тяжестью сопутствующей патологии.
При рассмотрении вопроса о локализации рецидивного злокачественного процесса необходимо учитывать объем ранее перенесенного вмешательства. С учетом особенностей местного роста и метастазирования мы различали следующие локализации опухолевого процесса:
1. После проксимальной резекции желудка:
-
а) поражение пищеводно-желудочного анастомоза с инфильтрацией или без инфильтрации пищевода;
б) субанастомотическое расположение опухоли без вовлечения пищеводно-желудочного анастомоза;
в) тотальное поражение оставшейся части желудка.
2.После гастрэктомии:
-
а) поражение пищеводно-кишечного анастомоза с инфильтрацией или без инфильтрации пищевода.
После проксимальной резекции желудка и гастрэктомии закономерным является поражение пищеводного анастомоза (пищеводно-желудочное соустье — 95 случаев, пищеводно-кишечное — 40 случаев), что в большинстве случаев, особенно при возникновении рецидива в ближайшие сроки после операции, следует объяснять неадекватностью объема вмешательства по поводу первичного заболевания. Лишь в 9 случаях имела место субанастомотическая локализация опухоли в дистальной культе желудка.
Особенности лимфогенного метастазирования рецидивов кардиоэзофагеального рака во многом определяются характером предшествующего вмешательства с учетом объема выполненной лимфодиссекции. Закономерным как для первичного кардиоэзофагеального рака, так и для рецидивов является метастазирование в лимфатические коллекторы по обе стороны диафрагмы.
Опыт торакоабдоминального отделения показывает, что принципиальное применение абдоминоторакального доступа при хирургическом лечении первичного кардиоэзофагеального рака с обязательной резекцией не менее 5-6 см непораженного пищевода от проксимальной границы опухоли и выполнение лимфодиссекции в объеме D4 достоверно уменьшает число местных рецидивов в 4 раза.
Морфологические характеристики рецидивов кардиоэзофагеального рака с поражением пищеводных соустий и распространением инфильтрации на пищевод свидетельствуют о том, что при планировании хирургического лечения оптимальным является комбинированный абдоминоторакальный доступ по VI или VII межреберью слева.
Комбинированный доступ из срединной лапаротомии и правосторонней торакотомии по V межреберью необходим при локализации и распространении рецидивной опухоли на среднюю треть пищевода с целью адекватной его резекции и выполнения верхнемедиастинальной лимфодиссекции.
Всем больным были выполнены повторные операции различного объема. Характер повторных вмешательств, главным образом, определяется вариантом первой операции и степенью распространенности опухолевого процесса. 50 больным выполнена экстирпация оставшейся части желудка с резекцией пищевода, 15 больным — экстирпация пищеводно-кишечного анастомоза.
Распространение опухолевой инфильтрации на прилегающие структуры не являлось сдерживающим моментом при решении вопроса о возможности выполнения атипичной операции: комбинированные резекции выполнены 59 из 65 больных, причем у 51 пациента (86,4%) возникла необходимость выполнения мультиорганных резекций.
Реконструктивный этап после повторных вмешательств с высокой резекцией пищевода характеризуется значительным разнообразием способов восстановления непрерывности пищеварительного тракта, однако, на наш взгляд, оптимальными являются три варианта, каждый из которых имеет свои четкие показания:
-
1) после экстирпации культи желудка и резекции пищевода у 31 пациента использовалась петлевая пластика тонкой кишкой, во второй группе у 9 больных применялась пластика Roux-en-Y, в третьей группе у 10 пациентов использовался изоперистальтический сегмент толстой кишки;
2) у пациентов с перенесенной ранее гастрэктомией в интересах реконструктивного этапа отмечались различия объема резекции анастомозированной петли тонкой кишки: у 9 из 15 пациентов пищевод анастомозировали с непересеченной петлей тонкой кишки, у 3 больных восстанавливали непрерывность пищеварительного тракта по Ру, и еще у 3 больных для пластики использовали сегмент толстой кишки.
Показатели операбельности и резектабельности в различные периоды деятельности отделения имели существенные отличия. Показатель операбельности за весь период с 1981 по 1995 гг. составил 70,2%. В группе оперированных больных резектабельность составила 63,7%. И если в первый период работы отделения этот показатель был равен 55,6% (25 из 45 больных), то во второй период он увеличился до 70,8% (40 из 57).
В группе больных, перенесших пробные и паллиативные хирургические вмешательства, наоборот, отмечается динамика в сторону уменьшения пробных и увеличения паллиативных шунтирующих операций, направленных в основном на купирование наиболее тягостного симптома — дисфагии и улучшение социально-психологического состояния пациентов.
Таким образом, отработка методологии выполнения повторных вмешательств по поводу рецидивов кардиоэзофагеального рака способствовала значительному смещению акцентов в течение второго периода хирургической деятельности с увеличением показателей операбельности и резектабельности.
Самые высокие показатели операбельности отмечены после операции чрезбрюшинной проксимальной резекции желудка. Они составили 80,6% (75 из 93 больных). Резектабельность после операции чрезбрюшинной гастрэктомии составила 72,2% (13 из 18 больных). При рецидивах опухоли после операции типа Гэрлока и чресплевральной гастрэктомии отмечена меньшая частота операбельности и резектабельности.
При раннем рецидиве кардиоэзофагеального рака возможности радикального хирургического лечения ограничены. Из 115 больных, госпитализированных в клинику, оперированы 76 (66,0%), из них только у 43 удалось выполнить радикальную операцию. Таким образом, резектабельность по отношению к госпитализированным больным составила лишь 37,4%, а по отношению к оперированным — 56,6%. Столь низкие показатели операбельности и резектабельности в этой группе связаны с биологическими особенностями опухоли, в частности выраженным инфильтративным ростом с вовлечением окружающих структур и ранним метастазированием.
При позднем рецидиве кардиоэзофагеального рака показатели хирургического лечения лучше. Так из 29 госпитализированных пациентов оперированы 26 (89,7%), причем у 22 человек удалось выполнить радикальную операцию. Показатели резектабельности составили 75,9% по отношению к госпитализированным и 84,7% — по отношению ко всем оперированным больным.
Самая высокая резектабельность отмечена при экзофитной форме роста рецидивной опухоли — 73,0% (19 из 26 больных). Самые низкие показатели отмечены при смешанной форме роста рецидивной опухоли. Хотя операбельность составила 71,2%, возможность выполнения радикальной операции была значительно ограничена, а резектабельность по отношению ко всем оперированным больным составила 57,1%, а по отношению к госпитализированным — лишь 40,7%.
Из 102 оперированных по поводу рецидива кардиоэзофагеального рака больных осложнения после операции возникли у 30 (29,4%) человек, из них умерли 10, что составило 9,5% к общему числу оперированных. Наиболее высокий процент послеоперационных осложнений (33,8%) отмечался после радикальных вмешательств. После паллиативных вмешательств частота осложнений составила 26,6%, а после пробных — 18,8%.
Анализ полученных результатов показал, что ведущее место в структуре послеоперационных осложнений заняли функциональные осложнения со стороны дыхательной и сердечно-сосудистой систем.
В серии операций по поводу рецидивных опухолей кардиоэзофагеальной зоны хирургические осложнения встречаются значительно реже, чем функциональные. Это связано с анатомичностью оперирования и детальной отработкой техники выполнения вмешательств.
Внедрение усовершенствованных погружных антирефлюксных пищеводных анастомозов, а также успехи анестезиологии и реаниматологии во второй период деятельности отделения (1988-1995 гг.) значительно уменьшили частоту послеоперационных осложнений и летальности. За этот период частота несостоятельности швов пищеводных соустий снизилась до 2,5%.
Из 65 больных, которым были произведены повторные радикальные вмешательства, в послеоперационном периоде от различных осложнений умерли 7 человек (10,7%).
Из 58 пациентов, переживших радикальные вмешательства различного объема, 31 пациент умер в различные сроки от прогрессирования основного заболевания или от других соматических заболеваний. Одногодичный рубеж пережили 53 пациента. Средняя продолжительность жизни радикально оперированных пациентов составила 32,8 месяцев. Самый длительный срок наблюдения за больной после повторной операции — 10 лет. 5-летняя актуариальная выживаемость среди 65 оперированных больных, рассчитанная по таблицам дожития Cutler-Ederer, составила 24,6%.
При анализе отдаленных результатов радикального хирургического лечения в зависимости от сроков развития рецидива опухоли получены следующие данные: 44 больных имели ранний и 21 — поздний рецидив. Один больной из первой группы выбыл из-под наблюдения через 11 месяцев. Из 43 больных с ранними рецидивами до одного года умерли 7 человек. Среди больных с поздними рецидивами после радикальных операций до одного года умерли 5 из 21 больного.
Из 31 больного с ранним рецидивом опухоли трехлетний период прожили 7 пациентов (32,1%). Из 16 больных с поздним рецидивом 3 года пережили 9 пациентов (55,4%). В этом промежутке времени отмечается более благоприятное течение заболевания у пациентов с поздним появлением рецидива, хотя эти различия статистически недостоверны. Результаты 5-летней выживаемости не зависят от времени возникновения рецидива и составляют приблизительно одинаковое количество больных: 23,6% при раннем рецидиве и 25,6% — при позднем.
Из 15 больных, которым была выполнена паллиативная операция, в послеоперационном периоде умер 1 больной. Причиной смерти была тромбоэмболия легочной артерии. Из оставшихся 14 больных дальнейшая судьба 2 больных неизвестна. Остальные пациенты умерли от прогрессирования опухолевого процесса в сроки до 2 лет. Средняя продолжительность жизни у больных с паллиативными операциями составила 7 месяцев.
Улучшение качества жизни убедительно свидетельствует о целесообразности применения шунтирующих операций у больных с нерезектабельной формой рецидива кардиоэзофагеального рака и является альтернативой наложению кишечных свищей. В связи со сложностью выполнения шунтирующих операций, требующих навыка формирования высокого пищеводного соустья, часто выше дуги аорты, выполнение этих операций оправдано только в условиях специализированных клиник, располагающих опытом подобных вмешательств. Средняя продолжительность жизни после эксплоративных вмешательств равна 3,4 месяца.
Таким образом, радикальные операции при рецидиве кардиоэзофагеального рака позволяют не только избавить больных от тяжелых проявлений заболевания, но и увеличить продолжительность жизни. В ряде случаев возможно полное излечение больных. В целом, после отработки показаний и методологии выполнения повторных вмешательств отдаленные результаты приближаются к результатам хирургического лечения первичных опухолей кардиоэзофагеальной зоны.
Паллиативные шунтирующие операции обеспечивают лучшее качество жизни по сравнению с гастро-(еюно-)стомией и являются операциями выбора при технически неудалимых и диссеминированных рецидивных опухолях.
rosoncoweb.ru
Современные подходы хирургического лечения рака кардии с переходом на пищевод Текст научной статьи по специальности «Клиническая медицина»
УДК: 616.333+616.329]-006.6-089
современные подходы хирургического лечения рака кардии с переходом на пищевод
э.р. тикаев, М.в. Бурмистров, р.ф. Еникеев, С.в. Эинченко, Е.И. Сигал, р.М. тазиев, И.А. бродер, И.ф. раббаниев, А.А. Морошек
Кафедра онкологии и хирургии Казанской государственной медицинской академии, Республиканский клинический онкологический диспансер МЗ РТ, г. Казань 420029, г. Казань, Сибирский тракт, 29, e-mail: [email protected]
Представлен опыт хирургического лечения кардиоэзофагеального рака у 224 пациентов, находившихся на лечении в РКОД МЗ РТ г. Казани. Больные разделены на 3 группы в зависимости от типа аденокарциномы по классификации J.R. Siewert. В первой группе было 35 (15,6 %), во второй — 107 (47,8 %), в третьей — 82 (36,6 %) больных. Каждая группа разделена на подгруппы, в зависимости от следующих выполненных операций: трансхиатальные пластики пищевода с эзофагогастроанастомозом на шее, трансторакальные пластики пищевода (операции типа Льюиса и Гэрлока) с внутриплев-ральным эзофагогастроанастомозом и гастрэктомии с высокой резекцией пищевода. Показана высокая результативность дифференцированного подхода в хирургическом лечении кардиоэзофагеального рака в зависимости от типа аденокарциномы. Так, при Siewert 1 возможно проведение трансхиатальных и трансторакальных пластик пищевода, тогда как выполнение гастрэктомий при Siewert 2 и трансхиатальных пластик пищевода при Siewert 3 прогностически неблагоприятно.
Ключевые слова: кардиоэзофагеальный рак, хирургическое лечение.
MODERN APPROACHES TO SURGICAL TREATMENT FOR CARDIO-ESOPHAGEAL CANCER E.R. Tickaev, M.V. Burmistrov, R.F. Enikeev, S.V Zinchenko, E.I. Sigal, R.M. Tasiev,
I.A. Broder, I.F. Rabbaniev, A.A. Moroshek Department of oncology and surgery of Kazan State Medical Academy, Republic Clinical Oncology Dispensary, Kazan 29, Sibirsky tract, 420020-Kazan, e-mail: [email protected]
The experience of surgery in 224 patients with cardio-esophageal cancer treated in the Kazan Republic Clinical Oncology Dispensary is presented. The patients are divided into 3 groups in respect of the type of adenocarcinoma (classification by J.R. Siewert). Thus, the first group consists of 35 (15.6 %) patients, the second-107 (47.8 %) and the third — 82 (36.6 %) patients. Each group is divided into subgroups according to the performed operation: transhiatal esophagoplasty with esophagogastroanas-tomosis on the neck, transthoracal esophagoplasty (operations by Lewis and Gerlock) with intrapleural esophadogastroanastomosis and gastrectomies with high resection of esophagus. High productivity of the differentiated approach to surgical treatment of cardio-esophageal cancer depending on the type of adenocarcinoma is shown. So, it is revealed that performance of transhiatal and transthoracal esophagoplasty is possible in cases of type I adenocarcinoma. Gastrectomies in cases of type II adenocarcimoma are of poor prognosis. And type III adenocarcinoma makes transhiatal esophagoplasty extremely unfavorable.
Key words: cardio-esophageal cancer, adenocarcinoma, esophagectomy, Barret’s cancer.
Кардиоэзофагеальный рак (КЭР) — рак проксимального отдела желудка с переходом на пищевод, который характеризуется как высокозлокачественная опухоль с лимфогенным метастазированием в лимфоколлекторы как брюшной полости, так и средостения. За последние 20 лет, на фоне снижения заболеваемости раком желудка, отмечен резкий рост случаев КЭР [2, 3]. Эта форма онкопатологии в настоящее время занимает 6-е место по причине смерти от рака во всем мире. При этом отмечается, что при эпидемиологических исследованиях в Европе и США выявлены значительные
изменения в структуре гистологического типа рака пищевода и пищеводно-желудочного перехода за счет увеличения доли аденокарцином [6, 7].
Несмотря на заметные успехи в хирургическом лечении КЭР, ближайшие и отдаленные результаты экстирпаций и резекций пищевода с одномоментной пластикой остаются неудовлетворительными. Данное обстоятельство требует всесторонней оценки оперативной техники и путей улучшения хирургического лечения КЭР. В связи с этим актуальным остается вопрос выбора оперативного доступа при этом виде рака [1, 4, 5].
Практически значимым примером попытки создания универсальной классификации для аденокарциномы зоны пищеводно-желудочного перехода является классификация, предложенная J.R. Siewert в 1996 г. [7]. С позиций этой классификации представляется интересным проанализировать непосредственную и отдаленную эффективность хирургического лечения больных кардиоэзофагеальным раком.
Материал и методы
За 12 лет, с 1998 по 2009 г., в отделении хирургии пищевода и желудка Республиканского клинического онкологического диспансера Министерства здравоохранения Республики Татарстан находилось на лечении 224 пациента с КЭР Возраст больных от 36 до 84 лет (средний возраст — 63,2 года). В анализируемой группе преобладали лица мужского пола — 74,5 % и пациенты возрастной группы от 61 до 70 лет — 48,2 % (табл. 1). У 215 пациентов были выявлены различные сопутствующие заболевания, чаще всего со стороны сердечно-сосудистой и дыхательной систем. При распределении больных КЭР по классификации Международного противоракового союза (2007 год, 5-е издание) TNM выявлено, что у большинства пациентов диагностирован КЭР Ша стадии — 92 и II стадии -58 наблюдений.
Все больные, согласно классификации J.R. Siewert [7], были разделены на три группы. Каждая группа подразделена на подгруппы, в зависимости от выполненной операции: транс-
хиатальная (ТХ) экстирпация пищевода с одномоментной заднемедиастинальной пластикой «стеблем» желудка и эзофагогастроанастомозом (ЭГА) на шее; резекция пищевода трансторакальным (ТТ) (право- или левосторонним) доступом с внутриплевральным анастомозом; гастрэкто-мия (ГЭ).
В первую группу вошло 35 (15,6 %) пациентов с аденокарциномой 1-го типа. Из них — 17 (48,6 %) произведена ТХ пластика пищевода и 18 (51,4 %) -ТТ. Во второй группе было 107 (47,8 %) человек с аденокарциномой 2-го типа, из которых 32 (29,9 %) прооперированы из ТХ доступа, 49 (45,8 %) — из ТТ доступа с внутриплевральным анастомозом (операции типа Льюиса и Гэрлока) и 24 (24,3 %) выполнили ГЭ с резекцией абдоминального сегмента пищевода. В третьей группе было 82 (36,6 %) человека с аденокарциномой 3-го типа. Из них 2 (2,4 %) больным произведена эзофагога-стрэктомия с одномоментной колопластикой левой половиной ободочной кишки, 8 (9,8 %) прооперированы из ТТ доступа с внутриплевральным анастомозом (операции типа Льюиса и Гэрлока) и 71 (87,8 %) пациенту выполнена ГЭ (табл. 2).
Общая послеоперационная летальность при хирургическом лечении КЭР составила 3,1 %, умерло 7 больных. В зависимости от варианта выполненных операций, независимо от уровня поражения по Siewert, наибольший уровень летальности зафиксирован при трансторакальных вмешательствах и при гастрэктомии — по 3 случая соответственно (табл. 3). Основные причины летальных исходов: несостоятельность
Таблица 1
распределение больных кардиоэзофагеальным раком по полу и возрасту
Возраст (лет) 31-40 41-50 51-60 61-70 71-90 Итого
Мужчины 5 12 44 79 27 167
Женщины — 4 8 29 16 57
Всего 5 16 52 108 43 224
Таблица 2
распределение больных Кэр по характеру оперативного вмешательства
в зависимости от типа опухоли
Операционный доступ ТХ ТТ ГЭ Итого
Siewert 1 17 18 — 35 (15,6 %)
Siewert 2 32 50 25 107 (47,8 %)
Siewert 3 2 8 72 82 (36,6 %)
Всего 51 76 97 224 (100 %)
современные подходы хирургического лечения рака кардии с переходом на пищевод ——————————————————————————— 63
Таблица 3
распределение показателей послеоперационной летальности в зависимости от характера оперативного вмешательства и типа опухоли
Доступ ТХ ТТ ГЭ
Siewert 1 (n=35) — 1 (2,8 %) —
Siewert 2 (n=107) 1 (0,9 %) 2 (1,8 %) 1 (0,9 %)
Siewert 3 (n=82) — — 2 (2,4 %)
Таблица 4
Количество ранних осложнений в зависимости от операции
Доступ ТХ ТТ ГЭ
Ранние Отдаленные Ранние Отдаленные Ранние Отдаленные
Siewert 1 5 (29,4 %) — 3 (16,6 %) — — —
Siewert 2 7 (21,8 %) 4 (12,5 %) 5 (10,0 %) 2 (4 %) 2 (8,0 %) 1 (4,0 %)
Siewert 3 2 (100 %) — 1 (12,5 %) — 8 (11,0 %) 2 (2,6 %)
ВСЕГО 14 (27,4 %) 4 (7,8 %) 9 (11,8 %) 2 (2,6 %) 10 (10,3 %) 3 (3,0 %)
анастомозов — 3, в том числе внутриплевраль-ных ЭГА — 2, эзофагоеюноанастомоза — 1; в остальных случаях — острый инфаркт миокарда, тромбоз брыжеечных сосудов, ТЭЛА и отек легких.
Осложнения при хирургическом лечении КЭР возникли в 18,7 % случаев (табл. 4), они представлены как ранними (табл. 5), так и отдаленными процессами (к последним отнесены стриктуры и рецидивы в зоне анастомозов).
Уровень осложнений зависел от вида выполненных операций и распространенности опухолевого процесса по Siewert, реже всего ранние осложнения возникали после ГЭ — в 10 (10,3 %) случаях, а отдаленные осложнения после ТТ операций — в 2 (2,6 %) случаях.
При анализе радикальности выполненных операций выявлено, что среднее количество удаленных лимфатических узлов равнялось 5,2.
При этом наибольшее количество лимфоузлов было удалено при операциях по поводу КЭР, классифицированного как Siewert 3, — 18 , наименьшее при Siewert 1 — 11. Выявлено, что наиболее радикальными оказались ТТ операции при Siewert 1 и Siewert 3, среднее количество удаленных лимфоузлов — 6,1 и 8,1 соответственно. Наименее радикальными были ТХ пластики при Siewert 3, в среднем в послеоперационном материале обнаружено 3 лимфоузла.
Однако основным критерием эффективности хирургического лечения у пациентов со злокачественными новообразованиями, как известно,
Таблица 5
характер и частота ранних осложнений после хирургического лечения Кэр
Количество осложнений Количество больных
Несостоятельность ЭГА на шее 7
Несостоятельно сть внутриплеврального ЭГА 6
Плеврит 4
Пневмония 4
Внутрибрюшное кровотечение 3
Серозный перитонит 3
Внутриплевральное кровотечение 2
Эмпиема плевры 2
Острая кишечная непроходимость 1
Отек легких 1
Тромбоэмболия легочной артерии 1
Острый инфаркт миокарда 1
Острый тромбоз мезентериальных сосудов 1
Нагноение послеоперационной раны 1
Приступы аритмии в послеоперационном периоде 1
Подкожная эвентрация 1
Несостоятельно сть эзофаго еюноанастомоза 1
Полиорганная недостаточность 1
Всего 41
1 Операция
11 1
1 J _П2
1 J 1-censored
+ 2-censored
1 1
-а—нн-п і
1
‘ і 1 1 -ні
і — +
п і і і і і г~
0,00 2,00 4,00 6,00 8,00 10,00 12,00
Продолммтельность (годы)
Рис. 1. Отдаленная выживаемость пациентов при КЭР Siewert 1, в зависимости от вида оперативного вмешательства:
1 — ТХ, 2 — ТТ
V Операция
і’ 1
jA Л2
11 _■ ! 3
J 1-censored
+ 2-censored
4 1 -r 3-censored
1 u-і ;
■_ і _ ” ; “i
1———1———1——-1———1——-1———Г~
0,00 2,00 4,00 6,00 8,00 10,00 12,00
Продолжітельность (годы)
Рис. 2. Отдаленная выживаемость пациентов при КЭР Siewert 2, в зависимости от вида оперативного вмешательства:
1 — ТХ, 2 — ТТ, 3 — ГЭ
являются показатели отдаленной выживаемости. Учитывая убывание пациентов в группах с течением времени по причине летальности, подсчет производился по Каплану-Мейеру. Следует отметить, что в данном исследовании проанализировано 206 случаев из 224, так как 11 пациентов проживали в отдаленных регионах страны, 7 больных умерли в послеоперационном
периоде и при анализе отдаленных результатов лечения не учитывались.
При КЭР Siewert 1 под динамическом наблюдении находились 33 больных, которые перенесли ТХ и ТТ пластики пищевода. В отдаленные сроки после ТХ пластики пищевода погибли 13 пациентов, сроки жизни составили от 2 до 102 мес. Аналогичный показатель при ТТ операциях (п=9) составил от 3 до 50 мес. После ТХ пластики пищевода живы 4 больных, сроки наблюдения составили от 18 до 111 мес, после ТТ операций живы 8 пациентов, сроки — от 15 до 131 мес (рис. 1). Медиана продолжительности жизни (МПЖ) составила при ТХ операциях 25 мес, при ТТ — 15 мес.
После операций в объеме ТХ, ТТ и ГЭ по поводу КЭР Siewert 2 в отдаленном периоде наблюдались 96 больных. Из них в отдаленном периоде умерли 24 пациента, перенесших ТХ пластику пищевода, сроки жизни составили от 3 до 51 мес. Аналогичный показатель при ТТ операциях (п=29) составил от 4 до 41 мес, при ГЭ (п=17) — от 4 до 44 мес соответственно. Сроки жизни 4 живых пациентов после ТХ пластики пищевода составили от 22 до 125 мес, после ТТ операцияй (п=15) — от 5 до 142 мес, при ГЭ (п=7) — от 8 до 42 мес соответственно (рис. 2). Таким образом, МПЖ составила при ТХ — 19 мес, при ТТ — 20 мес, при ГЭ — 14 мес.
При КЭР Siewert 3 больным (п=76) также выполнялись ТХ, ТТ операции и ГЭ. В отдаленные сроки (от 11 до 12 мес) после ТХ пластики пищевода умерли 2 пациента. Аналогичный показатель при ТТ операциях (п=3) составил от 5 до 63 мес. при ГЭ (п=43) — от 11 до 115 мес соответственно. После ТТ пластики пищевода живы 3 больных, сроки наблюдения составили от 45 до 113 мес, после ГЭ (п=25), сроки наблюдения — от 2 до 137 мес (рис. 3). Таким образом, МПЖ при ТХ операциях составила — 10 мес, при ТТ вмешательствах -63 мес, при ГЭ — 20 мес.
Нами были рассмотрена выживаемость пациентов по временным шкалам при разных типах КЭР (1 год, 3 года и 5 лет). При Siewert 1 после ТХ операций в течение одного года наблюдалось 70,6 %, до 3 лет — 41,0 % и до 5 лет -35,2 % пациентов. После ТТ операций — 64,7, 53,0 и 47,0 % больных соответственно.
СОВРЕМЕННыЕ ПОдХОды ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ РАКА КАРдИИ С ПЕРЕХОдОМ НА ПИщЕВОд
————————————————————————————- 65
Рис. 3. Отдаленная выживаемость пациентов при КЭР Siewert 3, в зависимости от вида оперативного вмешательства:
1 — ТХ, 2 — ТТ, 3 — ГЭ
При КЭР Siewert 2 после ТХ операций в течение одного года наблюдалось 53,5 %, до 3 лет — 17,8 % и до 5 лет — 14,3 % пациентов. После ТТ операций — 82, 34 и 32 % больных соответственно. После ГЭ 1 год наблюдалось 54 %, до 3 лет — 41,6 % больных и до 5 лет -29 % пациентов
При КЭР Siewert 3 после ТХ операций ни один из больных не пережил первый год наблюдения. После ТХ операций в течение 1 года наблюдалось 83,3 %, до 3 лет и до 5 лет —
66,6 % больных. После ГЭ — 70,5, 42,6 и 41,1 % пациентов соответственно.
При анализе отдаленных результатов хирургического лечения установлено, что при КЭР, стратифицированного как Siewert 1, показатели одногодичной выживаемости лучше после ТХ операций — 70,6 %. Однако в этом случае 3- и 5-летняя выживаемость оказалась максимальной после ТТ хирургических вмешательств — 53,0 %
и 47,0 % соответственно. При Siewert 2 наиболее высокие показатели 1- и 5-летней выживаемости зарегистрированы после ТТ операций — 82,0 % и 32,0 % соответственно, тогда как 3-летней выживаемости после ГЭ — 41,6 %. При КЭР Siewert 3 лучшие показатели 1-, 3- и 5-летней выживаемости получены при ТТ операциях — 83,3,
66,6 и 66,6 % соответственно. При всех типах операций в целом был отмечен достаточно высокий уровень 5-летней выживаемости — 34,4 %. однако особенно следует отметить отдаленные результаты при ГЭ, выполненных по методике проф. М.З. Сигала, — 46,0 %.
Таким образом, при всех типах аденокарцином, поражающих зону кардиоэзофагеального перехода, наиболее радикальными являются трансторакальные вмешательства (операции по типу Гэрлока или Льюиса). Однако в исследовании не получено статистически значимых различий в отдаленных результатах лечения в зависимости от вида операций, соответственно. мы считаем возможным выполнение трансхиатальных вмешательств у больных с КЭР.
ЛИTЕРATУРA
1. Баймухамедов А.А. Оптимизация лечебной тактики при распространенном кардиоэзофагеальном раке: Дис. … д-ра мед. наук. М., 1999. 265 с.
2. давыдов М.И. Принципы хирургического лечения злокачественных опухолей в торакоабдоминальной клинике // Вопросы онкологии. 2002. Т. 48, № 4-5. С. 468-479.
3. Тер-Ованесов М.д., давыдов М.И., Леснидзе Э.Э. Индекс лимфогенного метастазирования (ИЛМ) как прогностический фактор хирургического лечения рака желудка, способный нивелировать феномен миграции стадии // Материалы V съезда онкологов стран СНГ. Ташкент, 2008. С. 36.
4. Тер-Ованесов М.д. Факторы прогноза хирургического лечения рака проксимального отдела желудка: Aвтореф. дис. … д-ра мед. наук. М., 2007. 54 с.
5. Maruyama K., Sasako M., Kinoshita T. Can sentinel node biopsy indicate rational extent of lymphadenectomy in gastric cancer surgery? Fundamental and new information on lymph node dissection // Langenbecks Areh. Surg. 1999. -Vol. 38 (4). P. 149-157.
6. Saha S., Dehn T.C. Ratio of invaded to removed lymph nodes as a prognostic factor in adenocarcinoma of the distal esophagus and esophagogastric junction // Dis. Esophagus. 2001. Vol. 14 (1). P. 32-36.
7. Siewert J.R. Classification of the adenocarcinoma of the oesoph-agogastric junction // Br. J. Surg. 1998. № 85. P. 1457-1459.
Поступила 22.12.10
cyberleninka.ru
