Лечение рака нижнеампулярного отдела прямой кишки: современное состояние проблемы — Онкология. Журнал им. П.А. Герцена — 2015-01
Ежегодно в России выявляется около 26,3 тыс. новых случаев заболевания раком прямой кишки, при этом смертность составляет 16,8 тыс. ежегодно. В структуре заболеваемости злокачественными новообразованиями за 2012 г. колоректальный рак занимал 2-е место и составил 11,5%, при этом на долю рака ободочной кишки пришлось 6,4% и рака прямой кишки — 5%. Соответственно заболеваемости растет и показатель смертности, который в 2012 г. составил 5,9% и занял 5-е место в структуре смертности от злокачественных новообразований [1].
Несмотря на совершенствование хирургической техники и прогресс комбинированных методов лечения, остается много спорных и нерешенных вопросов, одним из которых является лечение рака нижнеампулярного отдела прямой кишки.
Широкое внедрение и популяризация тотальной мезоректумэктомии (ТМЕ) позволило значительно снизить частоту местных рецидивов рака прямой кишки и увеличить продолжительность жизни пациентов [2, 3]. Однако это оказалось верным только для так называемых высоких раков, когда опухоли локализовались в верхне- и среднеампулярном отделах прямой кишки [2, 4]. Результаты же лечения рака дистальных отделов прямой кишки по-прежнему оставались малоудовлетворительными, о чем свидетельствовало большинство исследований [5—7]. В 2005 г. были опубликованы данные проспективного исследования, проведенного в Норвегии, целью которого было оценить результаты внедрения методики ТМЕ при раке прямой кишки. Частота местных рецидивов в группе дистальных раков составила 18,0%, в то время как при локализации опухоли выше 6 см от ануса — 5,0%. Кумулятивная 5-летняя выживаемость составила 59,0 и 78,0% соответственно [8].
Только одно низкое расположение опухоли в прямой кишке рассматривается некоторыми исследователями как независимый фактор, влияющий на риск развития местного рецидива [9].
Сегодня хирургическое лечение низкого рака прямой кишки развивается в двух направлениях. Это органосохранное лечение, подразумевающее сфинктеросохраняющие операции и полное удаление органа вместе со сфинктерным аппаратом — брюшно-промежностная экстирпация прямой кишки (БПЭ), в стандартном или расширенном варианте.
Необходимо отметить, что огромный вклад в развитие сфинктеросохраняющих операций внесли исследования, посвященные изучению дистального распространения рака прямой кишки.
В конце 1940—50-х годов появились первые пилотные исследования, в которых рассматривался вопрос дистального края резекции. Было показано, что опухоль не распространяется дальше 2 см от визуализируемого макроскопического края опухоли [10, 11]. Однако общепринятым безопасным отступом продолжали считать 5 см от дистального края опухоли. Этому способствовало исследование J. Goligher и С. Dukes, опубликованное в 1951 г., проведенное на 1500 патоморфологических послеоперационных препаратах у больных раком прямой кишки [12]. Активные патоморфологические исследования дистального края резекции продолжались в 80-х годах прошлого века. Так, N. Williams и соавт. [13] показали, что распространение опухоли в дистальном направлении более чем на 1 см от макроскопически визуализируемого края опухоли наблюдается лишь в 10% случаев.
До конца 90-х дистальный отступ от края опухоли оставался равным не менее 2 см [14]. В 2000-х годах началась дискуссия о возможности дальнейшего уменьшения дистального края резекции до 1 см, что позволяло даже при низкой локализации опухоли выполнять сфинктеросохраняющие операции без ухудшения онкологических результатов [15, 16].
По мнению ряда зарубежных исследователей, при локализации опухоли ниже 5 см от края анального канала оправдано выполнение сфинктеросохраняющих операций с хорошими онкологическими и функциональными результатами [17, 18]. Среди факторов, снижающих функциональные и непосредственные результаты интерсфинктерных резекций, авторы выделяют предоперационную лучевую терапию и преклонный возраст пациентов [19].
В 2013 г. E. Rullier и соавт. [20] представили результаты лечения 404 пациентов с низким раком прямой кишки. Авторы предложили свою, оригинальную классификацию опухолей нижнеампулярного отдела прямой кишки. Все опухоли располагались на расстоянии ниже 6 см от края анального канала. В 1-ю группу вошли 135 пациентов, у которых опухоль локализовалась в 1 см от зубчатой линии — всем был сформирован колоанальный анастомоз. Во 2-й группе опухоль локализовалась на 1 см ниже зубчатой линии — была выполнена парциальная интерсфинктерная резекция прямой кишки. В 3-ю группу включили пациентов с интраанальными опухолями (вовлечение внутреннего сфинктера) — всем была выполнена тотальная интерсфинктерная резекция. В 4-й группе всем пациентам была выполнена БПЭ прямой кишки. У всех пациентов этой группы было диагностировано вовлечение в опухолевый процесс наружного сфинктера. Исследователи не получили достоверных различий по частоте местного рецидива (5, 9 и 6%), не было получено различий по частоте отдаленного метастазирования (23—23%), а также безрецидивной 5-летней выживаемости (70, 73, 68%) между 1-й группой и 2-й и 3-й группами. Прогностически значимыми факторами выживаемости стали стадия опухоли и R1-резекция, однако ни морфологический тип опухоли, ни вариант хирургического вмешательства не повлияли на выживаемость. Таким образом, у 79% пациентов сфинктеросохраняющие операции оказались оправданными и никак не ухудшали онкологические результаты. Однако в данном исследовании авторы никак не оценивали континенцию пациентов после сфинктеросохраняющих операций.
Хорошие онкологические и функциональные результаты были показаны K. Yamada и соавт. [21] после выполнения интерсфинктерных резекций у пациентов при ранних стадиях заболевания Т (1—2)N (0—1). Пятилетняя выживаемость составила 97%, безрецидивная — 86%, местный рецидив — 2,5%.
По данным O. Krand и соавт. [22], выход опухоли за пределы мышечного слоя Т3 снижает 5-летнюю выживаемость до 82% при R0-резекции. Однако не у всех исследователей получились столь обнадеживающие результаты. Так T. Tokoro и соавт. [23] показали на 30 пациентах с ультранизким раком прямой кишки без проведения неоадъювантного лечения, что интерсфинктерная резекция оправдана лишь при начальном раке нижнеампулярного отдела прямой кишки (Тis-Т2), при этом местный рецидив наблюдается в 5,2% случаев. При распространенности опухоли Т3 частота местного рецидива сразу возросла до 45,5% ( р=0,008). Общая и безрецидивная 5-летняя выживаемость составила 76,5 и 68,4% соответственно.
S. Martin и соавт. [24] указывают, что сфинктеросохраняющие оперативные вмешательства можно считать онкологически оправданными только при тщательном отборе пациентов, небольшом размере и распространенности опухолевого процесса. Аналогичного мнения придерживаются и другие исследователи. Z. Yang и соавт. [25] провели ретроспективное исследование, по результатам которого определили, что для сфинктеросохраняющих операций должен проводиться тщательный отбор пациентов, так как выполнение низкой передней резекции будет неоправданно при местно-распространенном раке прямой кишки вследствие значительного увеличения частоты местного рецидива.
До середины 80-х годов XX века в клинической практике использовали ручное выделение прямой кишки, при котором прямая кишка выделялась тупым путем. ТМЕ, предложенная R. Heald в 1982 г., стала новым этапом развития хирургического лечения рака прямой кишки [26]. Широкое использование прецизионного выделения прямой кишки в межфасциальном пространстве в 90-х годах привело к значительному улучшению результатов хирургического лечения рака прямой кишки, 5-летняя продолжительность жизни увеличилась с 40 до 68%, а местный рецидив снизился до 5—12% [2, 27].
Вместе с тем анализ непосредственных и отдаленных результатов лечения пациентов с локализацией опухолевого процесса в нижнеампулярном отделе прямой кишки показал, что даже при строгом соблюдении принципов ТМЕ результаты БПЭ значительно хуже по сравнению с передней резекцией прямой кишки [6, 28].
В чем же причина этих неудач? Среди неблагоприятных факторов прогноза, оказывающих негативное влияние как на непосредственные, так и на отдаленные результаты лечения нижнеампулярного рака, авторами были отмечены следующие: местно-распространенная опухоль (Т4), положительный циркулярный край резекции (ЦКР), интраоперационная перфорация опухоли, нерадикальный характер самой операции (R1) [29, 30].
R. Marr и соавт. [8] опубликовали результаты исследования, проведенного в Великобритании, где отметили увеличение частоты местного рецидива и ухудшения общей выживаемости в группе пациентов с БПЭ по сравнению с пациентами, перенесшими переднюю резекцию — 36,5% против 22,3% и 52,3% против 65,8% соответственно. Причиной тому явилось большая частота положительного ЦКР в группе БПЭ — 41 и 12% соответственно.
Следует отметить, что ЦКР — понятие относительно новое, вошедшее в практику одновременно с внедрением методики ТМЕ. Под ЦКР подразумевают хирургически мобилизованную неперитонизированную поверхность мезоректума. Минимальное расстояние от края опухоли на участке ее максимальной инвазии в мезоректальную клетчатку до латерального края резекции составляет так называемый хирургический клиренс. Его величина, наравне с наличием или отсутствием опухоли в ЦКР, является важным показателем качества мезоректумэктомии, прогностическим фактором местного рецидива, отдаленного метастазирования и продолжительности жизни.
ЦКР считается положительным (ЦКР+) при непосредственном прорастании опухоли в собственную фасцию прямой кишки (при так называемом нулевом клиренсе) и в случаях близкого расположения элементов опухоли от мезоректальной фасции (1 мм и менее). При этом необходимо учитывать, что точкой отсчета минимального клиренса (≤1 мм) является не только край опухоли, но и опухолевые депозиты в мезоректальной клетчатке, опухолевые эмболы в сосудах и метастазы в лимфатических узлах [31].
В настоящее время определение статуса ЦКР наряду с исследованием проксимального и дистального краев резекции является основным показателем радикальности проведенного оперативного вмешательства.
M. Gosens и соавт. [32] по результатам лечения 201 пациента показали, что местный рецидив при отрицательном ЦКР развивается в 8%, при положительном ЦКР — в 37% случаев. В Норвежском исследовании (686 пациентов) местный рецидив при положительном ЦКР развился в 22%, при отрицательном крае резекции — в 5% случаев [33].
I. Nagtegaal и соавт. [34] в том же 2005 г., подводя итоги большого рандомизированного Голландского исследования (Dutch TME trial), продемонстрировали значительное различие выживаемости между группами БПЭ и передней резекции (38,5 и 57,6%). При низком ректальном раке чаще определяли положительный ЦКР — 26,5%, чем при более высоких локализациях — 12,6%. Значительно чаще положительный край резекции встречался в группе БПЭ — 30,4%, чем при передних резекциях — 10,7%. Кроме того, чаще при низком ректальном раке наблюдали перфорацию опухоли во время мобилизации — 13,7% по сравнению с опухолями средне- и верхнеампулярного отделов — 2,5%.
По мнению ряда исследователей, такое различие результатов может быть обусловлено как анатомическими, так и хирургическими причинами, связанными с выполнением стандартной БПЭ прямой кишки [35]. В дистальных отделах прямой кишки толщина мезоректальной клетчатки значительно уменьшается и практически исчезает на уровне верхнего края сфинктерного аппарата. Ниже этого уровня мышцы сфинктера прямой кишки и образуют ЦКР [31]. Таким образом, опухоли нижнеампулярного отдела прямой кишки будут иметь значительно меньшую величину хирургического клиренса, чем вышележащие новообразования, окруженные слоем мезоректальной клетчатки. Этот факт был подтвержден морфометрическими исследованиями R. Marr и соавт. [8], показавшими, что толщина тканей вокруг опухоли при стандартной БПЭ значительно сокращается по сравнению с передней резекцией прямой кишки.
Другим неблагоприятным фактором, влияющим на результаты лечения, являются трудности мобилизации абдоминальным доступом при глубоко расположенных опухолях, что увеличивает частоту интраоперационных перфораций [36]. Следует отметить, что при выполнении промежностного этапа при БПЭ в стандартном объеме также высока вероятность перфорации опухоли, вследствие малого объема резекции леваторов и незначительной величины хирургического клиренса.
В 2007 г. группой исследователей из Стокгольма под руководством профессора T. Holm была предложена и описана методика модифицированной БПЭ прямой кишки. Техника операции заключалась в мобилизации прямой кишки в пределах мезоректальной фасции до уровня начала m. levator ani. После формирования одноствольной колостомы первый этап операции заканчивали и брюшную полость зашивали. После переворота пациента на живот в положение «сложенного перочинного ножа» выполняли второй этап операции: широкое рассечение промежности, включающее в себя сфинктер прямой кишки, и широкое пересечение леваторов в точке, близкой к их фиксации к боковой поверхности таза. Это место должно соответствовать уровню, где была прекращена мобилизация прямой кишки со стороны брюшной полости. При этом может быть удален копчик для улучшения визуализации и облегчения мобилизации препарата. Операция получила название цилиндрической или экстралеваторной БПЭ (ЦБПЭ) прямой кишки.
Методика цилиндрического удаления тканей позволила авторам снизить частоту положительного ЦКР с 40,6 до 14,8% и частоту интраоперационных перфораций с 22,8 до 3,7% [37, 38].
H. Jiang и соавт. [39] провели метаанализ, в котором анализировалось одно рандомизированное контролируемое и пять нерандомизированных исследований, включающих 656 пациентов, из них 346 была выполнена ЦБПЭ, 310 стандартная БПЭ. Было показано снижение уровня положительного края резекции и местного рецидива при ЦБПЭ по сравнению со стандартной БПЭ. По частоте интраоперационной перфорации и послеоперационных осложнений различий отмечено не было [39]. Схожие результаты получили H. Yu и соавт. [4], представляя ЦБПЭ как более эффективное оперативное вмешательство по сравнению со стандартной БПЭ [4].
Однако далеко не все специалисты получили такие обнадеживающие результаты. Так, C. Anderin и соавт. [40] при выполнении данного оперативного вмешательства с пластикой большой ягодичной мышцей столкнулись с большой частотой послеоперационных осложнений — 41,5%.
S. Stelzner и соавт. [41] сравнивали результаты 46 стандартных БПЭ и 28 ЦБПЭ. Интраоперационная перфорация была ниже при ЦБПЭ — 0% против 15,2% при стандартной БПЭ (р=0,04), положительный край резекции составил 0% при ЦБПЭ и 4,9% при стандартной методике (р=0,511). Послеоперационные абсцессы промежностной раны при стандартной БПЭ встречались чаще — 17,4% против 10,7% при ЦБПЭ (р=0,518). Авторы показали значение ЦБПЭ как способа, позволяющего контролировать местный рецидив и оказывать влияние на выживаемость.
В 2011 г. S. Stelzner и соавт. [42] провели систематический анализ результатов лечения 1097 пациентов, которым выполнили расширенную БПЭ и сравнили с результатами 4147 пациентов, оперированных по стандартной методике. Частота интраоперационных перфораций и положительного края резекции при расширенной и стандартной БПЭ была 4,1% против 10,4% (относительное снижение риска на 60,6%, p=0,004) и 9,6% против 15,4% (относительное снижение риска на 37,7%, p=0,022). Местный рецидив наблюдался у 6,6% пациентов после расширенной БПЭ и у 11,9% после БПЭ (р<0,0001). Авторы делали вывод о лучших результатах после расширенных БПЭ.
T. Welsch и соавт. [38] в ретроспективном исследовании, анализируя 30 расширенных БПЭ, показали, что данное оперативное вмешательство позволяет контролировать местный рецидив (0% местного рецидива при медиане выживаемости 28,3 мес), однако не влияет на отдаленное метастазирование (8 пациентов). Послеоперационные осложнения промежностной раны были отмечены у 46,6% пациентов и отмечались стойкие нарушения мочеполовой функции. Качество жизни не отличалось от качества жизни после стандартной БПЭ.
Однако, несмотря на определенные успехи, достигнутые в лечении низкого рака прямой кишки, после ЦБПЭ появились требующие разрешения вопросы, связанные с расширением объема хирургического вмешательства: замещение дефекта промежностной раны, послеоперационные осложнения промежностной раны, мочеполовые расстройства, хронический болевой синдром в области промежности [37].
Необходимо отметить, что определенного стандарта в объеме удаляемых тканей при экстралеваторной БПЭ прямой кишки нет, достаточно много вариантов выполнения промежностного этапа этой операции [43]. Особый интерес представляет новая концепция экстралеваторной БПЭ, предложенная основоположником операции T. Holm в 2014 г. Автор выделяет три типа БПЭ: интерсфинктерную БПЭ, экстралеваторную БПЭ и исхиоанальную БПЭ. Интерсфинктерная БПЭ выполняется в случае невозможности выполнения реконструкции, наличия жалоб на недержание до лечения, высокого риска несостоятельности анастомоза, предпочтение пациента. Со стороны брюшной полости выполняется ТМЕ до тазового дна, далее мобилизация продолжается, пересекается на уровне пубо-ректальной связки, кишка может быть прошита сшивающим аппаратом, со стороны промежности выполняется диссекция в плоскости межу наружным и внутренним сфинктерами до уровня пубо-ректальной связки. После удаления препарата оставшийся анальный канал наглухо ушивается. Экстралеваторная БПЭ выполняется в случае дистальной границы опухоли менее 1 см от зубчатой линии (распространенность Т2—Т4), а также в случае высокого риска положительного ЦКР. Со стороны брюшной полости производится мобилизация прямой кишки до уровня шейки матки у женщин или семенных пузырьков у мужчин, далее начинается промежностный этап в положении «перочинного» ножа. Выполняется удаление мышц леваторов до боковых стенок таза (внутренних запирательных мышц). Исхиоанальная БПЭ выполняется при местно-распространенном опухолевом процессе, распространяющемся на мышцы леваторов, исхиоанальную клетчатку, перианальную кожу, и наличии специфических свищей. Данное оперативное вмешательство отличается от экстралеваторной БПЭ тем, что результатом операции становится удаление исхиоанальной клетчатки [35].
Более 100 лет лучевой метод лечения используется в лечении онкологических заболеваний. Как самостоятельный метод лечения аденогенного рака прямой кишки в настоящее время не применяется. В то же время пред- и/или послеоперационная лучевая/химиолучевая терапия как один из компонентов комбинированного лечения входит в различные стандарты лечения рака прямой кишки. Единого мнения по поводу использования неоадъювантной и адъювантной лучевой/химиолучевой терапии нет. Целью неоадъювантного лечения являются уменьшение размера первичной опухоли, обеспечение наилучшего местного контроля, повышение общей выживаемости.
Необходимо отметить, что единого стандарта в проведении лучевой/химиолучевой терапии на сегодняшний день нет. Среди большого числа методик и схем радиотерапевтического лечения можно выделить три основных: 1) крупнофракционное предоперационное облучение (РОД 5 Г.в течение 5 дней до СОД 25 Гр) часто используемое в скандинавских странах и некоторых крупных российских центрах; 2) предоперационная химиолучевая/лучевая терапия по схеме динамического или классического фракционирования в течение 4—5 нед до СОД 40—50 Г.используется в России и Европе; 3) послеоперационная лучевая терапия до СОД 40—50 Г.в режиме классического фракционирования часто использовалась в Северной Америке. В странах Северной Америки, в частности США, с 1990 г. Национальный институт рака рекомендует проведение послеоперационной химиолучевой терапии при II—III стадии.
Остановимся на 4 самых крупных рандомизированных исследованиях, проведенных в США, в которых рассматривался вопрос о проведении послеоперационной химиотерапии и лучевой/химиолучевой терапии у пациентов с резектабельным раком прямой кишки, показавших улучшение отдаленных результатов [44—47]. В 80-х годах XX века было проведено 2 крупных исследования, в которых применялась послеоперационная лучевая/химиолучевая терапия: исследование Gastrointestinal Study Group (GITSG) и исследование North Central Cancer Treatment Group (NCCTG). В исследовании GITSG в группе больных, получивших послеоперационную лучевую/химиолучевую терапию, было получено достоверное снижение частоты местных рецидивов и улучшение общей 5-летней выживаемости по сравнению с группой хирургического контроля (24%, 46% и 11%, 59% соответственно, р<0,05) [45]. В исследовании NCCTG сочетание адъювантной химиотерапии с послеоперационной лучевой терапией способствовало снижению частоты рецидивов с 25 до 14% (р<0,05), отдаленных метастазов с 46 до 29% (р<0,05) и улучшению 5-летней выживаемости с 47 до 58% (р<0,05) по сравнению с только послеоперационной лучевой терапией [46]. В исследовании NSABP протокол R0—1 и протокол R0—2 было показано, что основным фактором, влияющим на 5-летнюю выживаемость, является химиотерапия [44, 47]. Основными выводами этих 4 исследований стали — адъювантная лучевая терапия малого таза снижает частоту местного рецидива, значимо не влияя на общую и безрецидивную продолжительность жизни, в то время как адъювантная химиотерапия с использованием 5-ФУ улучшает специфическую и общую выживаемость.
Проведены исследования, сравнивающие неоадъювантную и адъювантную лучевую терапию. Так, L. Pahlman и соавт. [48] сравнивали интенсивное крупнофракционное облучение СОД 25 Гр (236 пациентов) с послеоперационным облучением СОД 60 Гр (235 пациентов). В группе после предоперационного облучения отмечено статистически значимое снижение частоты местных рецидивов по сравнению с послеоперационным облучением (12 и 21% соответственно) в сроки наблюдения с медианой 6,3 года, при этом разницы в показателях выживаемости выявлено не было.
К схожим выводам приходят и норвежские исследователи, которые проанализировали результаты лечения 4113 пациентов. В исследование были включены 50 центров Норвегии, всем пациентам были выполнены радикальные оперативные вмешательства с использованием техники ТМЕ. У 514 пациентов было проведено комбинированное лечение или с предоперационной лучевой терапии до СОД 50 Гр, или с послеоперационной лучевой терапией до СОД 50 Гр. Многофакторный анализ показал достоверное снижение местного рецидива после комбинированного лечения с использованием предоперационного облучения — 10,6% против 15,8%. Авторами было показано, что послеоперационная лучевая терапия не влияет на частоту местных рецидивов [49].
R. Sauer и соавт. [50] на III стадии рандомизированного многоцентрового исследования (protocol CAO/ARO/AIO-94) в сравнительном анализе предоперационной и послеоперационной химиолучевой терапии (ХЛТ) показали на 628 пациентах (послеоперационная ХЛТ у 310 больных, предоперационная ХЛТ у 318 больных), что неоадъювантная предоперационная лучевая терапия не увеличивает общую частоту послеоперационных осложнений (13% при предоперационной ХЛТ против 12% при послеоперационной ХЛТ). Несостоятельность анастомоза составила 3% при предоперационной ХЛТ и 4% при послеоперационной ХЛТ, вялое заживление послеоперационной раны отмечено в 5% случаев с использованием предоперационной ХЛТ и 6% с применением послеоперационной ХЛТ.
Несмотря на большое количество рандомизированных и моноцентровых исследований, сравнивавших непосредственные и отдаленные результаты хирургического и комбинированного лечения больных раком прямой кишки, окончательного единого мнения о варианте лечения в настоящее время нет.
Отношение к лучевой терапии при резектабельном раке прямой кишки остается весьма противоречивым. Ряд авторов, среди которых R. Heald, A. Wibe, считают, что при всех стадиях рака прямой кишки предпочтительно хирургическое лечение, а показанием для лучевой терапии являются только нерезектабельные формы опухоли [28].
По данным O. Visser и соавт. [51] применение лучевой терапии необходимо у всех больных раком прямой кишки независимо от стадии. E. Kapiteijn и соавт. [52] показали, что проведение предоперационной химиолучевой терапии и хирургического лечения с ТМЕ значимо снижает частоту местного рецидива.
Существует и третья точка зрения, согласно которой необходимо разумное сочетание применения хирургического, лучевого и лекарственного лечения [53, 54].
Голландское рандомизированное мультицентровое исследование: 1861 пациент, II—III стадия заболевания, сравнивали две группы пациентов. В 1-й группе провели неоадъювантную лучевую терапию 5×5 Г.до СОД 25 Гр + хирургическое лечение с использованием техники ТМЕ. Во 2-й группе — только хирургическое лечение с использованием техники ТМЕ. Было получено достоверное снижение местных рецидивов (5,6% против 10,9%, р<0,001) и не получено достоверных различий в 5-летней выживаемости — 64,2 и 63,5% соответственно (р=0,902) [55]. В 2011 г. были опубликованы 12-летние результаты Голландского исследования. Местный рецидив при комбинированном лечении отмечен в 5% случаев, при только хирургическом в 11% (p<0,0001). Десятилетняя выживаемость в группе комбинированного лечения составила 50% против 40% в группе хирургического лечения (р=0,032) [56]. Полученные отдаленные результаты полностью подтвердили эффективность концепции комбинированного лечения с предоперационной лучевой терапией.
В сравнительном анализе исследований EORTC 22921 и FFCD 9203 при раке прямой кишки рТ3—4 были показаны преимущества предоперационной химиолучевой терапии с 5-ФУ/лейковарином.
В ЕОRTC включили 1011 пациентов (с адъювантом и без него), в FFCD — 1000 больных. Из них 881 проводили лучевую терапию, а 886 — химиолучевую терапию. Оценивали общую выживаемость, локальный контроль (время до возникновения рецидива), полный ответ (при плановом морфологическом исследовании — рТ0N0). Медиана выживаемости составила 5,6 года, у 230 — местный рецидив, у 540 — отдаленные метастазы, 607 — умерли.
Общая выживаемость, появление отдаленных метастазов, безрецидивная выживаемость не зависели от варианта лечения. Общая выживаемость составила 66,3% после химиолучевой терапии и 65,9% после лучевой терапии. ХЛТ была эффективнее при изучении частоты местного рецидива [57].
L. De Caluwe и соавт. [58] в своем метаанализе показали преимущества предоперационной ХЛТ перед только лучевой терапией (увеличение числа лечебного патоморфоза 3—4-й степени, снижение частоты местного рецидива). K. McCarthy и соавт. [59] в своем метаанализе показали, что при проведении предоперационной ХЛТ частота местного рецидива ниже, чем после предоперационной ХЛТ, однако различий в общей выживаемости получено не было.
Было отмечено, что при проведении предоперационной химиолучевой терапии при плановом морфологическом исследовании, несмотря на одинаковую дозу облучения и модификацию химиопрепаратов, лечебный патоморфоз 3—4-й степени и 1—2-й степени встречается одинаково часто. Это послужило толчком для проведения исследований по поиску предикторов эффективности лучевой терапии. Так, I. Zlobec и соавт. [60] провели исследование, в которое включили 104 пациента с резектабельным инвазивным раком прямой кишки (гистологически — аденокарцинома). Отбирали пациентов с опухолью Т2, Т3 и Т4 (размером от 3 до 5 см). Исключили пациентов с отдаленными метастазами, с метастазами в лимфатических узлах. Во всех случаях проводили предоперационную внутриполостную лучевую терапию высокой мощности 192Ir. На 88 удаленных препаратах авторы анализировали патоморфологический ответ после хирургического компонента лечения по наличию или отсутствию экспрессии VEGF (эндотелиальный фактор роста) и EGFR (рецептор эпидермального фактора роста). При отсутствии экспрессии VEGF и при наличии экспрессии EGFR была получена полная резорбция опухоли. Следовательно, данные иммуногистохимические факторы могут быть предикторами эффективности лучевого компонента комбинированного лечения. Положительный EGFR и отрицательный VEGF были выявлены в случаях полного отсутствия патоморфологического ответа. Полученные результаты позволяют предположить, что возможно есть группы пациентов, которым изучаемая методика предоперационного лечения не показана. Авторами были изучены непосредственные результаты лечения, однако не оценивались качество хирургического лечения и корреляция с отдаленными результатами (местный рецидив, общая выживаемость).
В наше исследование было включено 176 пациентов нижнеампулярным раком прямой кишки, которым в период с 2008 по 2014 г. проведено либо хирургическое, либо комбинированное лечение, набор пациентов продолжается. Хирургическое лечение выполнено в объеме низкой передней резекции прямой кишки, брюшно-анальной резекции, БПЭ в стандартном либо расширенном варианте. Комбинированное лечение: на первом этапе химиолучевая терапия СОД 47 Г.по схеме 5-ФУ внутривенно в течение 5 дней, далее ДЛТ по схеме динамического фракционирования, первые 3 дня РОД 4 Г.с внутривенным введением препаратов платины, далее РОД 1,25 2 раза в день. Через 6 нед после завершения ХЛТ проводили второй этап комбинированного лечения — хирургический. С 2010 г. мы начали выполнять экстралеваторную БПЭ прямой кишки. С учетом многих нерешенных вопросов в лечении рака нижнеампулярного отдела прямой кишки мы планируем определить место и показания для экстралеваторной БПЭ, роль предоперационной химиолучевой терапии, выявить возможные предикторы эффективности лучевой терапии, оценив качество выполнения ТМЕ и непосредственные результаты хирургического и комбинированного лечения.
Таким образом, анализ данных литературы показал, что результаты лечения нижнеампулярного рака по сравнению с другими отделами прямой кишки по-прежнему остаются наиболее неблагоприятными по частоте местного рецидива, продолжительности и качеству жизни. Подход к лечению этой локализации рака должен быть мультидисциплинарным, однако необходимо подчеркнуть, что без хирургического этапа сегодня обойтись нельзя. Хирургия рака прямой кишки не стоит на месте, и ее развитие идет по двум основным направлениям: сохранение функции без ухудшения онкологических результатов и все более расширенные хирургические вмешательства. Лучевая терапия как до операции, так и после операции при различных методиках и разных режимах фракционирования убедительно показала свою целесообразность. Особое внимание в настоящее время уделяется поискам и разработке предикторов эффективности предоперационной лучевой/химиолучевой терапии (иммуногистохимические, молекулярно-генетические). Несмотря на множество нерешенных вопросов в лечении нижнеампулярного рака прямой кишки целью всех исследователей является улучшение результатов лечения, поэтому в нашей работе мы будем пытаться приблизиться к достижению именно этой цели.
Конфликт интересов отсутствует.
как развивается, симптомы и выявление, лечение

Рак прямой кишки (РПК) составляет почти половину всех случаев новообразований кишечника, значительно опережая по частоте опухоли ободочной кишки. Заболевание коварно своей локализацией, так как прямая кишка замыкается мышечным сфинктером, поражение которого влечет необходимость проведения травматичных операций, нередко заканчивающихся нарушением естественного акта дефекации, что существенно усложняет привычный образ жизни пациента.
Опухоли прямой кишки распространены повсеместно, но чаще их диагностируют в странах Западной и центральной Европы, США и Великобритании. Жители Азии и Африки меньше подвержены раку в связи с особенностями питания, включающего большое количество растительных компонентов.
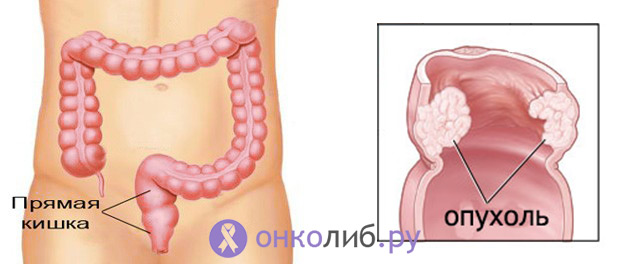
Средний возраст пациентов – 50-60 лет, то есть по мере приближения к старости риск опухоли возрастает. Считается, что мужчины и женщины в равной степени заболевают новообразованиями прямой кишки, но по некоторым данным, мужчин среди пациентов все-таки больше. Возможно обнаружение рака и у молодых лиц, у которых опухоль нередко протекает более агрессивно и с худшим прогнозом.
Прямая кишка, в отличие от других отделов желудочно-кишечного тракта, вполне доступна для осмотра, но число запущенных форм заболевания остается высоким. Поздняя диагностика становится причиной объемных и травматичных операций, но и они далеко не всегда оказываются эффективными. Прогноз по-прежнему серьезен, а с каждым годом число пациентов с такой опухолью только увеличивается, что делает проблему рака прямой кишки весьма актуальной.
Причины и разновидности рака прямой кишки
Уже ни для кого не секрет, что увеличение заболеваемости раком толстой кишки связано с особенностями образа жизни и питания современного человека. Особенно хорошо такая связь прослеживается у жителей крупных городов экономически развитых стран. Прямая кишка, являясь конечным отделом пищеварительной системы, испытывает на себе весь спектр негативного влияния канцерогенов и токсических веществ, которые не только поступают из вне с пищей или водой, но и образуются в ходе переваривания в самом кишечнике.

Среди причин, вызывающих РПК, наибольшее значение имеют:
- Характер питания, когда преобладают животные жиры, мясные продукты, полуфабрикаты, тогда как растительной клетчатки в рационе недостаточно;
- Изменения кишечника в виде хронического воспаления (колит, проктит), полипов, хронических анальных трещин, а также болезнь Крона и неспецифический язвенный колит, сопровождающиеся рецидивирующим повреждением слизистой с последующими рубцовыми изменениями;
- Запоры, вызывающие механическое повреждение внутреннего слоя кишки плотным содержимым и увеличивающие время контактирования слизистой с канцерогенными веществами;
- Употребление алкоголя, даже в небольших количествах, курение и малоподвижный образ жизни, часто сочетающийся с ожирением и обменными нарушениями;
- Наследственность.
Среди предопухолевых изменений особое значение придается полипам, которые считают облигатным предраком при их расположении в прямой кишке. Это значит, что любой полип этой локализации без своевременного удаления грозит перерасти в рак.
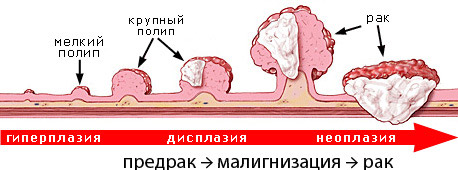
Как правило, пациенты, страдающие РПК, могут указать на наличие у себя сразу нескольких предрасполагающих факторов, среди которых главное место принадлежит питанию, гиподинамии и хроническим воспалительным изменениям.
Опухоль может располагаться в верхнем, среднем или нижнем отделах прямой кишки, от ее локализации будет зависеть характер лечения и прогноз.
Чем выше рак от анального канала и его сфинктеров, тем лучше исход и менее травматичное лечение ждет пациента при равных прочих условиях.
В зависимости от особенностей роста РПК может быть экзофитным, когда новообразование обращено внутрь органа, и эндофитным, растущим в толще стенки. Эндофитный рак вызывает значительное сужение просвета кишки и склонен изъязвляться.
С позиций гистологических особенностей, большинство злокачественных опухолей прямой кишки – аденокарциномы (железистые раки), однако встречаются и слизистые, недифференцированные, фиброзные опухоли, обладающие большей злокачественностью, а потому и худшим прогнозом.
Возникнув в слизистой оболочке, РПК постепенно захватывает все большую площадь, прорастая в мышечный и серозный слой органа, выходя в клетчатку малого таза, поражая матку и придатки, влагалище, мочевой пузырь у женщин, семенные пузырьки, простату, мочевыводящие пути у мужчин. Опухолевые клетки, попав в лимфатические и кровеносные сосуды, распространяются по ним и дают начало метастазам: лимфогенным в лимфоузлах, гематогенным – во внутренних органах. Гематогенные метастазы наиболее часто обнаруживаются в печени, собирающей от всех отделов кишечника кровь, поступающую туда по воротной вене для обезвреживания. Попадание раковых клеток на серозный покров кишки влечет за собой так называемое имплантационное метастазирование, когда опухоль распространяется по поверхности брюшины.
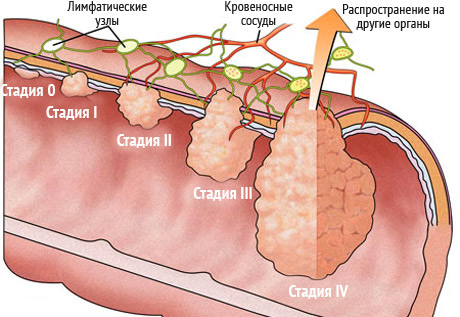
Стадии рака прямой кишки учитывают особенности самого новообразования, его размеры, врастание в окружающую ткань, а также характер метастазирования. Так, отечественные онкологи выделяют четыре клинических стадии течения опухоли:
- 1 стадия, когда опухоль не более двух сантиметров, врастает не глубже подслизистого слоя и не метастазирует.
- На 2 стадии новообразование до 5 см, не выходит за границы органа, но может проявляться метастазами в местных лимфоузлах.
- 3 стадия сопровождается прорастанием всех слоев кишечной стенки и появлением метастазов в местных лимфоузлах.
- 4 стадия характеризует большую неоплазию, внедряющуюся в окружающие ткани, клетчатку малого таза с лимфогенным и гематогенным метастазированием в лимфоузлы и внутренние органы.
Проявления и диагностика рака прямой кишки
Рак прямой кишки – распространенное заболевание, информации о котором много в интернете и соответствующей литературе. Рост количества пациентов заставляет проводить просветительскую работу среди населения, призывая к посещению врача. Начитавшись о симптомах болезни, лица с патологией кишечника нередко склонны преувеличивать свои жалобы и самостоятельно ставить себе диагноз опухоли. В иных случаях, особо впечатлительные больные и вовсе отказываются от осмотров врачей, считая себя обреченными умереть от рака. Такой подход в корне неправильный, ведь
подтвердить или опровергнуть факт наличия неоплазии может только специалист, а симптомы и злокачественного процесса, и других заболеваний часто похожи, что сбивает с толку людей, не обладающих достаточным количеством медицинских знаний.
Заподозрить колоректальный рак можно уже на ранней стадии по характерной симптоматике. Конечно, если пациент страдает геморроем, анальной трещиной или хроническим абсцессом в области прямой кишки, то отличить рак от этих заболеваний самостоятельно вряд ли получится, ведь некоторые проявления их схожи. В то же время, общность симптомов не должна приводит к панике и поиску у себя опасной болезни. Не всегда кровотечение, боль или выделение крови свидетельствуют именно о раке, ведь кровь может быть при геморрое, гной и слизь – при воспалительных процессах. Чтобы отличить эти заболевания, нужен осмотр проктолога, самостоятельно ставить себе диагноз опухоли нельзя.

Симптомы рака прямой кишки определяются стадией и уровнем расположения образования. Они включают:
- Различные диспепсические расстройства;
- Кровотечение и другие патологические примеси в кале;
- Нарушение стула вплоть до кишечной непроходимости;
- Признаки общей интоксикации;
- Анемию;
- Болевой синдром.
Первые симптомы зависят от расположения неоплазии. Помимо кровотечения, возникающего почти у всех больных, возможна боль как первый признак в случае низкого расположения рака с переходом на анальный сфинктер. В части случаев заболевание протекает с нарушениями стула, чаще – в виде запоров, которые могут быть расценены как проявления другой патологии (проктит, анальная трещина, геморрой).
Ранняя стадия опухоли может не давать специфической симптоматики, однако у 9 из 10 пациентов уже в этот период появляются признаки кровоточивости опухоли. Кровотечение – один из самых характерных симптомов колоректального рака. Массивного кровотечения обычно не случается, кровь выделяется небольшими порциями, смешана с калом или появляется раньше него.

Больные геморроем также обычно наблюдают кровотечение из прямой кишки, однако кровь при этом будет выделяться после дефекации, покрывая каловые массы снаружи, что может быть отличительным признаком этих заболеваний. Для того чтобы исключить рак, который может возникнуть и при наличии геморроя, необходим осмотр проктолога и дополнительные исследования, самодиагностика в таком случае невозможна.
Помимо крови, в каловых массах можно обнаружить слизь и гной, наличие которых отражает вторичное воспаление в опухоли и кишечнике (проктит, проктосигмоидит). Эти признаки при отсутствии анальных трещин и хронических абсцессов с большой долей вероятности указывают на злокачественный процесс.
Вторым по частоте после кровоточивости является синдром кишечных расстройств, на который указывает абсолютное большинство пациентов с любой стадией рака. Характерным является запор и невозможность полного опорожнения кишечника. Наличие опухоли дает ощущение инородного тела и ложные позывы к дефекации, подчас болезненные и мучительные. При попытке освободить кишечник, больной наблюдает выделение небольшого количества крови, слизи, гноя, при этом каловых масс может и не быть. Таких позывов случается до 15 в сутки.
По мере того, как увеличивается размер неоплазии, запор становится упорнее и длительнее, живот вздувается накопленным газом, появляется урчание, боль, которые носят поначалу периодический характер, но при прогрессировании рака становятся постоянными. При полном закрытии просвета кишки новообразованием, продвижение каловых масс останавливается – развивается кишечная непроходимость. Боль при непроходимости кишечника интенсивная, схваткообразная, сопровождается рвотой и полным отсутствием стула и отхождения газа.
Выраженность и время появления боли зависят от локализации опухоли. При нахождении ее в верхнем или среднем отделе, боль непостоянна и вызвана внедрением опухоли в окружающие ткани, тогда как при раке анального канала с вовлечением сфинктера боль возникает уже на ранней стадии болезни и может быть первым признаком неблагополучия. Характерно, что пациент, испытывающий боль по причине РПК, старается садиться на одну половину ягодицы – так называемый «симптом табуретки».
Поздние стадии болезни, когда опухоль поражает структуры малого таза, активно метастазирует, распадается и воспаляется, сопровождаются общей интоксикацией, потерей веса, слабостью, лихорадкой. Хронические кровопотери приводят к анемии.
При появлении подозрительных симптомов или каких-либо нарушений со стороны кишечника, нужно отправиться к врачу для выяснения диагноза. Прямая кишка доступна непосредственному осмотру и пальцевому исследованию, эти способы не требуют сложной аппаратуры и могут проводиться повсеместно, но частота запущенных форм рака продолжает оставаться высокой. Это связано не только с агрессивностью некоторых опухолей или неспецифичностью симптоматики на ранних стадиях, но и с нежеланием многих пациентов обращаться к врачу и проходить соответствующие исследования.

С целью диагностики рака специалист осмотрит прямую кишку, подробно расспросит о характере жалоб и назначит дополнительные исследования, в числе которых:
- Ректороманоскопия, во время которой возможен не только осмотр поверхности слизистой оболочки, но и забор подозрительных фрагментов для гистологического анализа;
- Рентгенологическое исследование (ирригография) с взвесью бария для контрастирования позволяет обнаружить наличие патологии не только в прямой кишке, но и в вышележащих отделах кишечника;
- УЗИ органов брюшной полости и малого таза необходимо для поиска метастазов и определения распространенности злокачественного процесса;
- КТ, МРТ – для поиска метастазов и определения характеристик самой опухоли;
- Лабораторные исследования – анализы крови, мочи, кала, в том числе на скрытую кровь;
- Лапароскопия и лапаротомия (последняя позволяет точно определить распространенность опухоли).
Среди лабораторных методов возможно проведение теста на рак толстой кишки, заключающегося в определении раково-эмбрионального антигена и маркера опухолей СА-19-9. Обычно при РПК эти показатели увеличиваются, однако, повышение их возможно и при некоторых других заболеваниях (неспецифический язвенный колит, например). Кроме того, раково-эмбриональный антиген часто повышен у активных курильщиков, что нужно учитывать при проведении анализа.
Самым точным способом узнать строение опухоли будет гистологическое исследование ее фрагментов. Гистологический тип (аденокарцинома, слизистый, недифференцированный рак) и степень дифференцировки определяют скорость роста, поведение новообразования и прогноз для больного.
Особенности лечения ректального рака
В отличие от других отделов пищеварительного тракта, прямая кишка имеет особенность строения в виде анального сфинктера, регулирующего процесс дефекации. Без адекватного функционирования этой мышечной структуры сложно представить себе нормальную жизнедеятельность, социальную и трудовую адаптацию. При операциях на прямой кишке особое значение придается возможности сохранения сфинктера или проведения реконструктивных операций, которые и предопределят дальнейший образ жизни пациента.
Выбор конкретного метода лечения и разновидности вмешательства определяется месторасположением опухоли относительно заднепроходного жома, глубиной врастания в стенку кишки и окружающие структуры, общег состояния пациента и стадии опухоли. Как правило, сочетают облучение, химиотерапию и операцию, но хирургическое удаление продолжает оставаться основным способом лечения рака кишечника.
Когда без операции не обойтись…
Удаление неоплазии – самый эффективный способ избавиться от образования, но, вместе с тем, и наиболее травматичный. Операции на прямой кишке отличаются сложностью проведения и требуют зачастую участия двух бригад хирургов одновременно. В ряде случаев возникает необходимость в последующей пластике, ведь жизнь с каловым свищом на передней брюшной стенке нельзя назвать легкой, в том числе, в психологическом для больного отношении.

Конечно, раннее обнаружение опухоли может помочь избежать объемных операций, однако низкое расположение опухоли – фактор, не зависящий от пациента, но определяющий суть оперативного лечения. Сегодня хирурги-проктологи стараются по возможности прибегать к менее травматичным вмешательствам, если это не происходит в ущерб радикальности. Существуют методики сохранения или воссоздания анального сфинктера, что значительно улучшает качество жизни больных в послеоперационном периоде.
При операциях на кишечнике, важную роль играет правильная подготовка, которая возможна только при плановых вмешательствах. Она включает в себя назначение слабительных средств (вазелиновое масло, магнезия внутрь), соблюдение щадящей диеты. Используемые повсеместно очистительные клизмы все чаще уступают место лаважу кишечника специальным раствором, который может быть принят внутрь или введен через 12-перстную кишку. Лаваж-раствор (фортран) назначается в количестве 3 литров за 18-20 часов до планируемой операции.
Если опухоль сопровождается воспалительным процессом, то обязательно назначаются антибиотики, возможно – в ударной дозе перед операцией для профилактики инфекционных осложнений.
Вид вмешательства определяется, в первую очередь, близостью опухоли к анальному сфинктеру. Анализ результатов проводимых операций показал, что для соблюдения основ радикализма достаточно отступить на 2-5 см от нижнего полюса неоплазии и на12 см от верхнего. В зависимости от того, попадает ли в зону удаляемых тканей сфинктер, будет выбрана конкретная хирургическая методика. Понятно, что наибольшие трудности будут возникать при опухолях нижнего отдела прямой кишки, но в каждом конкретном случае хирург постарается сохранить пациенту сфинктер с возможностью хорошей социальной адаптацией в будущем.
Хирургическое лечение нижнеампулярного рака прямой кишки
Еще недавно основным и единственно возможным способом лечения рака, расположенного в нижнем отделе прямой кишки, считалась брюшно–промежностная экстирпация (БПЭ). Операция состоит в иссечении всей прямой кишки вместе с мышечным сфинктером, клетчаткой малого таза и лимфатическим аппаратом. Вмешательство проводится в два этапа: сначала выводят сигмовидную кишку на переднюю стенку живота, формируя колостому для отвода каловых масс, а затем из области промежности удаляют прямую кишку и клетчатку малого таза (промежностный этап). При участии двух бригад хирургов эти этапы осуществляются одновременно.

Показаниями для БПЭ считаются рак, находящийся ближе 6-7 см от заднепроходного отверстия, неоплазии, прорастающие соседние ткани и метастазирующие в местные лимфоузлы, а также запущенные случаи заболевания, осложненные кишечной непроходимостью.
Возможности восстановления непрерывности кишечника после БПЭ уже нет, а больной вынужден жить с противоестественным задним проходом в области живота или промежности. Послеоперационная реабилитация сложна, а приспособиться к привычному укладу жизни и, тем более, трудовой деятельности получается далеко не у всех пациентов. В связи с этим, хирурги по возможности прибегают к более щадящим методам лечения, если они не противоречат радикальности.
Несколько улучшить качество жизни пациентов после радикального вмешательства позволяет создание промежностной колостомы и искусственного прямокишечного сфинктера. После брюшно-промежностной экстирпации в этом случае на область промежности подводится сохраненный конец толстой кишки и при помощи гладкомышечной ткани формируется искусственный сфинктер. Помимо этого, возможно создание дополнительного резервуара из толстой кишки в полости малого таза. Такие модификации радикального лечения предпочтительны для пациентов молодого возраста, желающих сохранить активный образ жизни и возможность трудовой деятельности. Условиями их проведения считают отсутствие метастазирования, прорастания тазовой клетчатки, а новообразование должно занимать не больше 1/2 окружности прямой кишки.
У мужчин при распространенных вариантах колоректального рака, когда в зону поражения входят мочевой пузырь, простата и семенные пузырьки, единственно возможным становится проведение эвисцерации малого таза с удалением всех пораженных структур, клетчатки и лимфоузлов. Операция чрезвычайно травматична и требует не только создания противоестественного заднего прохода, но и возможности отведения мочи в условиях отсутствия мочевого пузыря.
Сфинктеросохраняющие операции
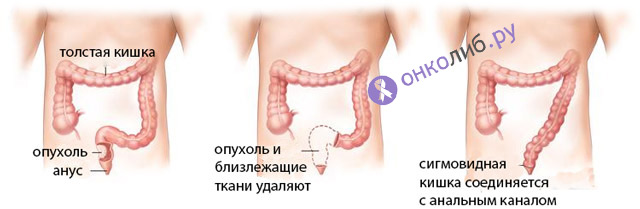
пример сфинктеросохраняющей операции
- Секторальная резекция прямой кишки и анального сфинктера, когда иссекается участок жома и стенки органа с восстановлением непрерывности кишечника. Условием для ее проведения считается распространенность опухоли не более чем на треть окружности кишки с врастанием ее во внутренний мышечный жом.
- Трансанальная резекция состоит в иссечении фрагмента кишки и выполнима она в случае инвазии опухоли не глубже подслизистого слоя. После иссечения пораженной ткани восстанавливается соединение между прямой кишкой и анальным жомом.
- Брюшно-анальная резекция показана при новообразованиях, расположенных выше 5-6 см от ануса и занимающих не более 1/2 окружности прямой кишки. После иссечения пораженной кишки верхний конец толстого кишечника подводится к сохраненным сфинктерам, и формируется соединение, обеспечивающее движение кала к заднепроходному отверстию. В некоторых случаях проводится брюшно-анальная резекция с иссечением внутреннего сфинктера, который воссоздается из мышечного слоя толстого кишечника.
Операции при опухолях среднеампулярного и верхнего отделов
отделы и анатомия прямой кишки
Расположение неоплазии на относительном удалении от анального сфинктера позволяет удалить ее без нарушения непрерывности кишечника и с сохранением естественного акта дефекации. Возможно проведение брюшно-анальной резекции с подведением сигмовидной кишки к области ануса. При высоко растущих неоплазиях показана передняя резекция, когда удаляется пораженный фрагмент органа, а концы сшиваются между собой с восстановлением проходимости кишечника. Наложение швов на кишечную стенку можно произвести с помощью специальных сшивающих аппаратов, что значительно облегчает и ускоряет проведение операции.
Если опухоль осложнилась кишечной непроходимостью, то резекцию провести будет невозможно, и тогда методом выбора становится операция Гартмана, когда после извлечения опухоли прямая кишка зашивается, а на переднюю стенку живота выводится колостома для отвода каловых масс. Впоследствии восстановить непрерывность кишечника можно, но следует учитывать определенные трудности по причине уменьшения размеров оставшейся прямой кишки и развития спаек в полости таза.
Поскольку риск инфицирования, послеоперационных осложнений и прогрессирования опухоли при вмешательствах на кишечнике довольно велик, то разработаны основные принципы хирургической техники у таких пациентов:
- Введение антибиотиков накануне планируемой операции;
- Ранняя перевязка сосудов, питающих кишечную стенку, строгое отграничение рассекаемых тканей друг от друга с помощью салфеток;
- Промывание тазовой полости и операционной раны антисептическими растворами;
- Тщательная перевязка сосудов, замена белья и перчаток при переходе от одного этапа операции к следующему.
Паллиативная помощь
К сожалению, нередко рак прямой кишки выявляется на той стадии, когда радикальное лечение уже невозможно, а помочь больному могут только паллиативные операции, направленные на уменьшение болевого синдрома, ликвидацию кишечной непроходимости и других осложнений опухоли.

К паллиативным относят вмешательства по созданию калового свища (колостомы) на передней стенке живота путем выведения сигмовидной кишки с ушиванием прямой либо формирования двуствольной колостомы за счет рассечения и фиксации кишечника к брюшной стенке. Выведение кишечного содержимого через такое искусственно созданное отверстие ликвидирует кишечную непроходимость, уменьшает болезненные ощущения и помогает несколько облегчить общее состояние пациента.
Особенности образа жизни после операции на прямой кишке зависят от характера вмешательства. Если хирургу удастся сохранить анальный сфинктер без ущерба радикальности, то от пациента потребуется соблюдение диеты и регулярное посещение онколога. В случаях, когда врач вынужден идти на создание противоестественного заднего прохода, пациент обречен на сложности в дальнейшей реабилитации. Такие больные должны будут тщательно следить за состоянием колостомы, должное внимание уделяя гигиеническим процедурам и соблюдению диеты. Трудовая деятельность нередко затруднена и даже невозможна. После операций на прямой кишке в ряде случаев больным присваивается инвалидность.
Облучение и химиотерапия
Облучение и химиотерапия обычно не применяются в самостоятельном виде при раке дистальных отделов кишечника, но входят в состав комбинированной терапии опухоли.
Облучение возможно как до операции, так и после нее. До операции лучевая терапия преследует цель уменьшения массы опухолевой ткани и назначается в суммарной дозе 20 Гр на протяжении пяти суток. Спустя несколько дней проводится операция. Такой короткий промежуток времени между облучением и удалением неоплазии связан с возможным развитием лучевых повреждений в месте роста рака, что может стать причиной перфорации кишки.
Если при исследовании удаленных лимфатических узлов было подтверждено поражение их метастатическим процессом, то пациенту дополнительно проведут послеоперационную лучевую терапию в количестве 40 Гр на область удаленных лимфоузлов и зону роста опухоли. Облучение после операции помогает избежать рецидива рака и его дальнейшего распространения по лимфатическим и кровеносным сосудам.

Химиотерапия используется после хирургического этапа либо как вариант паллиативной помощи. Для пациентов с раком прямой кишки разработаны схемы полихимиотерапии, включающие 5-фторурацил, фторафур, адриамицин, элоксатин как наиболее эффективные. Такая адъювантная химиотерапия направлена на удаление оставшихся злокачественных клеток в месте хирургического вмешательства и препятствие метастазированию. Если химиотерапия назначается при неоперабельных формах заболевания, то целью ее становится уменьшение размеров опухоли и, соответственно, болевого синдрома, облегчение пассажа кишечного содержимого, а также борьба с метастазами.
На всех этапах лечения больные нуждаются в поддерживающей и симптоматической терапии, внутривенных инфузиях жидкости, питательных и солевых растворов. Адекватное обезболивание – важнейший компонент как во время хирургического лечения, так и при оказании паллиативной помощи. Больные раком кишечника нуждаются в постоянном контроле показателей электролитного обмена и своевременной коррекции нарушений, которые часто сопутствуют этому заболеванию. В качестве средства, нормализующего электролитный баланс, может быть использован гидрокарбонат натрия (сода), но это не означает, что нужно следовать рецептам из интернета и употреблять соду внутрь самостоятельно или даже вводить в прямую кишку. Такие эксперименты чреваты серьезными осложнениями и даже смертельным исходом, поэтому регулировать тонкие метаболические процессы должен врач с учетом анализов.
Прогноз при раке прямой кишки всегда очень серьезен. При отсутствии метастазирования пять и более лет проживают до 70% пациентов, но наличие вторичных опухолевых поражений снижает этот показатель до 40%. Понятно, что чем более выражен опухолевый процесс и запущенней стадия болезни, тем хуже и прогноз. У молодых пациентов, чаще страдающих агрессивными разновидностями рака прямой кишки, особенно, при поражении анального сфинктера, не всегда возможно добиться удовлетворительных результатов терапии.
Профилактика рака прямой кишки состоит в регулярном посещении проктолога всеми лицами, страдающими какими-либо поражениями кишечника (полипы, воспаление, анальные трещины). Осмотр у специалиста должен проводиться ежегодно или чаще при наличии показаний. Всем без исключения, особенно людям пожилого возраста, нужно уделять должное внимание характеру питания, увеличив долю растительных компонентов и клетчатки и отказавшись от большого количества животного жира и алкоголя. При подозрении на наличие опухоли в кишечнике, не стоит медлить, нужно сразу же отправиться к врачу. Только при раннем обращении за помощью можно ожидать хорошего результата лечения.
Видео: заболевания прямой кишки в программе “Жить здорово!”
Автор: врач-онколог, гистолог Гольденшлюгер Н.И. (OICR, Toronto, Canada)
Обсуждение и вопросы автору:
Автор выборочно отвечает на адекватные вопросы читателей в рамках своей компетенции и только в пределах ресурса ОнкоЛиб.ру. Очные консультации и помощь в организации лечения в данный момент не оказываются.
Рак прямой кишки
МРТ методика и МРТ стадирование рака прямой кишки
Основным направлением в лечении колоректального рака в настоящее время является иссечение прямой кишки вместе с эмбриологически связанным с ней фасциальным футляром и параректальной клетчаткой содержащей лимфатические узлы, total mesorectal excision (TME). Другим направлением является переход от адъювантной к неоадъювантной химиолучевой терапии. Оба подхода кардинально изменили частоту местных рецидивов и выживаемость пациентов. Полная ремиссия может достигать до 30% у пациентов получающих неоадьювантную химиотерарию. Вопрос состоит в том, является ли пациент с раком прямой кишки кандидатом на TME или же необходима предоперационная химиолучевая терапия с последующей TME. МРТ, как наиболее точный метод для стадирования рака прямой кишки, может ответить на этот вопрос.
Max Lahaye, Regina Beets-Tan and Robin Smithuis [перевод оригинальной статьи ->]
Radiology Departement of the Maastricht University Hospital and the Rijnland Hospital in Leiderdorp, the Netherlands
Введение
Ранние методы хирургического лечения рака прямой кишки заключались в резекции опухоли с окружающей параректальной клетчаткой. Однако при использовании данных методик частота местных рецидивов достигала 40%. В 1982 году хирургом Richard John Heald была предложена техника TME. Широкое внедрение данной техники позволило снизить частоту местных рецидивов с 40% до 11% (1,2). Роль МРТ заключается в определении возможности TME операции, а в случае значительной распространенности опухолевого процеса назначения химиолучевой терапии как первого этапа лечения, с последующей TME.
Total mesorectal excision
TME техника является методом выбора при лечении колоректального рака при условии налиичия свободного края опухоли. Прямая кишка с опухолью «единым блоком» удаляется вместе с мезоректумом под контролем зрения до уровня анального канала острым путем в бессосудистой зоне. Собственная фасция остается неповрежденной. Сохраняются в целостности расположенные кнаружи пресакральная прослойка жировой ткани, париетальная фасция боковых стеной таза, предстательная железа у мужчин и влагалище у женщин вместе с нервными сплетениями. Это сводит к минимуму вероятность неполного удаления опухоли.

На схематическом изображении слева, опухоль прямой кишки с прорастанием в параректальную клетчатку и изменениями единичных лимфатических узлов. Край резекции по мезоректальной фасции без признаков инвазии, следовательно TME может быть выполнена. Обратите внимание на верхний край анального канала (зуючатая линия — синяя стрелка).
На МР изображениях параректальная клетчатка имеет высокую интенсивность сигнала на Т1 и Т2 взвешенных изображениях. Параректальная клетчатка отграниченна мезоректальной фасцией, которая виднка как тонкая линия с низкой интенсивностью МР сигнала (красные стрелки).
Роль мезоректальной фасции при планировании TME.
Наименьшая дистанция от края опухоли или лимфатических узлов называется circumferential resection margin (CRM/циркулярный край резеции/ проксимальный, дистальный и латеральный края резекции). Она является одим из главных факторов риска местного рецидива. Вовлеченный латеральный край резекции является отдельным прогностическим фактором общей и безрецидивной выживаемости, расстояние > 2 мм позволяет говорить о том, что мезоректальная фасция интактна, 1-2 мм с возоможной инвазией, и вовлечена в процесс если это расстояние ⩽1 mm.

Прямая кишка окружена параректальной клетчаткой, отграниченной мезоректальной фасцией, помеченной красными стрелками. Р — простата V — семенные пузырьки
Сircumferential resection margin / циркулярный край резеции / латеральный край резекции

На иллюстрации слева:
- T2-опухоль ограниценная стенкой кишки
- T3-опухоль с широким circumferential resection margin или T3 CRM-
- T3-опухоль с вовлечениемм латерального края резекции или T3 CRM+ (красная стрелка)
- T4-опухоль с прорастанием в семенные пузырьки и простату
При наличии визуализируемых лимфатических узлов и «отсевов» опухоли в 2 мм от мезоректальной фасции, всегда необходимо отражать это в описании, так как они могут отражать вовлечение латерального края резекции (синяя стрелка).

МРТ исследование должно определить следующее:
- Расположение опухоли
- Уровень (нижне-, средне- или верхнеампулярный отдел прямой кишки), размер, окружость роста
- T-стадию: T1, T2, T3 или T4
- Расстояние от опухоли до мезоректальной фасции. Вовлечен или нет?
- Рост опухоли или лимфатических узлов в 1 мм от края резекции?
- N-стадию: Есть ли лимфатические узлы в пределах параректальной клетчатки или за ее пределами?
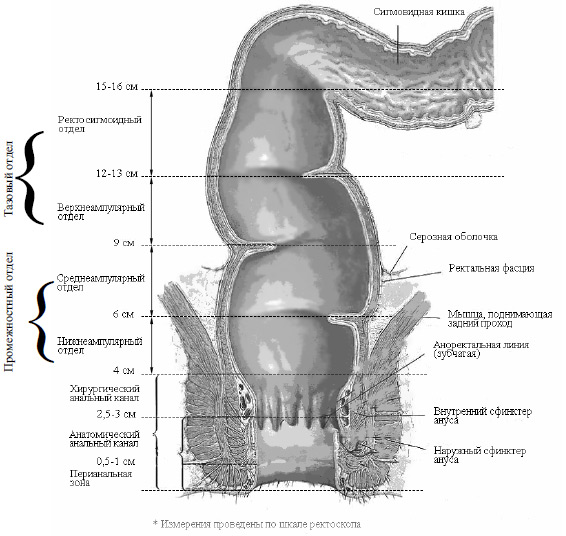
Локализация опухоли
Прямой кишкой называется сегмент толстой кишки к низу от сигмовидной ободочной кишки и до заднепроходного отверстия. Ректосигмоидный переход условно определяется на 15 см выше анального отверстия. Опухоли с локализацией более 15 см выше анального отверстия рассматриваются и рассматриваться как опухоли сигмовидной кишки. Поскольку на МР изображениях мы не можем обнаружить анального отверстия, лучше измерять это расстояние от аноректального угла. Таким образом опухоли на 15 см выше аноректального угла рассматриваютсякак опухоли сигмовидной кишки.
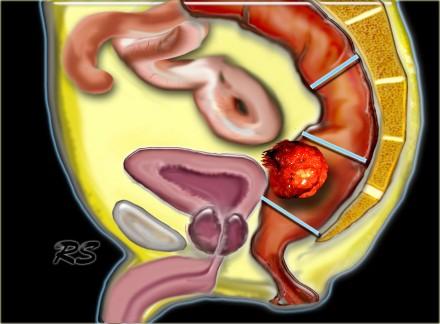
Рак прямой кишки может быть разделен на:
- Нижнеампулярный рак прямой кишки:
Дистальная граница от аноректального угла на 5 см. - Среднеампулярный рак прямой кишки:
Границы составляют 5-10 см от аноректального угла. - Верхнеампулярный рак прямой кишки:
Границы составляют 10-15 см от аноректального угла.
Нижнеампулярный рак прямой кишки

Нижнеампулярный рак прямой кишки имеет более высокую частоту местных рецидивов. Дистальное сужение параректальной клетчатки предрасполагает к тому, что нижнеампулярный рак прямой кишки более легко проникает в окружающие структуры и более трудоемок для получения свободного края резекции хирургом (см рисунок).
T-стадия и мезоректальная фасция.

Следующим шагом после определения локализации опухоли, необходимо определить Т-стадию. МРТ не может определить отграниченна ли опухоль подслизистым слоем или есть инвазия мышечного слоя, и следовательно, не может разграничить T1 и T2 стадию. Чтобы избежать рисков, тяжелых осложнений, связанных с обширными операциями, для ранних опухолей прямой кишки Т1 применяется трансанальное местное иссечение. Этот метод требует тщательной предоперационной диагностики с участием трансанального УЗИ, как более точного в дифференцировке на T1 и T2 стадиях.
T1 и T2
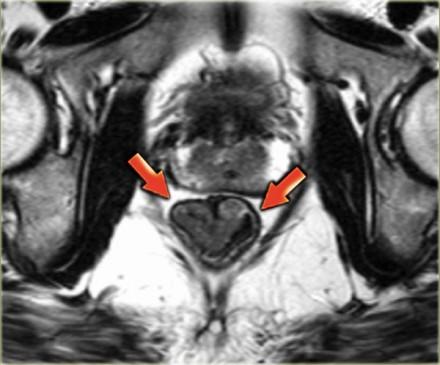
T1 и T2 опухоли ограничены стенкой кишечника и имеют хороший прогноз в лечении.
Они могут быть достаточно точно определены на МРТ, так как неизмененная стенка прямой кишки будет иметь вид линии с МР-сигналом низкой интенсивности, что означает что наружный мышечный слой окружает опухоль (3). На изображении, опухоль прямой кишки полностью окружена черной полоской наружной мышечной стенки. Это Т2 опухоль.
T3 MRF-

Т3 опухоли прорастают все слои кишечной стенки и проникают в параректальную жировую клетчатку. При данной стадии важно определить имеется ли вовлечение мезоректальной фасции или нет. Слева изображена опухоль с возможной инвазией в параректальную клетчатку т.е. Т3 (стрелка). Край резекции широкий и нет увеличения лимфатических узлов прилегающих к мезоректальная фасции . Эта опухоль классифицируется как Т3 MRF-. В Нидерландах, как и в большинстве европейских стран, этому пациенту будет проведен короткий предоперационный курс лучевой терапии с последующим TME.

Периректальная инфильтрация/инвазия
Чувствительность МРТ в диагностике инвазии в периректальную клетчатку составляет 82%. Видимая лучистая инфильтрация периректальной клетчатки, может быть ловушкой, так как может быть как результатом опухолевого прорастания, так и местной десмопластической реакции. Что бы избежать неправильной трактовки, опухоли с инфильтрацией периректальной клетчатки рекомендуется стадировать как Т3. Степень экзофитного распространения является прогностическим фактором. На МР изображениях слева предствалены две опухоли со схожей МР картиной. На изображении А была выявленая инвазия периректальной клетчатки. На изображении В опухоль была отграничена стенкой кишечника, Т2 стадия, периректальная инфильтрация клетчатки в данном случае была результатом десмопластической реакции. На выбор лечебной тактики данный признак, при дифференцировке между T2 MRF- и T3 MRF- опухолями, не оказывает значимого влияния. Обе опухоли будут подвергнуты ТМЕ или предоперационному курсу низкодозной лучевой терапии 5х5 Гр с последующим TME
T3 MRF +
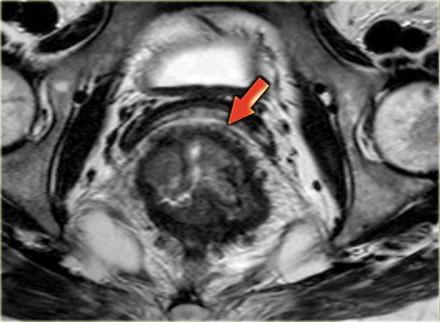
Слева опухоль с инвазией параректальной клетчатки и инвазией переднего края резекции (стрелка). Такая опухоль классифицируется как Т3 MRF +. Данный пациент будет проходить курс химиолучевой терапии, при положительном ответе на которую по результатам МРТ контроля будет проведено рестадирование с последующей ТМЕ.
T4

Т4 — опухоль инфильтрирует окружающие органы (влагалище, простату, семенные пузырьки или мочевой пузырь) и ткани. Пациенты с данной стадией требуют длительного курса химиолучевой терапии и обширной операции. Для определяется инвазии в окружающие органы все диагностические методы показывают схожую чувствительность: 70% для ТРУЗИ, 72% для КТ и 74% для МР-томографии. Слева T4-опухоль с инвазией предстательной железы.
N-стадия

Наличие N-стадии является важным фактором риска развития локорегионарного рецидива. К сожалению МРТ, как и большинство других методов визуализации, имеет низкую чувствительность и специфичность для обнаружения метастазов в лимфатических узлах. Пораженными считаются лимфатические узлы с размерам по короткой ось > 5 мм, изменением формы, с лучистыми контурами и нечеткими границами или гетерогенной структурой. Однако не все пораженные лимфатические узлы отвечают этим критериям.
Более часто используется классификация TNM5 для определения N-стадии. N-стадии в TNM7 схожи с TNM5, но N1 и N2-стадии более дифференцированы.
Даже в T1 и T2 стадии опухолевого процесса имеют значительный риск метастатическго поражения лимфоузлов (см. таблицу).
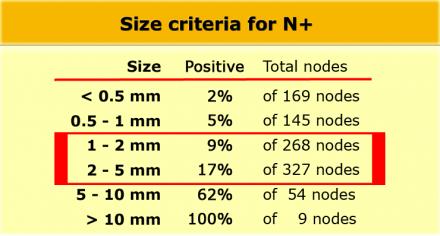
Низкая чувствительной использования для оценки только размеров, может быть объяснена тем фактом, что при колоректальном раке широко распространено наличие злокачественных изменений даже в мелких лимфатических узлах, до 9% в узлах размерами 1-2 mm nodes и до 17% у узлах размерами 2-5 mm (11). Как показано в таблице слева, большинство изменений выявляется в лимфатических узлах размерами 1-5 mm. Чтобы не занижать стадию все визуализируемые лимфатические узлы можно рассматривать как малигнезированные.

На изображении слева нижнеампулярный рак прямой кишки с множественными лимфатическими узлами в периректальной клетчатке кзади от ампулы. Это имеет огромное влияние на прогноз у пациента, основанное на MRF+ и N+ статусе, по этому пациент будет получать более агрессивное лечение с неоадъювантной химиолучевой терапией.

Важно обращать внимание на лимфатические узлы задней мезоректальной клетчатки (стрелка). Данные мезоректальные лимфатические узлы важны, так как могут быть причиной местных рецидивов. При их обнаружении с помощью МРТ, лучевая терапия и хирургическое планирование будут адаптированы.
Слева пациент после TME с рецидивом в узлах мезоректальной клетчатки (стрелка). Эти мезоректальные лимфатические узлы не были резецированы во время стандартной ТМЕ операции.
Определение малигнезированных мезоректальных лимфатических узлов как минимум влечет за собой более расширенную хирургическую тактику, так как необходимо удалить все опухолевые узлы или увеличение дозы лучевой терапии в зоне риска.

На аксиальных Т2-взвешенных изображениях слева представлены два пациента с раком прямой кишки. Эти примеры иллюстрируют сложности определяется N-статуса. На крайний слева определяется небольшой эктрамезоректальный лимфатический узел.
На изображении справа визуализируются многочисленные крупные мезоректальные лимфатические узлы, а также в правых отделах эктрамезоректальной клетчатки определяется лимфатический узел с нечеткими границами (красная стрелка). Хотя лимфатические узлы этих пациентов имеют разные характеристики по размерам, границам и гетерогенному внешнему виду, все они оказались малигнезированными.
Рак прямой кишки характеризуется метастатическим поражением мелких лимфатических узлов.
МР протокол

Только T2 FSE изображения, нет контрастное усиления.
Требуются только T2 FSE последовательности. Применение препаратов гадолиния не улучшает диагностическую точность и, следовательно, они не включены в стандартный протокол при данной патололгии. Изображения получают в сагиттальной, корональной и аксиальной плоскостях. Начинать необходимо с сагиттальной серии, по ней выстраиваются аксиальные изображения, перпендикулярные стенкам прямой кишки на уровне опухоли (синие линии). Коронарные изображения выстраиваются перпендикулярно аксиальной серии (желтая линия) через дистальные отделы опухоли и параллельно анальному каналу. Данный подход позволяет избежать артефакт частичного объема и позволяет точно оценить глубину инвазии опухоли, а так же оценить врастание опухоли в анальный канал. Кроме того правильно планировать МР последовательности помогает указание хирургом в направлении на исследование уровня опухоли. Верхней границей поля обследования (FOV) является L5, каудальная граница — ниже уровня анального канала. Рекомендуется использовать поверхностную катушку, в эндоректальной катушке нет необходимости. Единого мнения об использовании 1.5T или 3.0T систем нет. Диффузионно взвешенные изображения могут использоваться для переоценки стадии процесса. Высокий уровень сигнала на изображениях с B1000 указывает на неполный ответ.

Углы
Аксиальные изображения должны быть под правильным углом, перпендикулярно оси опухоли, чтобы избежать усреднения объема.
На примере слева первое планирование аксиальных изображений было выполнено под неправильным углом, что создало ложное впечатление о вовлечении мезоректальной фасции (MRF, выделено красным кругом), при правильном изменении угла перпендикулярно оси опухоли видно, что мезоректальная фасция (MRF) не вовлечена в процесс (желтый круг).

Не используйте программы с подавлением сигнала от жира и ректальное контрастирование
Подавление сигнала жира не улучшает визуализацию границ опухоли. Пациенты не нуждаются в подготовке кишечника. Использование ректального контраста не рекомендуется, потому что растяжение стенок кишечника может привести ложноположительным результатам при отсутствии инвазии в мезоректальную фасцию.
Кроме того, это затрудняет оценку дистальных мезоректальных лимфатических узлов.
Описание исследования
Описание исследования
А. Первичное исследование
Радиологический отчет должен содержать следующие пункты:
- Положение опухоли в нижне-, средне- или верхнеампулярном отделе прямой кишки.
- Расстояние от аноректального угла до нижнего полюса опухоли.
- Длина опухоли.
- Циркулярная или полуциркулярная. Положении опухоли боковых, передней или задней стенке.
- T-стадии:
- T1 / T2: опухоль ограничена стенки кишечника
- T3: инвазия периректальной клетчатки с указанием степени прорастания в мм.
- T4: вторжение в окружающие органы и ткани, с указанием пораженных органов.
- Наименьшее расстояние (в мм) между опухолью и мезоректальной фасцией с указанием локализации.
- N-стадия: лимфатические узлы в параректальной клетчатке с указанием минимального расстояния к краю резекции, указание экстрамезоректальных лимфатических узлов . Обозначить количество подозрительных лимфатических узлов.
Б. Оценка ответа на неоадъювантную химиолучевую терапию
Контрольное исследование выполняется аналогичным образом как и первичное исследование, с добавлением префикса Y.
Например YT3 означает, что пациент с опухолевой инвазией в мезоректальную фасцию получает неоадъювантую терапию.
Лечение
Существуют различные подходы в лечении рака прямой кишки в разных странами и разных учреждениях. Общепринято, что TME является лучшим методом радикального лечения для всех опухолей со свободным краем резекции. В Нидерландах, как и в большинстве европейских стран, большинству пациентов до TME проводится краткий курс лучевой терапии 5×5 Гр. В отдельных учреждениях, при наличии хороших прогностических факторов (верхнеампулярные раки T1N0 и T2N0), предоперационный курс лучевой терапии не проводится. Короткие курсы лучевой терапии непосредственно перед TME не снижают распространенность и поэтому не подходят для местно распространенных опухолей.Все пациенты с Т4-опухолями, опухолями с инвазией края резекции, а так же опухолями с малигнезацией лимфатических узлов вблизи или за пределами края резекции, сначала получают высокодозную химиолучевую терапию. Дальнейшая тактика зависит от ответа на проводимое предоперационное лечение. В случае регрессии опухоли выполняется менее обширная резекция. В случаях уменьшения размеров опухоли и стерилизации узлов (yN0) следующим шагом выполняется TME. При полном исчезновение опухоли и лимфатических узлов может рассматриваться выжидательная тактика. Однако этот подход остается спорным и не является стандартным.
Рак прямой кишки: первые симптомы, стадии, лечение
Патологическое перерождение здоровых клеток дермы кишечника в злокачественное провоцирует болезнь, которая называется рак прямой кишки у человека. Точные причины возникновения онкологии анального канала до сих пор окончательно не установлены, однако определены предрасполагающие факторы риска. Начальные симптомы рака толстой кишки проявляются не сразу, зачастую они беспокоят больного уже на третьей степени, когда высок риск распространения метастазов. Поэтому важно своевременно вылечить недуг и предотвратить возможность рецидивов рака.
 Рак прямой кишки – смертельное заболевание, которое весьма опасно своим бессимптомным протеканием на ранних стадиях.
Рак прямой кишки – смертельное заболевание, которое весьма опасно своим бессимптомным протеканием на ранних стадиях.Каков патогенез и причины развития?
Этиология и патогенез, из-за которых возникает опухоль в толстой кишке, до сих пор точно не установлены, но известно, что риск рака у мужчин и женщин увеличивается в старшем возрасте — от 55 лет. Причины, провоцирующие возникновение рака анального отверстия следующие:
- Наследственность. Болезнь чаще проявляется у детей и взрослых, в роду которых уже была диагностирована онкология, поражающая ректальный отдел.
- Неправильное питание. Рак заднего прохода нередко появляется у людей, которые неправильно питаются, злоупотребляют вредной пищей.
- Пассивный образ жизни. Заболевания в нижнем отделе прямого кишечника нередко проявляются у женщин и мужчин, которые ведут малоподвижный, сидячий образ жизни.
- Чрезмерно лишний вес. Большая масса тела приводит к нарушениям в работе внутренних органов, в том числе органах пищеварения. Сначала больной обнаруживает у себя все признаки геморроя, который излечим. Но если вовремя не приступить к терапии, быстро развивается рак.
- Злоупотребление вредными привычками.
- Авитаминоз. При недостатке витаминов Е, А и С ядовитые и токсические вещества беспрепятственно проникают в прямой кишечник и усваиваются там, провоцируя развитие злокачественной патологии.
- Присутствие в организме ВПЧ 16 типа, который вызывает онкологию.
Вернуться к оглавлениюУ ребенка онкологическое заболевание зачастую вызвано наследственной предрасположенностью, при этом предпосылки развития недуга закладываются еще в период внутриутробного развития.
Какие бывают виды?
Рак прямого кишечника имеет разновидности, которые отличаются по месту локализации патологии, типу роста и особенностей строения. Исходя из всего этого, различают такие виды патологии:
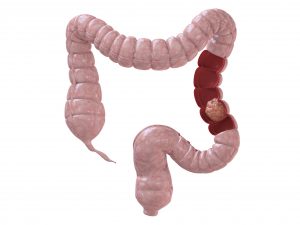 Рак прямой кишки классифицируют по локализации, степени поражения, интенсивности роста.
Рак прямой кишки классифицируют по локализации, степени поражения, интенсивности роста.- По месту локализации рак бывает:
- Рак ануса. Раковое новообразование локализуется в области анального отверстия.
- Рак нижнеампулярного отдела прямой кишки. Онкологией затрагивается первый отрезок, который продолжается после анального отверстия, имеющий продолжительность до 5 см.
- Рак среднеампулярного отдела. Злокачественные клетки поражают отрезок прямой кишки, располагающийся на высоте 5—7 см.
- Рак верхнеампулярного отдела. При поражении верхнего ампулярного отрезка поражается отрезок, который располагается на высоте 7—12 см.
- Онкологическое новообразование в отрезке ректосигмоидного отдела. Опухоль локализуется в прямой кишке на глубине более 12 см.
- По типу роста разделяют:
- Экзофитный. Разрастается в просвете кишки и выглядит как узловатое соединение.
- Эндофитный. Новообразование увеличивается в размерах и поражает глубокий слизистый слой органа.
- Инфильтративный. Поражает все слои кишечника и затрагивает соседние, здоровые ткани.
- По виду гистологической природы выделяют:
- Аденокарциному или железистый рак прямой кишки, при этой форме различают:
- высокодифференцированный;
- умеренно дифференцированный;
- низкодифференцированный.
- Слизистую аденокарциному которая, в свою очередь, подразделяется на рак:
- коллоидный;
- мукоидный;
- слизистый.
- Перстневидноклеточную опухоль.
- Недифференцированная опухоль.
- Неклассифицируемую онкологи.
- Аденокарциному или железистый рак прямой кишки, при этой форме различают:
Первые симптомы и течение в зависимости от стадии
Симптомы рака прямой кишки на начальных стадиях распознать не всегда удается, так как зачастую первые признаки проявляются уже тогда, когда опухоль имеет большие размеры, нарушает работу органа провоцирует непроходимость кишечника и обильное кровотечение. Однако для того, чтобы терапия была успешной, а шансы на выживаемость повысились, важна диагностика проблем на ранних стадиях, поэтому при любых нарушениях и подозрениях ни в коем случае не медлите, а идите на консультацию к врачу.
 Первая стадия рака прямой кишки может проявляться нечастыми сбоями пищеварения.Вернуться к оглавлению
Первая стадия рака прямой кишки может проявляться нечастыми сбоями пищеварения.Вернуться к оглавлению1-я стадия
Клиническая картина на стадии, когда болезнь только начинается, не выражена, больного зачастую не беспокоят неприятные ощущения, иногда наблюдается повышенное газообразование, признаки несварения, при дефекации из анального отверстия иногда кровит. Раковые клетки пока сосредоточены только в верхних слоях органа, более глубокие ткани, мышечный слой и лимфоузлы не затронуты, регионарных и отдаленных метастазов нет.
Вернуться к оглавлению2-я стадия
На стадии 2-А болезнь протекает с более выраженными симптомами, при этом опухоль занимает от трети до половины площади слизистых тканей, но ограничивается пределами просвета органа, соседние ткани и органы не поражены, метастазов не наблюдается. На стадии 2-Б у больного появляются жалобы на нарушение самочувствия, так как опухоль метастазировала в соседние лимфоузлы, однако размеры такие же, как на стадии 2-А.
Вернуться к оглавлению3-я стадия
Признаки рака прямой кишки на 3-й стадии уже становятся более выраженными. Патология может вызывать у больного такие симптомы:
- тупые боли;
- тошнота;
- диарея, которая сменяется запорами;
- повышенное газообразование;
- проблемы с пищеварением.
Во время дефекации обнаруживается слизь и кровь в кале, возможна потеря массы тела. На стадии 3-А образование занимает более ½ просвета органа, все слои кишечника поражены, в близрасположенных лимфоузлах определяются метастазные клетки. Стадии 3-Б характерны множественные метастатические поражение лимфоузлов, однако вылечить болезнь и улучшить прогноз на восстановление еще возможно, если диагностировать проблему на этом этапе и начать ее правильно лечить.
Вернуться к оглавлению4-я стадия
 4-я стадия рака прямой кишки – болезненное, неизлечимое состояние.
4-я стадия рака прямой кишки – болезненное, неизлечимое состояние.На 4-й стадии человека беспокоят ярко выраженные клинические проявления рака прямой кишки. Опухоль имеет большой размер, при этом весь просвет кишечника нею закрыт. Раковые клетки распространены в регионарных и отдаленных лимфоузлах, патологическими клетками поражены другие органы. На этой стадии новообразование может распадаться, при этом разрушается и прямая кишка, что приводит к перфорации органа.
Состояние человека тяжелое. Беспокоят сильные боли в животе, наблюдается анорексия. Рвота при раке прямой кишки часто бывает с кровью, так как онкологией затронуты другие органы пищеварения и структуры периферической нервной системы. Температура при раке 4-й стадии высокая, у женщин помимо кишечника, поражены органы мочеполовой системы. На этой стадии недуг не вылечивается, больному проводится паллиативное лечение, важна также помощь, благодаря которой пациент будет готов психологически к исходу такой ситуации.
Вернуться к оглавлениюМетастазы при раке прямой кишки
Рак прямой кишки метастазирует на запущенных стадиях, но встречаются случаи, когда опухоль дает метастазы даже на 1-й стадии. Такой рак называется высокодифференцированным, поражающим любые, даже удаленно расположенные внутренние органы. Зачастую метастазы поражают:
- ткани печени, почек и мочеполовые органы, расположенные в малом тазу;
- тазовые кости и позвоночный столб;
- легкие и пищевод;
- ткани головного мозга;
- лимфоузлы регионарного, тазового и забрюшинного расположения.
Диагностика
Чтобы диагностировать рак прямой кишки, при подозрительных признаках важно обратиться к доктору и в деталях охарактеризовать всю беспокоящую симптоматику. Сначала доктор должен иметь основания для назначения дальнейшего исследования, поэтому пациенту проводится пальцевое исследование сфинктера и ректального отдела. Для исключения других патологий, поражающих прямую кишку, проводится дифференциальная диагностика. Если первичная диагностика подтверждает диагноз, больной отправляется на лабораторные и инструментальные методы исследования, приведенные в таблице.
| Исследования | Процедуры |
| Лабораторные | Общий и биохимический анализ крови |
| Анализ мочи | |
| Сдача кала на скрытую кровь | |
| Определение онкомаркера рака кишечника в крови | |
| Инструментальные | Ректороманоскопия |
| Фиброколоноскопия | |
| Ирригоскопия | |
| Гастроскопия | |
| Компьютерная или магнитно-резонансная томография с применением контрастного вещества |
Какое назначается лечение?
Лечение рака прямой кишки облегчается тем, что есть возможность применить почти все методы, которые хорошо зарекомендовали себя в терапии онкологических болезней. Недуг успешно лечится на начальных стадиях при помощи хирургии, если же болезнь развивалась долго, и были обнаружены метастазы во внутренних органах, понадобится комплексное лечение.
Вернуться к оглавлениюХирургическая операция
Нередко после хирургического вмешательства больные получают инвалидность. Группа инвалидности при раке кишечника зависит от тяжести патологии, зачастую пациенты получают I и II. III дают в случае ограниченных возможностей, когда работоспособность невозможна.
 Хирургия при раке прямой кишки чревата получением группы инвалидности и наложением пожизненной стомы.
Хирургия при раке прямой кишки чревата получением группы инвалидности и наложением пожизненной стомы.Карцинома лечится хирургическим путем, учитывается место локализации опухоли, стадия и состояние организма больного. Тактика при назначении лечения заключается в следующих мероприятиях:
- Для стабилизации состояния предусмотрено введение разгрузочной трансверзостомы, которая поможет избавиться от кишечной непроходимости и нормализовать работу органа. Когда больному станет лучше, проводится оперативное вмешательство.
- При новообразовании в ректосигмоидном изгибе удаляется пораженный участок, конец кишки выводят наружу в виде сигмостомы.
- При верхнеампулярном или среднеампулярном раке выполняют переднюю резекцию кишки, удаляя клетчатку таза и пораженные лимфоузлы. На месте удаления накладывают анастомоз или разгрузочную превентивную трансверзостому.
- При нижнеампулярном раке проводят брюшинно-анальную резекцию, удаляя практически всю прямую кишку, но сфинктерный аппарат оставляется.
- При аноректальной онкологии делают брюшинно-промежностную операцию, удаляя прямую кишку, сфинктерный аппарат и лимфоузлы. Дефекация будет производится через исскуственную стому, которая останется у больного навсегда.
Химиотерапия
После операции может возникнуть рецидив рака прямой кишки, поэтому назначаются сильнодействующие ядовитые препараты, затормаживающие рост и развитие опухоли:
- «5-Фторурацил»;
- «Оксалиплатин»;
- «Лейковорин».
Другие методы
Для успешной борьбы с патологией, имеющей злокачественный патогенез, важна иммуностимулирующая терапия, при которой применяются моноклональные антитела и цитокины, способны вызвать активацию защитных функций организма и уничтожить опухоль. Для предотвращения гнойных осложнений после операции понадобится особый уход. Если поражено анальное отверстие, используется мазь «Левомеколь». Из народных средств применяются кровоостанавливающие микроклизмы на основе подорожника, ромашки и зверобоя, частота применений которых согласовуется с врачом.
Вернуться к оглавлениюДиетическое питание
Если диагностирован рак прямой кишки, то помимо хирургии и химиотерапии, патологию лечат при помощи диеты. Во время лечения и при рецидиве важно придерживаться правильного питания. Основные принципы диеты общеизвестны. Меню должно быть полноценным, питаться нужно понемногу, часто, делая легкие перекусы даже ночью перед сном. Важно чтобы день начинался с полноценного завтрака, обед должен содержать сложные углеводы и белки, а на ужин рекомендуется овощной гарнир с постным мясом.
 Избежать рак прямой кишки можно соблюдая здоровый образ жизни и своевременно обращаясь к врачу при появлении тревожных симптомов.Вернуться к оглавлению
Избежать рак прямой кишки можно соблюдая здоровый образ жизни и своевременно обращаясь к врачу при появлении тревожных симптомов.Вернуться к оглавлениюПрофилактика и прогноз
Профилактика рака заключается в своевременном обнаружении и правильном лечении. Прогноз зависит от своевременности обнаружения и адекватности подобранной терапии. Поэтому важно сразу идти к врачу, как только обнаружились подозрительные симптомы. Важно не пропустить симптомы рецидива рака прямой кишки, если начать лечение сразу, прогноз на восстановление положительный.
Рак прямой кишки — Абдоминальная онкология
Лечение рака прямой кишки является актуальной проблемой современной онкологии. В некоторых случаях рак прямой кишки требует комбинированного лечения, то есть сочетания хирургического, лучевого и химиотерапевтического методов, выбор этапности и объема которого зависит от стадии заболевания.
Лучевая терапия в основном проводится на предоперационном этапе, в случаях значительного локорегионарного (местного) распространении опухоли, с целью уменьшения её размеров и повышения радикальности предстоящей операции. Лучевая терапия рака прямой кишки проводится при локализации опухоли в средне- и нижнеампулярном отделах прямой кишки. При локализации опухоли в верхнеампулярном и/или ректосигмоидном отделе прямой кишки лучевая терапия не проводится.
Химиотерапия может проводиться как на предоперационном этапе, с целью уменьшения размеров первичной опухоли, уменьшения размеров имеющихся метастазов, так и в послеоперационном периоде, в тех случаях, когда при исследовании материала, удаленного во время операции обнаруживаются лимфатические узлы с метастазами опухоли (регионарные метастазы). Другим основанием для назначения химиотерапии является наличие отдаленных метастазов.
Но в любом случае, операция является основным этапом лечения.
В нашем стационаре проводится комбинированное лечение злокачественных опухолей прямой кишки. Оно включает в себя:
1. Оперативное лечение:
- традиционные (открытые) оперативные вмешательства
- Лапароскопические операции
- Роботассистированные операции (при помощи робота Da Vinci).
2. Химиотерапевтическое лечение:
- Предоперационная (неоадъювантная) химиотерапия
- Послеоперационная (адъювантная) химиотерапия
Операция выбора
Принципиальными факторами, влияющими на выбор объема оперативного вмешательства, является соблюдение двух обязательных условий:
- обеспечение максимального радикализма операции, то есть удаление раковой опухоли вместе с зонами и путями регионарного метастазирования в едином фасциальном (эмбриональном) футляре
- и стремление хирурга обеспечить максимальную физиологичность выполняемой операции.
Кроме того, выбор характера и объема оперативного вмешательства (в первую очередь органосохраняющего) зависит от степени местного распространения опухолевого процесса и уровня локализации опухоли в прямой кишке.
В нашем стационаре используется следующая классификация локализации раковой опухоли:
Уровни локализации рака прямой кишки
|
|
С учетом перечисленных факторов все операции на прямой кишке можно разделить на две группы – с сохранением и без сохранения сфинктерного аппарата прямой кишки.
В последние годы, прежде всего благодаря развитию медицинского инструментария, появлению специальных сшивающих аппаратов количество органосохраняющих операций неуклонно растет.
Лечение рака ректосигмоидного, верхне- и среднеампулярного отделов
При раке ректосигмоидного, верхне- и среднеампулярного отделов прямой кишки операцией выбора является внутрибрюшная (передняя) резекция прямой кишки.
Смысл операции заключается в удалении (резекции) части прямой кишки с окружающей её жировой клетчаткой в единой фасциально-футлярной капсуле (мезоректумэктомия) ниже опухоли на 5-6 см.
| Хирургическое лечение рака прямой кишки |
| Резекция части прямой кишки |
| Хирургическое лечение рака |
| Удаление части прямой кишки |
Данный этап операции особенно важен, так как адекватность и полнота его выполнения является важнейшим фактором для профилактики местного рецидива (из околопрямокишечных лимфатических узлов). Адекватная и полная лимфодиссекция с учетом основного пути лимфооттока также является очень важным фактором профилактики локорегионарных рецидивов, ассоциированных с заболеванием регионарных лимфатических узлов. Она достигается за счет высокой перевязки нижней брыжеечной артерии у места её отхождения от брюшной аорты.
| Операция при раке прямой кишки |
| Циркулярный сшивающий аппарат |
Завершается операция формированием межкишечного анастомоза (соустья) между оставшейся частью прямой кишки и вышележащим отделом толстой кишки (чаще всего с сигмовидной кишкой). Анастомоз формируется либо с помощью ручного шва, либо с помощью специальных сшивающих аппаратов циркулярного шва. Тем самым восстанавливается непрерывность кишечной трубки.
Лечение рака нижнеампулярного отдела прямой кишки
На протяжении длительного периода времени операцией выбора с позиции соблюдения принципов онкологического радикализма при локализации опухоли в нижнеампулярном отделе прямой кишки была брюшно-промежностная экстирпация прямой кишки. Суть операции заключалась в удалении всей прямой кишки с окружающей её параректальной клетчаткой и вместе со сфинктерным аппаратом.
| Удаление прямой кишки при нижнеампулярной локализации | Формирование колостомы на передней брюшной стенке |
Операция завершается формированием противоестественного заднепроходного отверстия (колостомы) на передней брюшной стенке.
В настоящее время брюшно-промежностная экстирпация выполняется только при больших распространенных опухолях, которые располагаются глубоко в малом тазу и вовлекают мышцы анального сфинктера или в случае локализации опухоли на расстоянии 1-2 см от анального сфинктера.
В нашем стационаре используется более радикальная методика — «цилиндрическая» экстралеваторная брюшно-промежностная экстирпация прямой кишки в модификации Хольма. Суть операции сводится к выполнению промежностного этапа вмешательства в положении больного лежа на животе, что обеспечивает более радикальное удаление опухоли при локализации ее в нижнеампулярном отделе. Выполнение промежностного этапа в положении пациента лежа на животе дает существенные преимущества при визуализации структур таза, особенно у мужчин.
В случае расположения опухоли на расстоянии 3 см и выше от анального жома возможно выполнение сфинктеросохраняющей операции, так называемой ультранизкой передней резекции прямой кишки. Суть операции заключается в том, что также удаляется прямая кишка вместе с окружающей параректальной клетчаткой в едином фасциальном футляре, высоко у аорты перевязывается нижняя брыжеечная артерия, а сама линия резекции прямой кишки проходит непосредственно над сфинктерным аппаратом.
Завершается операция как и при оперировании ректосигмоидного, верхне- и среднеампулярного отделов — формированием межкишечного анастомоза (соустья) между оставшейся частью прямой кишки и вышележащим отделом толстой кишки (чаще всего с сигмовидной кишкой). Анастомоз также формируется либо с помощью ручного шва, либо с помощью специальных сшивающих аппаратов, что позволяет восстановить непрерывность кишечной трубки.
Единственной особенностью этой операции является то, что её можно выполнить только лапароскопически или роботассистированно. Это связано с особенностями топографии прямой кишки, которая располагается в полости малого таза, в очень малом и узком по объему пространстве в окружении костей таза, крупных магистральных сосудов и нервных сплетений.
После операции
Раньше, при выполнении подобных операций традиционным способом, в послеоперационном периоде пациенты сталкивались с нарушением функции тазовых органов, в первую очередь у них были проблемы с мочеиспусканием. Сейчас, благодаря использованию малотравматичных эндовидеохирургических методов (лапароскопические и роботические операции на хирургическом комплексе Da Vinci) с их высокой четкостью и детализацией мельчайших структур можно выполнять бережные нервосохраняющие операции. Благодаря которым у больных не только не нарушается мочевыделительная функция, но и сохраняется способность получения полового удовлетворения (оргазма), что особенной важно для молодых пациентов.
| Роботоассистированное лечение рака прямой кишки |
| Робот Да Винчи. Положение ассистента. |
| Робото ассистированная операция |
| Положение оперирующего хирурга. |
По мнению большинства авторов, а также по результатам множества исследований установлено, что наиболее оптимальным местом использования роботоассистированных операций является так называемая хирургия малых пространств, к которым относится и малый таз.
В нашем стационаре выполняется весь спектр операций на прямой кишке как традиционным (открытым) методом, так и высокотехнологичными малотравматичными методами: лапароскопически и роботассистированно.
Наш стационар с его онкологическим отделением единственный в городе Санкт-Петербурге имеющий роботический комплекс DaVinci. Специалисты нашего отделения проходили стажировку в крупнейших клиниках и научных центрах США и Европы, накоплен серьезный собственный опыт выполнения такого рода операций.
Эти операции относятся к разряду высокотехнологичных, а потому дорогостоящих. Однако, благодаря наличию федеральных квот эти операции доступны всем нуждающимся в них.
Виды радикальных операций при раке прямой кишки
При раке прямой кишки онкологически оправданными и типовыми являются два вида оперативных вмешательств: сфинктеросохраняющие и связанные с удалением анального замыкательного аппарата и наложением противоестественного заднего прохода.Сфинктеросохраняющие операции представлены передней резекцией прямой кишки и брюшно-анальной резекцией с низведением сигмовидной кишки. Вторая группа операций включает брюшно-промежностную экстирпацию прямой кишки и обструктивную резекцию прямой кишки.
Выбор той или иной радикальной операции зависит, прежде всего от локализации раковой опухоли и стадии опухолевого процесса.
Передняя резекция прямой кишки показана при раке верхнеампулярного и ректосигмоидного отделов, когда нижняя граница опухоли располагается на 10 см выше аноректальной линии и экзофитной форме роста опухоли I-II стадии (T1-2N0-IM0).
Брюшно-анальная резекция прямой кишки с низведением сигмовидной кишки выполняется при раке средне- или верхнеампулярного отделов, когда нижняя граница опухоли находится на расстоянии 7-12 см от аноректальной линии I-II стадии (T1-2N0-IM0).
При такой же распространенности опухоли, но если брыжейка сигмовидной кишки укорочена или во время операции возникли технические сложности, следует выполнить брюшно-промежностную экстирпацию прямой кишки. Кроме того, брюшно-промежностную экстирпацию прямой кишки производят при раке нижнеампулярного отдела прямой кишки, когда опухоль I-II стадии (T1-4N0-I-M0) располагается на расстоянии до 6 см от аноректальной линии.
Эта же операция должна осуществляться при инфильтративной форме рака средне- и верхнеампулярного отделов прямой кишки I-III стадии (T1-4N0-1M0) независимо от уровня расположения опухоли, а также раке средне- и верхнеампулярных отделов III стадии (T4NIM0).
Обструктивная резекция прямой кишки (операция Гартмана) может быть рекомендована при раке прямой кишки II стадии (T2-4N0M0) и III стадии (T0-4N1М0) верхнеампулярного и ректосигмоидного отделов прямой кишки, когда нижняя граница опухоли находится на 10-12 см выше аноректальной линии и при этом имеется выраженный стеноз, а также другие противопоказания общего и местного характера к выполнению брюшно-промежностной экстирпации или внутрибрюшной (передней) резекции.
Техника радикальных операций
Независимо от типа предполагаемой операции по поводу рака прямой кишки больной укладывается на операционном столе на спину. Под крестец подкладывается возвышающее опорное приспособление. Копчик и ягодицы выводятся за край стола.Ноги больного располагаются на специальных подставках таки образом, чтобы они были разведены под узлом 45 градусов, согнуты в тазобедренных и коленных суставах. В мочевой пузырь необходимо ввести катетер. Головной конец операционного стола должен быть опущен на 10° по отношению к горизонтали.
Оперативным доступом при всех видах операции является нижняя срединная лапаротомия от лобка с обходом пупка слева и выше него на 3-5 см.
Важным этапом операции по поводу рака прямой кишки является ревизия. Этот этап начинают с последовательного осмотра и ощупывания брыжейки сигмовидной, нисходящей, поперечной ободочной кишок и стенок малого таза. Пальпаторно исследуют обе доли печени, забрюшинное пространство с расположенными в нем органами, брыжейку тонкой кишки и остальные отделы ободочной кишки, органы малого таза.
При отсутствии видимых метастазов следующий момент ревизии осуществляется после вскрытия забрюшинного пространства. Этот акт одновременно является начальным этапом мобилизации прямой кишки. Для его выполнения петли тонкой кишки перемещаются вправо и кверху и отграничиваются влажным операционным бельем. Сигмовидная кишка оттягивается в краниальном направлении и кнаружи (влево).
После этого рассекается внутренний листок переходной складки брюшины корня брыжейки сигмовидной кишки (рис. 26.1). Затем сигмовидная кишка подтягивается в медиальном направлении и рассекается наружный листок брюшины в области его перехода с брыжейки сигмовидной кишки на боковую поверхность брюшной стенки и таза (рис. 26.2).
Рис. 26.1. Операция пo поводу рака прямой кишки. Рассечение брюшины по переходной складке
Рис. 26.2. Рассечение брюшины по боковой стенке живота и таза
Далее разрез продолжается в направлении прямокишечно-маточной (у женщин) или прямокишечно-пузырной (у мужчин) складки. Разрезы внутреннего и наружного листков брюшины соединяются спереди от прямой кишки, а в проксимальном направлении — на уровне предполагаемого пересечения сигмовидной кишки. Брюшинные листки следует пересекать осторожно, чтобы не повредить расположенные глубже подвздошные сосуды и мочеточник.
После рассечения брюшинных листков тазовую клетчатку тупым путем осторожно отсепаровывают в сторону прямой кишки вместе с лимфатическими узлами, расположенными по ходу общих подвздошных сосудов, их бифуркации, наружных и внутренних подвздошных сосудов. Проникают в позадипрямокишечное пространство. При этом необходимо бывает надсечь соединительнотканные тяжи между фасциями прямой кишки и крестца (рис. 26.3).
Рис. 26.3. Мобилизация прямой кишки по задней стенке тупым (а) и острым (б) путем
Отслойка должна происходить именно между ними в соответствии с принципом футлярности радикального оперирования. При повреждении фасции прямой кишки часть лимфатических узлов в параректальной клетчатке с возможными метастазами может остаться неудаленной. Повреждение фасции крестца может сопроводаться кровотечением из венозных сплетений.
После проникновения тупым путем в пространство между прямой кишкой и крестцом устанавливается или исключается возможное прорастание в крестец рака задней стенки прямой кишки. Если пальцы хирурга свободно доходят позади прямой кишки до уровня мышц тазового дна и ощущают переднюю поверхность кончика, мобилизацию задней стенки прямой кишки из брюшной полости следует считать завершенной.
Ревизия и мобилизация передней стенки прямой кишки представляют более сложную задачу. При этом существует реальная опасность повреждения органов таза, близко прилегающих к прямой кишке и связанных с нею соединительнотканными сращениями.
Особенно тесные взаимоотношения существуют между нижнеампулярным и промежностным отделами прямой кишки и мочеиспускательным каналом у мужчин и влагалищем у женщин. Мобилизация передней стенки прямой кишки начинается с того момента, когда хирург вводит кисть правой руки в позадипрямокишечное пространство и пытается охватить всю прямую кишку. Если это удается, вероятность прорастания опухоли в органы таза невелика.
Но все же окончательное суждение можно получить лишь после мобилизации передней стенки прямой кишки ниже уровня опухоли. Передняя стенка мобилизуется после рассечения собственной фасции прямой кишки (апоневроза Денонвилье). Если при этом не повреждаются соседние ткани, кровотечения не бывает.
Ревизия нижнеампулярного и анального отделов прямой кишки во время операции практически невозможна. Вопрос о возможности радикальной операции при этих локализациях рака следует решать на этапе дооперационного обследования. Ревизия завершается обследованием самой опухоли.
При этом выясняется прорастает ли опухоль всю толщу стенки кишки, распространяется ли она на прилежащие клетчатку и органы. Результатом является установленная возможность выполнения радикальной операции: простой, расширенной, комбинированной
Внутрибрюшная (передняя) резекция прямой кишки
При этой операции удаляются дистальная (или большая) часть сигмовидной кишки, проксимальная половина прямой кишки с параректальной клетчаткой и регионарными лимфатическими узлами (рис. 26.4). Начальные этапы мобилизации описаны выше.
Рис. 26.4. Схема операции внутрибрюшинной (передней) резекции прямой кишки
После отсепаровки клетчатки и брюшины становятся видны подвздошные артерии и вены до уровня их бифуркаций, а также оба мочеточника в месте их перекрещивания с сосудами. Вправо в краниальном направлении отводятся петли тонкой кишки. В рану выводится сигмовидная кишка и производят лирообразный разрез брюшины в области корня ее брыжейки (рис. 26.5).
Рис. 26.5. Лирообразный разрез брюшины над сигмовидной кишкой
Производится мобилизация сигмовидной кишки и проксимальной половины прямой кишки (рис. 26.6). Для избежания натяжения в области будущего анастомоза иногда приходится мобилизовать всю левую половину ободочной кишки.
Рис. 26.6. Мобилизация сигмовидной кишки и начального отдела прямой кишки
После пересечения сосудов сигмовидной кишки, а также верхних прямокишечных артерии и вены, в пределах собственной фасции выделяется прямая кишка. Линия резекции прямой кишки должна проходить не менее, чем на 4 см ниже от нижнего края опухоли. В этом месте стенка кишки освобождается от жировой клетчатки на участке шириной примерно 2 см.
В этой зоне в последующем будут накладываться швы. Граница пересечения сигмовидной кишки должна проходить не менее, чем в 8-10 см проксимальнее края опухоли. В месте пересечения стенка сигмовидной кишки также освобождается от брыжейки и сальниковых отрезков. При этом необходимо убедиться в хорошем кровоснабжении остающегося участка кишки.
На остающиеся отрезки кишки накладывают сшивающие аппараты УКЛ или УО, а на удаляемый два раздавливающих зажима. Брюшная полость изолируется тампонами и салфетками. Скальпелем пересекается стенки кишки. Поверхность разреза обрабатывается антисептиком. Пораженная опухолью часть кишки удаляется в одном блоке с клетчаткой и расположенными в ней регионарными лимфатическими узлами.
Пересеченные концы сигмовидной и прямой кишок сближаются и накладывается межкишечный анастомоз «конец в конец». При этом следует учитывать, что не всегда могут совпасть диаметры анастомозируемых просветов кишок. В этих случаях кишку с более широким просветом (чаще прямую) анастомозируют, прошивая ее строго поперечное сечение перпендикулярными швами, а кишку с более узким просветом — в косом сечении.
Как правило, необходимо наложение двухрядных швов. Вначале на заднюю полуокружность анастомоза накладываются отдельные узловые швы. Затем пересекают просвет кишки ниже наложенного аппаратного шва, обрабатывают срез слизистоя оболочки антисептиком и накладывают внутренний ряд швов через все слои стенки кишки (рис. 26.7).
Рис. 26.7. Наложение анастомоза между сигмовидной и прямой кишкой
При этом применяют отдельные синтетические швы с узлами в просвет кишки, непрерывный обвивной шов из рассасывающегося материала, а также вворачивающий скорняжный шов. Существенного влияния на исход операции выбор вида шва не оказывает. Важно, чтобы хорошо были сопоставлены края слизистой оболочки. После ушивания просвета кишки накладываются отдельные серозно-мышечные швы на переднюю полуокружность анастомоза.
В последнее время все популярнее становится применение при передней резекции прямой кишки механического шва. Техника аппаратного колоректального анастомоза, описанная M.Ravitch и F.Steichem (1982) стала весьма распространенной. Несмотря на имеющиеся отдельные предостережения об опасностях механического шва в настоящее время аппаратный шов при выполнении передней резекции прямой кишки предпочтительнее ручного шва.
За последние годы появились усовершенствованные аппараты и техника анастомозов намного упростилась. Ранние исследования, утверждавшие, что частота рецидивов возрастает при использовании аппаратного шва, не получили подтверждения. Так N.Wolmark et. al. (1986) сравнили результаты ручного и механического шва при радикальных резекциях прямой кишки по поводу рака. При этом не выявлено статистически достоверной разницы в частоте рецидивов, времени их появления и выживаемости пациентов.
Независимо от способа наложения анастомоза операция завершается тщательным гемостазом, промыванием полости малого таз раствором антисептика. Через отдельный разрез кожи над копчиком пресакрально вводят длинный зажим. С его помощью захватывают дренажную трубку и протягивают ее наружу.
Внутренний конец дренажа должен быть установлен дистальнее анастомоза. Отдельными швами сшивают листки париетальной брюшины, помещая таким образом анастомоз в полости малого таза забрюшинно. Индивидуально решается вопрос о наложении декомпрессионной трансверзостоме или трансанальном введении декомпресионного зонда.
Брюшно-промежностная экстирпация прямой кишки (операция Кеню-Майлса)
Операция заключается в удалении всей прямой кишки вместе с клетчаткой, регионарными лимфатическими узлами, дистальной частью сигмовидной кишки и наложении постоянного одноствольного противоестественного заднего прохода на переднюю брюшную стенку.Операция выполняется в два этапа из двух доступов — абдоминального и промежностного. Ее можно осуществить двумя бригадами, работающими синхронно, и одним хирургом, который последовательно оперирует сначала через абдоминальный, а затем промежностный доступ.
Начальные этапы операции описаны выше. После завершения мобилизации дистальной части сигмовидной кишки она подтягивается кверху. Пальпаторно определяется верхняя прямокишечная артерия у места ее от хождения от нижней брыжеечной артерии. Артерия и одноименная вена перевязывается и пересекаются (рис. 26.8).
Рис. 26.8. Перевязка верхней прямокишечной артерии и вены при брюшно-промежностной экстирпации прямой кишки
Затем осуществляется мобилизация прямой кишки с обеих сторон. Выделение ее производится частично тупым, частично острым путем. При этом параректальная клетчатка вместе с лимфатическими узлами должна смещаться от стенок таза к кишке.
Накладываются зажимы на боковые связки, в которых проходят средние прямокишечные артерии. Последние перевязываются и пересекаются. Дальнейшая мобилизация прямой кишки производится строго вдоль брюшинно-промежностного апоневроза (рис. 26.9).
Рис. 26.9. Мобилизация прямой кишки по передней стенке вдоль брюшинно-промежностоного апоневроза
Одна из двух пластинок этого апоневроза покрыват предстательную железу с семенными пузырьками и семявыносящими протоками (у мужчин) или влагалище (у женщин), а другая — переднюю стенку прямой кишки. Мобилизация передней стенки прямой кишки осуществляется до мышц диафрагмы таза мобилизацию боковых стенок прямой кишки осуществляют рассечением ножницами соединительнотканных связей. Мобилизацию прямой кишки следует считать завершенной, когда она выделена вместе с футляром, образованным собственной фасцией.
Вслед за этим этапом начинается промежностный этап. Толстой нитью зашивается заднепроходное отверстие и отступя от него на 1-2 см производится окаймляющий разрез кожи (рис. 26.10). На кожные края вокруг ануса накладываются дополнительные швы для большей герметизации просвета прямой кишки. Далее рассекаются подкожная клетчатка, волокна прямокишечно-копчиковой мышцы и заднепроходно-копчиковая связка. Выделяется в пределах фасции задняя стенка дистального отдела прямой кишки.
Рис. 26.10. Брюшно-промежностная экстирпация прямой кишки. Разрез на промежности. Наложены швы на кожные края раны
Мобилизацию передней стенки прямой кишки следует осуществлять ориентируясь у мужчин пальпаторно на катетер, введенный в мочеиспускательный канал. У женщин в связи с топографоанатомическими особенностями это сделать легче, особенно, если ввести палец во влагалище. Пересекается поперечная мышца промежности при этом следует также попасть между двумя листками брюшно-промежностного апоневроза. Остро и тупо постепенно прямая кишка полностью отделяется от мочеиспускательного канала (или влагалища) предстательной железы, семенных пузырьков.
После того, как достигается т. levator ani, в полость малого таза вводится рука и мышца подтягивается к средней линии. Ее волокна парциально пересекаются на зажимах и прошиваются (рис. 26.11), после чего заканчивается мобилизация прямой кишки со стороны промежности. После пересечения сигмовиднои кишки можно произвести удаление пораженной опухолью прямой кишки.
Рис. 26.11. Брюшно-промежностная экстирпация прямой кишки. Пересечение m.levator ani
Пересечение сигмовидной кишки удобно и асептично можно осуществить после прошивания остающегося и удаляемого отрезков с помощью аппарата УКЛ или УО. Аппарат снимают и оба конца кишки погружают кисетным швом. Через промежностную рану удаляют прямую кишку вместе с дистальной частью сигмовидной.
Если операция выполняется одной бригадой, то прежде, чем приступить к промежностному этапу, необходимо погрузить удаляемый отдел кишки в полость таза и зашить над ней тазовую брюшину После этого хирург осуществляет промежностный этап операции, а ассистент формирует одноствольную колостому.
После удаления прямой кишки осуществляют дополнительный гемостаз, полость таза промывают раствором антисептика, ушивают рану, дренируя через нее полость таза пресакрально введенной резиновой трубкой. Операцию завершают туалетом брюшной полости и ушиванием передней брюшной стенки.
Операция Гартмана. Обструктивная резекция прямой кишки
Сущность этой операции сводится к внутрибрюшному удалению пораженного отдела прямой кишки, ушиванию оставшейся части ее наглухо, восстановлению над ней целостности тазовой брюшины и формированию одноствольной колостомы. Мобилизация прямой кишки производится по описанной выше методике и в обозначенных ранее пределах: не менее 4-7 см дистальнее и 10-12 см проксимальнее опухоли. Остающаяся часть прямой кишки ушивается вручную или с помощью аппарата.Линию швов погружают полукисетными а затем отдельными узловыми швами. Черед промежностный разрез над копчиком область культи прямой кишки дренируется резиновой трубкой. Восстанавливается целостность тазовой брюшины. Формируется одноствольная колостома.
Брюшно-анальная резекция прямой кишки с низведением сигмовидной кишки
Начальные этапы этой операции такие же, как при брюшно-промежностной экстирпации прямой кишки. Кишку мобилизуют со стороны брюшной полости до мышц диафрагмы таза. При этом особенно важно сохранить хорошее кровоснабжеие сигмовидной кишки: сигмовидные артерии пересекаются непосредственно в месте их отхождения от нижней брыжеечной артерии.Достаточность кровоснабжения проверяется пережатием дуги Риолана на уровне предполагаемого пересечения сигмовидной кишки. При этом должна быть отчетливой пульсация последнего (краевого) прямого сосуда, питающего стенку кишки. Кроме того, сигмовидная кишка должна иметь достаточную длину Для проведения ее без натяжения через анальный канал.
Низводимая кишка должна без натяжения достигать уровня правого пахового сгиба. Если длина кишки недостаточна, необходимо дополнительно мобилизовать нисходящую ободочную кишку рассечением складки между париетальной и висцеральной брюшинной и селезеночный изгиб ободочной кишки.
Далее, если операция выполняется одной бригадой хирургов, сигмовидную кишку погружают в полость малого таза, маркировав специальной лигатурой ее дистальный конец в месте предполагаемого пересечения. Тазовую брюшину зашивают вокруг кишки. Затем выполняется промежностный этап.
Этот этап начинается с плавного пере-растяжения анального сфинктера. Ножницами рассекается слизистая оболочка прямой кишки по окружности выше гребежковой линии (рис. 26.12). По мере рассечения на низводимый отдел кишки проксимальнее линии рассечения слизистой оболочки накладывают 5-6 зажимов.
Потягивая за них, тупо пальцем проходят через толщу кишечной стенки и затем рассекают стенку кишки на уровне рассечения слизистой оболочки. Кишку с опухолью протягивают наружу через анальный канал до уровня маркированного лигатурой. Дистальную часть низведенной кишки с опухолью отсекают и удаляют (рис. 26.13).
Рис. 26.13. Брюшно-анальная резекция прямой кишки. Удаление прямой кишки
Низведенная сигмовидная кишка фиксируется или подшиванием по окружности к слизистой оболочке анального анала (рис. 26.14), или подшиванием к коже промежности 5-6 одиночными швами. Полость малого таза дренируется.
Рис. 26.14. Фиксация низведенной кишки швами со слизистой болонкой заднепроходного канала прямой кишки (а) и подшивание к коже промежности (б)
При двухбригадном методе оперирования схема операции несколько меняется. На сигмовидную кишку в месте намеченного пересечения накладываются маркировочные лигатуры. На прямую кишку на 4-7 см дистальнее опухоли накладывается Г-образный зажим. Обрабатывают антисептиком анальный канал. Сигмовидная кишка пересекается между лигатурами, а прямая — под наложенным зажимом. Удаляют пораженный отдел кишки. На конец оставленной сигмовидной кишки надевается резиновый колпачок (перчатка). Можно использовать аппаратный шов.
Хирург, оперирующий со стороны промежности, через перерастянутый анальный канал проводит в полость таза зажим Минулича, захватывает подготовленный для низведения конец сигмовидной кишки и выводит его наружу. Кишка подшивается к коже промежности. Первая бригада ушиват тазовую брюшину. Через пресакральное пространство вводится дренаж в полость малого таза. Избыток кишки отсекается через 3 недели после операции.
Яицкий Н.А., Седов В.М.
Опубликовал Константин Моканов
Рак прямой кишки
Вам поставили диагноз: рак прямой кишки?
Наверняка Вы задаётесь вопросом: что же теперь делать?
Подобный диагноз всегда делит жизнь на «до» и «после». Все эмоциональные ресурсы пациента и его родных брошены на переживания и страх. Но именно в этот момент необходимо изменить вектор «за что» на вектор «что можно сделать».
Очень часто пациенты чувствуют себя безгранично одинокими вначале пути. Но вы должны понимать — вы не одни. Мы поможем вам справиться с болезнью и будем идти с Вами рука об руку через все этапы вашего лечения.
Рак прямой кишки прогрессирует среди онкологических заболеваний. В 2017 году было выявлено 29918 новых случаев данного заболеваний у мужчин и у женщин в Российской Федерации. Смертность от этого заболевания также остаётся очень высокой. В 2017 году от этой локализации умерло 16360 человек.
Предлагаем Вашему вниманию краткий, но очень подробный обзор рака прямой кишки. Его подготовили высоко квалифицированные специалисты Абдоминального отделения МНИОИ имени П.А. Герцена – филиала ФГБУ «НМИЦ радиологии» Минздрава России.
Рак прямой кишки. Эпидемиология
Рак прямой кишки становится одной из наиболее распространенных форм злокачественных новообразований.
Эта тенденция за последние десятилетия все отчетливее проявляет себя во всех экономически развитых странах Европы и Северной Америки.
По данным одного из крупнейших исследований по эпидемиологии рака, World Cancer Report, заболеваемость раком прямой кишки стоит на третьем месте среди всех онкологических новообразований.

Анатомия прямой кишки
Прямая кишка (rectum) является дистальным отделом толстой кишки. Ее верхняя граница находится на уровне верхнего края 3-го крестцового позвонка , внизу прямая кишка переходит в анальный канал. Длина прямой кишки колеблется от 12 до 18 см, в месте перехода сигмовидной кишки в прямую ее диаметр составляет 3—4 см, ниже кишка значительно расширяется (ампула прямой кишки). Ампулу прямой кишки делят на верхний, средний и нижний отделы. Форма и ширина просвета ампулы во многом зависят от наполнения кишки. Верхний отдел прямой кишки расположен в брюшной полости, он смещен во фронтальной плоскости и располагается немного левее срединной линии, являясь как бы продолжением сигмовидной ободочной кишки.
Причины возникновения
1. Возраст старше 50 лет. Риск возникновения рака прямой кишки увеличивается с возрастом. Более 90 % случаев диагностируется у людей после 50 лет, причём он в равной степени касается мужчин и женщин. Риск развития рака прямой кишки удваивается с каждым прожитым десятилетием.
2. Наследственный фактор. Около 5% раков толстой кишки составляет наследственный рак, предрасположенность к которому передаётся по аутосомно-доминантному типу. Так, если риск возникновения рака толстой кишки у лиц, не имеющих предрасполагающих факторов, составляет 1–3%, то при его наличии у родственников первого порядка, риск повышается до 5%.
3. Генетические изменения. Изменения в определенных генах также повышают риск развития рака прямой кишки.
4. Наличие онкологического заболевания в прошлом. В некоторых случаях возможно повторное возникновение рака. К факторам риска также следует относить злокачественные опухоли других органов. Так, у женщин, имеющих рак молочной железы или репродуктивной системы, риск заболеть раком толстой кишки значительно увеличивается.
5. Хронические неспецифические воспалительные заболевания толстой кишки. У больных с хроническими воспалительными заболеваниями толстой кишки, особенно с язвенным колитом, частота возникновения колоректального рака значительно выше, чем в общей популяции.
6. Питание. Исследования показали, что прием пищи с высоким содержанием жиров, недостаток кальция, фолиевой кислоты и клетчатки, ограниченное количество фруктов и овощей увеличивает риск развития колоректального рака.
Классификация
В настоящее время рак прямой кишки классифицируют:
- — по стадии опухолевого процесса (TNM, Dukes, Dukes в модификации Aster et Coller)
- -по гистологической структуре опухоли
- — по типу роста опухоли.
Классификация TNM, 8-издание.
| Т | первичная опухоль |
| ТХ | первичный очаг невозможно выявить. |
| Т0 | отсутствие признаков первичной опухоли. |
| Tis | неинвазивный (карцинома in situ, внутриэпителиальный) рак (без прорастания собственной пластинки слизистой оболочки). Сюда относят и элементы опухоли в пределах кишечных желёз при отсутствии поражения мышечного слоя слизистой оболочки и подслизистого слоя. |
| Т1 | опухоль инфильтрирует подслизистый слой. |
| Т2 | прорастание собственной мышечной оболочки. |
| Т3 | опухоль прорастает субсерозный слой или неперитонизированные отделы стенки с выходом в прилежащую ткань (брыжейку ободочной кишки). |
| T4 | опухоль распространяется на соседние органы или структуры и/или прорастает висцеральную брюшину. |
| Т4а | опухоль прорастает висцеральную брюшину |
| Т4b | опухоль непосредственно прорастает другие органы и/или структуры |
| N | регионарные лимфатические узлы |
| NX | состояние регионарных зон оценить невозможно. |
| N0 | регионарных метастазов нет. |
| N1 | метастатическое поражение от 1 до 3 регионарных лимфоузлов; |
| N1a | в одном лимфоузле |
| N1b | в 2-3 лимфоузлах |
| N1c | опухолевые отсевы в субсерозном слое без наличия поражения лимфоузлов* |
| N2 | метастазы определяются в 4 и более регионарных ЛУ. |
| N2a | 4-6 поражённых лимфоузла |
| N2b | 7 и более поражённых лимфоузлов |
| М | отдалённые метастазы |
| Mx | отдалённые метастазы не могут быть подтверждены. |
| М0 | отдалённых метастазов нет. |
| M1a | поражение одного органа |
| M1b | поражение более одного органа или диссеминация по брюшине |
| M1c | Перитонеальные метастазы самостоятельные или с метастазами в другие органы или анатомические участки. |
| Duke`s А | рост опухоли ограничен стенкой кишки. |
| Duke`s В | опухоль распространена на окружающие ткани; метастазы в лимфатических узлах отсутствуют. |
| Duke`s С | опухоль с любой степенью местного распространения при наличии метастазов в регионарных лимфатических узлах. |
Международная гистологическая классификация
При разделении опухолей по гистологическому строению учитывается преобладание тканевой структуры паренхимы, характер клеточных элементов и их способность к секреции.
Ниже представлены четыре наиболее распространённые формы рака прямой кишки.
Аденокарцинома — наиболее часто встречаемая форма рака прямой кишки.
Выделяют три степени ее дифференцировки: высокодифференцированная; умеренно дифференцированная; низкодифференцированная.
Симптоматика
Клиническая картина рака прямой кишки находится в прямой зависимости от уровня расположения опухоли, характера ее роста, стадии заболевания. В начальных стадиях симптомокомплекс выражен слабо.
Выделяют несколько симптомокомплексов при раке прямой кишки. Наиболее частым являются патологические выделения из прямой кишки. Кровь темного цвета со сгустками выделяется до кала, во время тенезмов, или вне акта дефекации. Кроме крови при раке прямой кишки из заднего прохода может выделяться слизь. При распространенных формах и вовлечении в опухолевый процесс соседних органов и тканей возможно выделение гноя с калом.
Другим частым симптомокомплексом является нарушение функции толстой кишки. Характерным являются ложные позывы к дефекации – тенезмы. При тенезмах вместо кала выделяется кровь, слизь. При обтурации опухолью просвета кишки развивается запор. При этом изменяется вид кала – он становится лентовидный или «овечий». При вовлечении в процесс сфинктеров прямой кишки может развиться недержание.
Развитие болевого синдрома является характерным симптомом лишь при вовлечении в опухолевый процесс анального канала. Выше аноректальной линии болевых рецепторов в слизистой оболочке прямой кишки нет. Поэтому при ампулярном раке боль появляется в поздних стадиях, при прорастании опухолью соседних органов.
К неспецифическим клиническим проявлениям относится нарушение общего состояния пациента. Снижение массы тела, изменение цвета кожных покровов (бледный, землистый, иногда чуть желтушный) связано с хронической опухолевой интоксикацией. Анемия развивается из-за длительной кровопотери. Однако эти симптомы развиваются в поздних стадиях опухолевого процесса. Возникновение регионарных и отдаленных метастазов, как правило, изменение клинической картины не сопровождаются и специальной симптоматики не имеют.
Диагностика
Одним из основных методов обследования пациентов раком прямой кишки является пальцевое исследование прямой кишки и/или бидигитальное исследование через прямую кишку и влагалище (у женщин). При исследовании оценивается высота расположения нижнего полюса опухоли над уровнем аноректальной линии, протяженность и форму роста опухоли, состояние регионарных лимфатических узлов. При локализации нижнего полюса опухоли в верхне-среднеампулярных отделах прямой кишки необходимо выполнение ректороманоскопии. При этом удается осмотреть все отделы прямой кишки (до 25 см). Во время исследования проводится визуализация патологического процесса и объективизации данных пальцевого исследования. В ходе исследования, с целью определения гистологического строения первичной опухоли, производится забор материала для цитологического и/или гистологического исследования.
Колоноскопия выполняется с целью выявления патологических изменений толстой и прямой кишки проксимальнее опухоли.
Рентгенологическое исследование толстой и прямой кишок проводится методом трехэтапной ирригоскопии в прямой и боковой проекциях (полутугое-тугое наполнение, двойное контрастирование после опорожнения кишки, двойное контрастирование с нагнетанием воздуха). При исследовании оценивается протяженность опухолевого процесса и наличие сопутствующих заболеваний толстой кишки на участках, расположенных проксимальнее опухоли (синхронный рак, дивертикулез и др.).
Ультрасонография органов брюшной полости и малого таза позволяет оценить глубину инвазии первичной опухоли, вовлеченность в процесс соседних органов и тканей, наличие увеличенных регионарных лимфатических узлов, наличие отдаленных метастазов.
Рентгенологическое исследование органов грудной клетки в прямой и боковой проекции осуществлялось в условиях рентгенологического отделения на стандартном рентгенологическом оборудовании с целью выявления патологических изменений в легких и органах средостения.
КТ органов брюшной полости используют для диагностики наличия отдаленных метастазов.
МРТ органов малого таза следует выполнить для оценки вовлеченности смежных органов в опухолевый процесс. Также методика позволяет оценить латеральный клиренс распространения опухоли и поражение параректальных лимфатических узлов.
Определение уровня онкомаркёров. Наиболее часто используемые в практике при раке прямой кишки — раковоэмбриональный антиген (РЭА) и СА19-9. Маркеры неспецифичны и их концентрация не всегда коррелирует с распространённостью процесса и степенью дифференцировки опухоли, хотя чаще повышается при распространённом раке, особенно при метастазах в печени.
Лечение
Хирургический метод
Единственным радикальным методом лечения рака прямой кишки является хирургический. При локализации опухоли в нижнеампулярном отделе прямой кишки в стадии сT3-4 с поражением регионарных лимфатических узлов перед оперативным вмешательством, при отсутствии противопоказаний, возможно проведение предоперационной лучевой/химиолучевой терапии.
Выбор объема операции зависит от:
— Локализация опухоли
— степени распространенности опухолевого процесса
— общее состояние больного.
Для радикального удаления опухоли прямой кишки при ее резекции необходимо отступать в проксимальном направлении от верхнего края новообразования на 12-15см, в дистальном до 2- 5см.
Лучевая / химиолучевая терапия
Основными задачами применения лучевой / химиолучевой терапия на дооперационном этапе при раке прямой кишки являются уменьшение распространенности опухолевого процесса и улучшение местного контроля.
При локализации опухоли в нижнеампулярном отделе прямой кишки, прорастанием всех слоев кишечной стенки и выходом в мезоректальную клетчатку, при наличии поражения регионарных лимфатических узлов, при отсутствии противопоказаний, всем пациентам на дооперационном этапе проводится предоперационная лучевая терапия.
Послеоперационное облучение призвано снизить частоту возникновения локальных рецидивов, особенно у пациентов с R1-R2 резекцией.
Лекарственная терапия
Цель адъювантной терапии после радикальной операции является уничтожение отдаленных микрометастазов, что приводит к увеличению общей и безрецидивной выживаемости. Вопрос о её назначении следует решать с учётом исходной стадии заболевания. Показанием для проведения адьювантной химиотерапии больным раком прямой кишки служит III стадии (Dukes C) опухолевого процесса.
Минимальный объем адъювантной химиотерапии включает в себя назначение фторпиримидинов, которые можно применять в различных вариантах: струйном (режим клиники Mayo, Roswell Park), инфузионном (режимы DeGramont, AIO) или пероральном (капецитабин).
Оптимальный объем адъювантной химиотерапии включает в себя комбинацию оксалиплатина с фторпиримидинами. Наиболее оптимальными являются режимы FOLFOX или XELOX.
Диспансерное наблюдение
Основной целью диспансерного наблюдение за пациентами, перенесших радикальное лечение по поводу рака прямой кишки, является ранняя диагностика рецидива и метастазов опухоли. Все больные, перенесшие оперативное вмешательство по поводу рака прямой кишки, должны находится под строгим динамическим контролем.
КОМПЛЕКСНОЕ ЛЕЧЕНИЕ РАКА ПРЯМОЙ КИШКИ
Комплексного лечения больных раком прямой кишки включает предоперационную лучевую терапию, хирургическое вмешательство и адъювантную химиотерапию. Использование подобного подхода позволяет снизить частоту местных рецидивов, увеличить 5-летнюю выживаемость, улучшить качество жизни больных раком прямой кишки. Комплексное лечение с предоперационной лучевой (химиолучевой) терапией и адъювантной полихимиотерапией показано при наличии прорастания опухоли за пределы стенки кишки либо при метастатическом поражении лимфатических узлов.
После завершения предоперационной лучевой терапии выполняют хирургический этап лечения. После завершения данного этапа и полной реабилитации пациента через 3-4 недели проводят адъювантную химиотерапию. Проведение адъювантной химиотерапии показано пациентам при III стадии рака прямой кишки, а также ее можно рассматривать у отдельных больных при II стадии и наличии высокого риска рецидива заболевания.
ФГБУ «НМИЦ радиологии Минздрава России обладает всем спектром методик проведения комплексного лечения у больных раком прямой кишки, что позволяет достигнуть таких же результатов лечения пациентов, как в ведущих мировых клиниках.
НЕРВОСБЕРЕГАЮЩИЕ ОПЕРАЦИИ
Наряду с усовершенствованием методики и техники операций, обеспечивающих радикальность оперативного вмешательства, в последнее время все большее внимание уделяется разработке комплекса мер, направленных на профилактику ранних и отсроченных осложнений, в частности, проблеме послеоперационной мочеполовой дисфункции у оперированных больных. По данным разных авторов частота нарушения функции мочевого пузыря в послеоперационном периоде может достигать 40% и более. Основными признаками нарушения уродинамики являются: увеличение емкости мочевого пузыря, увеличение остаточного объема мочи, ослабление чувства наполнения пузыря, снижение внутрипузырного давления и другие. Все это зачастую приводит к необходимости больным производить самокатетеризацию мочевого пузыря или постановке постоянного катетера.
Указанные осложнения снижают качество жизни, а также социальную, психо-эмоциональную и семейную реабилитацию у оперированных больных. Одной из причин развития подобного рода осложнений является травма нервных стволов, отвечающих за иннервацию мочевого пузыря.
В ФГБУ «НМИЦ радиологии Минздрава России используется техника нервосберегающих операций при раке нижне — и среднеампулярного отделов прямой кишки, которая включает в себя выполнение стандартного хирургического вмешательства с использованием приемов, направленных на максимально возможное сохранение элементов вегетативной нервной системы таза.
СФИНКТЕРОСОХРАНЯЮЩИЕ ОПЕРАЦИИ
Стремление любого онкопроктолога при вмешательствах на прямой кишке направлено с одной стороны на попытку улучшения онкологических результатов лечения, а с другой – выполнение органосохраняющих операций, что позволило бы улучшить качество жизни пациентов. В связи с этим, на протяжении долгого времени, не ослабевает интерес к определению оптимальной дистальной линии резекции, разработке подходов, обеспечивающих сохранение интактных от опухолевого процесса тканей, и вместе с тем расширению объема оперативного вмешательства с целью максимально возможной санации тканей с высоким риском опухолевого поражения.
До настоящего времени, во многих медицинских учреждениях, единственным радикальным оперативным вмешательством при раке средне- и нижнеампулярного отдела считалось выполнение брюшно-промежностной экстирпации прямой кишки с формированием противоестественного заднего прохода на передней брюшной стенки. Однако, многочисленные исследования, проведенные как в России, так и за рубежом, показали, что при определенных показаниях, возможно сохранение сфинктерного аппарата прямой кишки, что позволяет в последующем сохранить естественный пассаж по кишечнику у оперированных пациентов.
ФГБУ «НМИЦ радиологии Минздрава России в абдоминальной онкологии активно применяются современные методики оперативных вмешательств, направленные на сохранение «жома» прямой кишки, что позволяет улучшить качество жизни и психо-социальную адаптацию оперированных пациентов.
Филиалы и отделения Центра, в которых лечат рак прямой кишки
ФГБУ «НМИЦ радиологии» Минздрава России обладает всеми необходимыми технологиями лучевого, химиотерапевтического и хирургического лечения, включая расширенные и комбинированные операции. Все это позволяет выполнить необходимые этапы лечения в рамках одного Центра, что исключительно удобно для пациентов. Однако надо помнить, что тактику лечения определяет консилиум врачей.
Рак прямой кишки можно лечить:
В Абдоминальном отделении МНИОИ имени П.А. Герцена – филиала ФГБУ «НМИЦ радиологии» Минздрава России
Заведующий отделения – д.м.н. Дмитрий Владимирович Сидоров.
Контакты: (495) 150 11 22
В Отделении лучевого и хирургического лечения заболеваний абдоминальной области МРНЦ имени А.Ф. Цыба — филиала ФГБУ «НМИЦ радиологии» Минздрава России
Заведующий отделением — к.м.н. Леонид Олегович Петров
Контакты: (484) 399-30-08
