Тема №26 «Углеводы: моносахариды, дисахариды, полисахариды»
- НОВОСТИ
- КУРС ХИМИИ
- Дополнительные уроки
- Курс химии
- Разбор заданий ЕГЭ
- ТЕСТЫ
- Вариаты ЕГЭ
- Тесты по заданиям
- Тесты по темам
- СТАТЬИ
- ОПЫТЫ
- ТАБЛИЦА МЕНДЕЛЕЕВА
Поиск
 CHEM-MIND.com
CHEM-MIND.com


- НОВОСТИ
-
 Новости
НовостиАлгоритм обучения для подготовки к ЕГЭ по химии
 Новости
НовостиОтветы в тестах вновь правильно отображаются!
 Новости
НовостиТехнические проблемы
 Новости
НовостиНовый раздел на сайте
 Новости
НовостиС 8 марта
-
- КУРС ХИМИИ
Углеводы — Википедия
Углево́ды — органические вещества, содержащие карбонильную группу и несколько гидроксильных групп[1]
Сахара́ — другое название низкомолекулярных углеводов: моносахаридов, дисахаридов и олигосахаридов.
Углеводы являются неотъемлемым компонентом клеток и тканей всех живых организмов представителей растительного и животного мира, составляя (по массе) основную часть органического вещества на Земле. Источником углеводов для всех живых организмов является процесс фотосинтеза, осуществляемый растениями.
Углеводы — весьма обширный класс органических соединений, среди них встречаются вещества с сильно различающимися свойствами. Это позволяет углеводам выполнять разнообразные функции в живых организмах. Соединения этого класса составляют около 80 % сухой массы растений и 2—3 % массы животных [1].
Все углеводы состоят из отдельных «единиц», которыми являются сахариды. По способности к гидролизу на мономеры углеводы делятся на две группы: простые и сложные. Углеводы, содержащие одну единицу, называются моносахариды, две единицы — дисахариды, от двух до десяти единиц — олигосахариды, а более десяти — полисахариды. Моносахариды быстро повышают содержание сахара в крови и обладают высоким гликемическим индексом, поэтому их ещё называют быстрыми углеводами. Они легко растворяются в воде и синтезируются в зелёных растениях. Углеводы, состоящие из 3 или более единиц, называются сложными. Продукты, богатые сложными углеводами, постепенно повышают содержание глюкозы и имеют низкий гликемический индекс, поэтому их ещё называют медленными углеводами. Сложные углеводы являются продуктами поликонденсации простых сахаров (моносахаридов) и, в отличие от простых, в процессе гидролитического расщепления способны распадаться на мономеры с образованием сотен и тысяч молекул моносахаридов.
Моносахариды[править | править код]
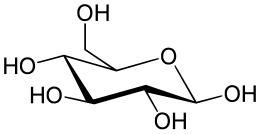 Распространённый в природе моносахарид — бета-D-глюкоза.
Распространённый в природе моносахарид — бета-D-глюкоза.Моносахари́ды (от др.-греч. μόνος ‘единственный’, лат. saccharum ‘сахар’ и суффикса -ид) — простейшие углеводы, не гидролизующиеся с образованием более простых углеводов — обычно представляют собой бесцветные, легко растворимые в воде, плохо — в спирте и совсем нерастворимые в эфире, твёрдые прозрачные органические соединения[2], одна из основных групп углеводов, самая простая форма сахара. Водные растворы имеют нейтральный pH. Некоторые моносахариды обладают сладким вкусом. Моносахариды содержат карбонильную (альдегидную или кетонную) группу, поэтому их можно рассматривать как производные многоатомных спиртов. Моносахарид, у которого карбонильная группа расположена в конце цепи, представляет собой альдегид и называется альдоза. При любом другом положении карбонильной группы моносахарид является кетоном и называется кетоза. В зависимости от длины углеродной цепи (от трёх до десяти атомов) различают триозы, тетрозы, пентозы, гексозы, гептозы и так далее. Среди них наибольшее распространение в природе получили пентозы и гексозы[2]. Моносахариды — стандартные блоки, из которых синтезируются дисахариды, олигосахариды и полисахариды.
В природе в свободном виде наиболее распространена D-глюкоза (C6H12O6) — структурная единица многих дисахаридов (мальтозы, сахарозы и лактозы) и полисахаридов (целлюлоза, крахмал). Другие моносахариды, в основном, известны как компоненты ди-, олиго- или полисахаридов и в свободном состоянии встречаются редко. Природные полисахариды служат основными источниками моносахаридов[2].
Дисахариды[править | править код]

Дисахари́ды (от др.-греч. δία ‘два’, лат. saccharum ‘сахар’ и суффикса -ид) — сложные органические соединения, одна из основных групп углеводов, при гидролизе каждая молекула распадается на две молекулы моносахаридов, являются частным случаем олигосахаридов. По строению дисахариды представляют собой гликозиды, в которых две молекулы моносахаридов соединены друг с другом гликозидной связью, образованной в результате взаимодействия гидроксильных групп (двух полуацетальных или одной полуацетальной и одной спиртовой). В зависимости от строения дисахариды делятся на две группы: восстанавливающие и невосстанавливающие. Например, в молекуле мальтозы у второго остатка моносахарида (глюкозы) имеется свободный полуацетальный гидроксил, придающий данному дисахариду восстанавливающие свойства. Дисахариды наряду с полисахаридами являются одним из основных источников углеводов в рационе человека и животных[3]
.Олигосахариды[править | править код]
О́лигосахари́ды (от греч. ὀλίγος — немногий) — углеводы, молекулы которых синтезированы из 2—10 остатков моносахаридов, соединённых гликозидными связями. Соответственно различают: дисахариды, трисахариды и так далее[3]. Олигосахариды, состоящие из одинаковых моносахаридных остатков, называют гомополисахаридами, а из разных — гетерополисахаридами. Наиболее распространены среди олигосахаридов дисахариды.
Среди природных трисахаридов наиболее распространена рафиноза — невосстанавливающий олигосахарид, содержащий остатки фруктозы, глюкозы и галактозы — в больших количествах содержится в сахарной свёкле и во многих других растениях[3].
Полисахариды[править | править код]
Полисахари́ды — общее название класса сложных высокомолекулярных углеводов, молекулы которых состоят из десятков, сотен или тысяч мономеров — моносахаридов. С точки зрения общих принципов строения в группе полисахаридов возможно различить гомополисахариды, синтезированные из однотипных моносахаридных единиц и гетерополисахариды, для которых характерно наличие двух или нескольких типов мономерных остатков
Гомополисахариды (гликаны), состоящие из остатков одного моносахарида, могут быть гексозами или пентозами, то есть в качестве мономера может быть использована гексоза или пентоза. В зависимости от химической природы полисахарида различают глюканы (из остатков глюкозы), маннаны (из маннозы), галактаны (из галактозы) и другие подобные соединения. К группе гомополисахаридов относятся органические соединения растительного (крахмал, целлюлоза, пектиновые вещества), животного (гликоген, хитин) и бактериального (декстраны) происхождения[2].
Полисахариды необходимы для жизнедеятельности животных и растительных организмов. Это один из основных источников энергии организма, образующейся в результате обмена веществ. Полисахариды принимают участие в иммунных процессах, обеспечивают сцепление клеток в тканях, являются основной массой органического вещества в биосфере.
Крахма́л (C6H10O5)n — смесь двух гомополисахаридов: линейного — амилозы и разветвлённого — амилопектина, мономером которых является альфа-глюкоза. Белое аморфное вещество, не растворимое в холодной воде, способное к набуханию и частично растворимое в горячей воде[2]. Молекулярная масса 105—107 Дальтон. Крахмал, синтезируемый разными растениями в хлоропластах, под действием света при фотосинтезе, несколько различается по структуре зёрен, степени полимеризации молекул, строению полимерных цепей и физико-химическим свойствам. Как правило, содержание амилозы в крахмале составляет 10—30 %, амилопектина — 70—90 %. Молекула амилозы содержит в среднем около 1000 остатков глюкозы, связанных между собой альфа-1,4-связями. Отдельные линейные участки молекулы амилопектина состоят из 20—30 таких единиц, а в точках ветвления амилопектина остатки глюкозы связаны межцепочечными альфа-1,6-связями. При частичном кислотном гидролизе крахмала образуются полисахариды меньшей степени полимеризации — декстрины (C
 Структура гликогена
Структура гликогенаГликоге́н (C6H10O5)n — полисахарид, построенный из остатков альфа-D-глюкозы — главный резервный полисахарид высших животных и человека, содержится в виде гранул в цитоплазме клеток практически во всех органах и тканях, однако, наибольшее его количество накапливается в мышцах и печени. Молекула гликогена построена из ветвящихся полиглюкозидных цепей, в линейной последовательности которых, остатки глюкозы соединены посредством альфа-1,4-связями, а в точках ветвления межцепочечными альфа-1,6-связями. Эмпирическая формула гликогена идентична формуле крахмала. По химическому строению гликоген близок к амилопектину с более выраженной разветвлённостью цепей, поэтому иногда называется неточным термином «животный крахмал». Молекулярная масса 105—108 Дальтон и выше[4]. В организмах животных является структурным и функциональным аналогом полисахарида растений — крахмала. Гликоген образует энергетический резерв, который при необходимости восполнить внезапный недостаток глюкозы может быть быстро мобилизован — сильное разветвление его молекулы ведёт к наличию большого числа концевых остатков, обеспечивающих возможность быстрого отщепления нужного количества молекул глюкозы[2]. В отличие от запаса триглицеридов (жиров) запас гликогена не настолько ёмок (в калориях на грамм). Только гликоген, запасённый в клетках печени (гепатоцитах) может быть переработан в глюкозу для питания всего организма, при этом гепатоциты способны накапливать до 8 процентов своего веса в виде гликогена, что является максимальной концентрацией среди всех видов клеток. Общая масса гликогена в печени взрослых может достигать 100—120 граммов. В мышцах гликоген расщепляется на глюкозу исключительно для локального потребления и накапливается в гораздо меньших концентрациях (не более 1 % от общей массы мышц), тем не менее общий запас в мышцах может превышать запас, накопленный в гепатоцитах.
Целлюло́за (клетча́тка) — наиболее распространённый структурный полисахарид растительного мира, состоящий из остатков альфа-глюкозы, представленных в бета-пиранозной форме. Таким образом, в молекуле целлюлозы бета-глюкопиранозные мономерные единицы линейно соединены между собой бета-1,4-связями. При частичном гидролизе целлюлозы образуется дисахарид целлобиоза, а при полном — D-глюкоза. В желудочно-кишечном тракте человека целлюлоза не переваривается, так как набор пищеварительных ферментов не содержит бета-глюкозидазу. Тем не менее, наличие оптимального количества растительной клетчатки в пище способствует нормальному формированию каловых масс[4]. Обладая большой механической прочностью, целлюлоза выполняет роль опорного материала растений, например, в составе древесины её доля варьирует от 50 до 70 %, а хлопок представляет собой практически стопроцентную целлюлозу[2].
Хити́н — структурный полисахарид низших растений, грибов и беспозвоночных животных (в основном роговые оболочки членистоногих — насекомых и ракообразных). Хитин, подобно целлюлозе в растениях, выполняет опорные и механические функции в организмах грибов и животных. Молекула хитина построена из остатков N-ацетил-D-глюкозамина, связанных между собой бета-1,4-гликозидными связями. Макромолекулы хитина неразветвлённые и их пространственная укладка не имеет ничего общего с целлюлозой[2].
Пекти́новые вещества́ — полигалактуроновая кислота, содержится в плодах и овощах, остатки D-галактуроновой кислоты связаны альфа-1,4-гликозидными связями. В присутствии органических кислот способны к желеобразованию, применяются в пищевой промышленности для приготовления желе и мармелада. Некоторые пектиновые вещества оказывают противоязвенный эффект и являются активной составляющей ряда фармацевтических препаратов, например, производное подорожника «плантаглюцид»[2].
Мурами́н (лат. múrus — стенка) — полисахарид, опорно-механический материал клеточной стенки бактерий. По химическому строению представляет собой неразветвлённую цепь, построенную из чередующихся остатков N-ацетилглюкозамина и N-ацетилмурамовой кислоты, соединённых бета-1,4-гликозидной связью. Мурамин по структурной организации (неразветвлённая цепь бета-1,4-полиглюкопиранозного скелета) и функциональной роли весьма близок к хитину и целлюлозе[2].
Декстра́ны — полисахариды бактериального происхождения — синтезируются в условиях промышленного производства микробиологическим путём (воздействием микроорганизмов Leuconostoc mesenteroides на раствор сахарозы) и используются в качестве замените
Глюкоза — Википедия
| Глюкоза[1] | |
|---|---|
 | |
| Систематическое наименование | (2R,3S,4R,5R)-2,3,4,5,6-пентагидроксигексаналь (D-глюкоза), (2S,3R,4S,5S)-2,3,4,5,6-пентагидроксигексаналь (L-глюкоза) |
| Традиционные названия | Глюкоза, декстроза |
| Хим. формула | C6H12O6 |
| Состояние | бесцветные кристаллы |
| Молярная масса | 180,16 г/моль |
| Плотность | 1,5620 г/см³ |
| Температура | |
| • плавления | α-D-глюкоза: 146 °C (моногидрат: 83 °C) β-D-глюкоза: 148–150 °C |
| Растворимость | |
| • в воде | 82 г/100 мл |
| • в 80 % этаноле | 2 г/100 мл |
| Вращение [α]D{\displaystyle [\alpha ]_{D}} | α-D-глюкоза: +112,2° β-D-глюкоза: +18,7° |
| Дипольный момент | 14,1 Д |
| Рег. номер CAS | 50-99-7 (D-глюкоза) 921-60-8 (L-глюкоза) |
| PubChem | 24895228 |
| Рег. номер EINECS | 200-075-1 |
| SMILES | |
| RTECS | LZ6600000 |
| ChEBI | 17234 |
| NFPA 704 |  |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |
Глюко́за, или виноградный сахар, или декстроза (D-глюкоза), C6H12O6 — органическое соединение, моносахарид (шестиатомный гидроксиальдегид, гексоза), один из самых распространённых источников энергии в живых организмах на планете[2]. Встречается в соке многих фруктов и ягод, в том числе и винограда, от чего и произошло название этого вида сахара. Глюкозное звено входит в состав полисахаридов (целлюлоза, крахмал, гликоген) и ряда дисахаридов (мальтозы, лактозы и сахарозы), которые, например, в пищеварительном тракте быстро расщепляются на глюкозу и фруктозу.
Вероятно, глюкоза известна человеку с древних времён, поскольку она кристаллизуется из мёда. Однако в чистом виде её выделили гораздо позже: немецкий химик Андреас Маргграф получил её в 1747 году из виноградного сока. Жозеф Луи Пруст в 1801 году осадил кристаллы α-D-глюкозы из того же виноградного сока. Благодаря этим экспериментам за глюкозой закрепилось название виноградного сахара[3].
Использование глюкозы в качестве подсластителя связано с тем, что во время Наполеоновских войн были заблокированы поставки тростникового сахара из Вест-Индии. Ещё в 1000 году до н. э. в Китае из крахмала (ферментацией риса) получали искусственный подсластитель — дисахарид мальтозу. К концу XVIII в. в Европе было известно, что крахмал можно обработать кислотой и получить сладкое вещество. Именно это позволило К. С. Кирхгофу нагреванием картофельного крахмала с серной кислотой получить сладкое сиропообразное вещество. В результате оптимизации процесса он получил сироп, который кристаллизовался при стоянии. Кроме того, была предпринята попытка прессовать получаемую массу в твёрдый продукт и в таком виде продавать. Однако организовать производство не удалось, поскольку Наполеон потерпел поражение и поставки сахара были восстановлены[3].
Процесс получения глюкозы исследовал французский химик Соссюр. Он выяснил, что крахмал подвергается гидролизу, при котором разрушаются связи между углеводными фрагментами, причём на каждый разрыв расходуется по одной молекуле воды. Также было обнаружено, что конфеты, производимые из сиропов глюкозы, не такие сладкие, как те, что получают из сахарозы. Поэтому в Германии и других странах Европы было организовано производство глюкозы[3].
В то время промышленная глюкоза была недостаточно чистой и получалась в виде сиропов. Её приходилось многократно кристаллизовать из воды или использовать органические растворители. Единственной твёрдой формой, которую выпускали в большом количестве, была литая глюкоза: сироп заливали в формы, где он затвердевал[3].
В 1923 году в США Уильям Б. Ньюкирк (англ. William B. Newkirk) запатентовал промышленный способ получения глюкозы. Этот способ отличался тщательным контролем условий кристаллизации, благодаря чему глюкоза выпадала из раствора в виде чистых, крупных кристаллов[3].
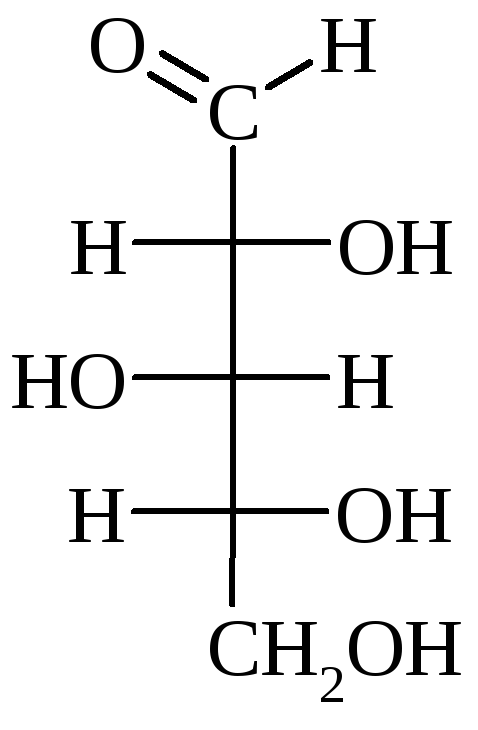
Глюкоза принадлежит к классу альдогексоз, то есть является полигидроксиальдегидом, содержащим шесть атомов углерода, альдегидную группу и пять гидроксильных групп. Четыре атома углерода в её структуре являются хиральными, поэтому существует 16 стереоизомерных альдогексоз: некоторые встречаются в природе, некоторые получены синтетически. Конкретную конфигурацию хиральных центров глюкозы в конце XIX в. установил немецкий химик Эмиль Фишер. Он сделал это при помощи реакций наращивания и деградации углеродной цепи сахаров. Наряду с наиболее распространённым в природе моносахаридом D-глюкозой существует также её энантиомер L-глюкоза,который в природе практически не встречается[4][5].
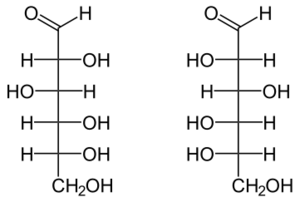 D-глюкоза (слева) и L-глюкоза (справа)
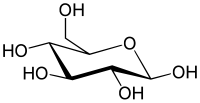
D-глюкоза (слева) и L-глюкоза (справа)Часто D-глюкозу изображают в линейной форме, однако в действительности D-глюкоза существует в циклической форме, образованной в результате присоединения ОН-группы при углероде С-5 к альдегидной группе. Образующийся при этом циклический полуацеталь устойчив: в растворах и кристаллической форме D-глюкоза более чем на 99 % находится в форме полуацеталя. В общем такую форму называют пиранозной (от названия пирана — шестичленного гетероцикла с одним атомом кислорода), а циклическую D-глюкозу называют D-глюкопиранозой[6].
При описанной циклизации возникает новый стереоцентр при полуацетальном атоме углерода, поэтому D-глюкопираноза может существовать в виде двух диастереомеров, называемых аномерами: α-D-глюкопиранозы и β-D-глюкопиранозы (или кратко: α-D-глюкозы и β-D-глюкозы; α-аномера и β-аномера). Изображать циклические формы углеводов удобно при помощи проекций Хеуорса — идеализированных шестичленных циклов с заместителями над и под плоскостью цикла[6][5].
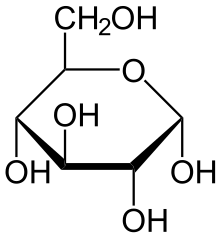 α-D-Глюкопираноза α-D-Глюкопираноза | 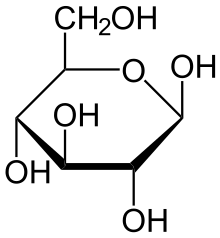 β-D-Глюкопираноза β-D-Глюкопираноза |
Наиболее близко к истине структуру молекулы глюкозы можно изобразить, используя конформацию «кресло». В таком представлении все гидроксильные группы D-глюкопиранозы находятся в экваториальных положениях (кроме аномерной, которая может находиться в экваториальном либо аксиальном положении в зависимости от аномера). Экваториальные положения более выгодны по сравнению с аксиальными: это объясняет, почему глюкоза является наиболее распространённым моносахаридом[6].
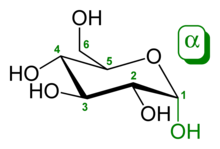 α-D-Глюкопираноза α-D-Глюкопираноза |  β-D-Глюкопираноза β-D-Глюкопираноза |
В растворах α-D-глюкопираноза и β-D-глюкопираноза существуют в равновесии и взаимопревращаются через образование открытоцепной формы. Равновесная доля α-аномера при 31 °С составляет 38 %, а более устойчивого β-аномера — 62 %[7]. Чистые аномеры можно получить в кристаллическом виде: α-аномер кристаллизуется из воды в виде моногидрата, а β-аномер кристаллизуется из пиридина[8].
Глюкоза — бесцветное кристаллическое вещество без запаха. Обладает сладким вкусом. D-глюкоза представлена в виде трёх кристаллических форм: безводной α-D-глюкопиранозы, моногидрата α-D-глюкопиранозы и безводной β-D-глюкопиранозы (хотя описан также моногидрат β-D-глюкопиранозы). Безводные формы имеют орторомбические кристаллы, а гидрат — моноклинные[7]. Все три формы отличаются температурой плавления: α-аномер плавится при 146 °С, его моногидрат — при 83 °С, β-аномер — при 148–150 °С[8].
Аномеры D-глюкопиранозы оптически активны: удельное вращение α-аномера составляет +112,2°, β-аномера — +18,9°[8]. Оба аномера при растворении претерпевают мутаротацию, то есть превращаются в равновесную смесь, состоящую из 62 % β-аномера и 38 % α-аномера[7]. Удельное вращение этой смеси составляет +52,7°[8].
Производство глюкозных сиропов[править | править код]
Кислотный гидролиз крахмала[править | править код]
Единственным сырьём для производства глюкозы является крахмал, хотя делаются попытки использовать другой природный полимер глюкозы — целлюлозу. Основным источником крахмала является кукуруза: 100 % глюкозных подсластителей в США и 84 % в Японии производят из кукурузного крахмала. Также 70 % производимой в мире кукурузы идёт на производство глюкозы. В Европе постепенно возрастает использование пшеничного крахмала, хотя в основном используется также кукурузный крахмал. В Австралии глюкозу получают только из пшеничного крахмала. В Азии используют крахмал из саго, тапиоки и кукурузы[9].
Для получения глюкозы крахмал гидролизуют в присутствии кислот или ферментов. При этом происходит разрыв связей между глюкозными звеньями полимерных амилозы и амилопектина — компонентов крахмала — и образуется мономер (D-глюкоза) с некоторым содержанием димеров: мальтозы и изомальтозы. Для кислотного гидролиза готовят суспензию крахмала в воде (30-40 мас. %) и доводят pH до 2 или ниже. При атмосферном давлении кислотный гидролиз протекает 6 ч, однако современные установки позволяют проводить процесс при повышенном давлении и, соответственно, более высокой температуре. При давлении 415–620 кПа и температуре до 160 °С крахмал гидролизуется в течение нескольких минут. Останавливают реакцию добавлением нейтрализующего реагента (обычно карбоната натрия), и pH повышается до 4-5,5[10].
После гидролиза нерастворимые примеси, которые изначально присутствовали в крахмале, отделяют центрифугированием или фильтрованием, а растворимые примеси удаляют активированным углём и ионообменными смолами. Смолы также позволяют обесцветить полученную глюкозу. Конечный раствор упаривают. Большинство глюкозных сиропов продают в виде 70-85 % растворов, хотя их можно упарить и до твёрдого состояния[10].
Глюкозные сиропы отличаются по степени гидролиза крахмала: её оценивают по количеству присутствующих в конечном продукте
| Альдодиоза | 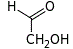 гликольальдегид | |||||||
| Альдотриоза | 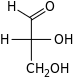 D-глицероза (глицераль) (D-глицеро-триоза) | |||||||
| Альдотетрозы | 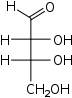 D-эритроза (D-эритро-тетроза) | 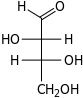 D-треоза (D-трео-тетроза) | ||||||
| Альдопентозы | 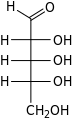 D-рибоза (D-рибо-пентоза) | 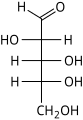 D-арабиноза (D-арабино-пентоза) | 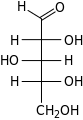 D-ксилоза (D-ксило-пентоза) | 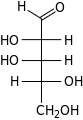 D-ликсоза (D-ликсо-пентоза) | ||||
| Альдогексозы |  D-аллоза (D-алло-гексоза) | 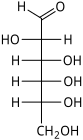 D-альтроза (D-альтро-гексоза) | 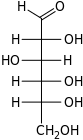 D-глюкоза (D-глюко-гексоза) | 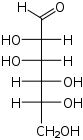 D-манноза (D-манно-гексоза) | 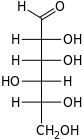 D-гулоза (D-гуло-гексоза) | 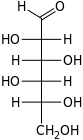 D-идоза (D-идо-гексоза) | 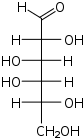 D-галактоза (D-галакто-гексоза) | 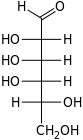 D-талоза (D-тало-гексоза) |
| Альдогептозы | 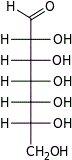 D-глицеро- D-аллогептоза | 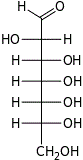 D-глицеро- D-альтрогептоза | 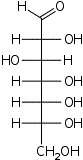 D-глицеро- D-глюкогептоза | 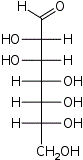 D-глицеро- D-манногептоза | 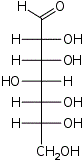 D-глицеро- D-гулогептоза |  D-глицеро- D-идогептоза | 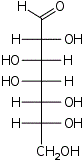 D-глицеро- D-галактогептоза | 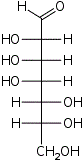 D-глицеро- D-талогептоза |
 D-глицеро- L-аллогептоза | 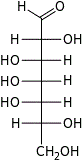 D-глицеро- L-альтрогептоза | 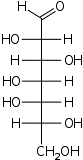 D-глицеро- L-глюкогептоза | 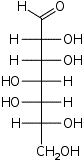 D-глицеро- L-манногептоза | 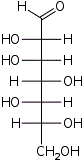 D-глицеро- L-гулогептоза | 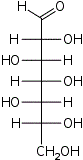 D-глицеро- L-идогептоза | 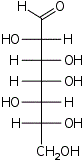 D-глицеро- L-галактогептоза | 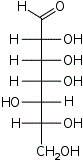 D-глицеро- L-талогептоза | |
| Альдооктозы |  D-эритро- D-аллооктоза | 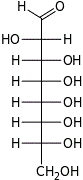 D-эритро- D-альтрооктоза | 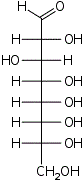 D-эритро- D-глюкооктоза | 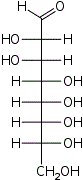 D-эритро- D-маннооктоза | 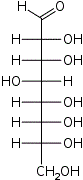 D-эритро- D-гулооктоза | 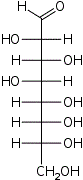 D-эритро- D-идооктоза | 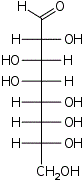 D-эритро- D-галактооктоза | 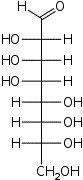 D-эритро- D-талооктоза |
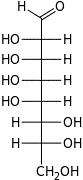 D-эритро- L-аллооктоза | 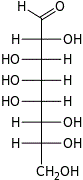 D-эритро- L-альтрооктоза | 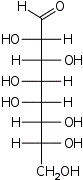 D-эритро- L-глюкооктоза | 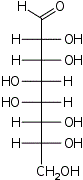 D-эритро- L-маннооктоза | 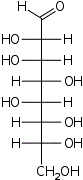 D-эритро- L-гулооктоза | 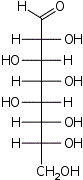 D-эритро- L-идооктоза | 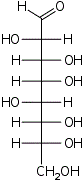 D-эритро- L-галактооктоза | 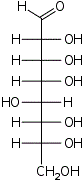 D-эритро- L-талооктоза | |
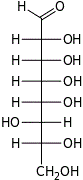 D-трео- D-аллооктоза | 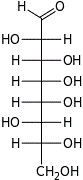 D-трео- D-альтрооктоза | 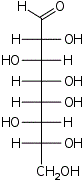 D-трео- D-глюкооктоза | 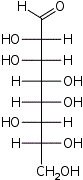 D-трео- D-маннооктоза | 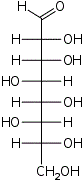 D-трео- D-гулооктоза | 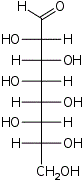 D-трео- D-идооктоза | 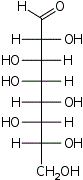 D-трео- D-галактооктоза | 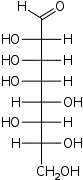 D-трео- D-талооктоза | |
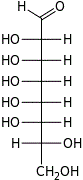 D-трео- L-аллооктоза | 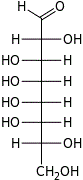 D-трео- L-альтрооктоза | 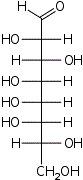 D-трео- L-глюкооктоза | 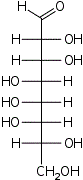 D-трео- L-маннооктоза | 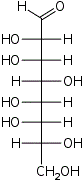 D-трео- L-гулооктоза | 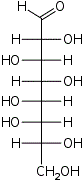 D-трео- L-идооктоза | 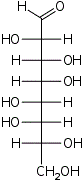 D-трео- L-галактооктоза | 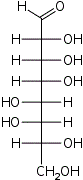 D-трео- L-талооктоза | |
Дисахариды — Википедия
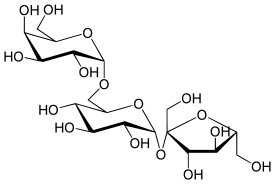
Дисахариды (от др. греч. δύο — два и σάκχαρον — сахар) — органические соединения, одна из основных групп углеводов; являются частным случаем олигосахаридов.
Молекулы дисахаридов состоят из двух остатков моносахаридов, соединённых друг с другом за счёт взаимодействия гидроксильных групп (двух полуацетальных или одной полуацетальной и одной спиртовой) — гликозидной связи. Общая формула дисахаридов, как правило, C12H22O11.
- Мальтоза — состоит из двух остатков глюкозы.
Дисахариды — твёрдые, кристаллические вещества, от слегка белого до коричневатого цвета, хорошо растворимые в воде и в 45 — 48°-градусном спирте, плохо растворимы в 96-градусном спирте, имеют оптическую активность; сладкие на вкус[1].
По химическим свойствам дисахариды можно разделить на две группы:
- восстанавливающие;
- не восстанавливающие.
К первой группе относятся: лактоза, мальтоза, целлобиоза. Ко второй: сахароза, трегалоза[2].
Восстанавливающие (редуцирующие) дисахариды[править | править код]
В данных дисахаридах один из моносахаридных остатков участвует в образовании гликозидной связи за счёт гидроксильной группы чаще всего при С-4 или С-6, реже при С-3. В дисахариде имеется свободная полуацетальная гидроксильная группа, вследствие чего сохраняется способность к раскрытию цикла. Возможностью осуществления цикло-оксо-таутометрии (кольчато-цепной) обусловлены восстановительные свойства таких дисахаридов и мутаротация их свежеприготовленных растворов[3].
Лактоза[править | править код]
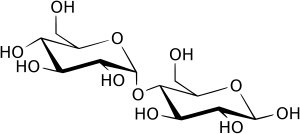
Лактоза (от лат. lac — молоко) C12H22O11 — углевод группы дисахаридов, содержится в молоке и молочных продуктах. Молекула лактозы состоит из остатков молекул β- глюкозы и β-галактозы, которые соединены между собой β(1→4)-гликозидной связью. Водные растворы лактозы мутаротируют. Вступает в реакцию с фелинговой жидкостью только после кипячения в течение 15 минут[4] и реактивом Толленса, реагирует с фенилгидразином, образуя озазон. Лактоза отличается от других дисахаридов отсутствием гигроскопичности — она не отсыревает. Это её свойство имеет большое практическое значение в фармации: если нужно приготовить с сахаром какой-либо порошок, содержащий легко гидролизующееся лекарство, то берут молочный сахар; если же взять другой сахар, то он быстро отсыреет и легко гидролизующееся лекарственное вещество быстро разложится. Значение лактозы очень велико, так как она является важным питательным веществом, особенно для растущих организмов человека и млекопитающих[5].
Мальтоза[править | править код]
Мальтоза (от лат. maltum — солод) C12H22O11 — дисахарид, состоящий из двух остатков глюкозы; содержится в больших количествах в проросших зёрнах (солоде) ячменя, ржи и других зерновых; обнаружен также в томатах, в пыльце и нектаре ряда растений. Мальтоза относится к восстанавливающим сахарам, восстанавливает фелингову жидкость, даёт гидразон и озазон и может быть окислена в одноосновную мальтобионовую кислоту, которая при гидролизе даёт α-D-глюкозу и D-глюконовую кислоту. Мальтоза была синтезирована действием мальтазы (энзима дрожжей) на концентрированные растворы глюкозы. Для неё характерно явление мутаротации, сильно вращает плоскость поляризации влево[5]. Мальтоза менее сладка, чем например сахароза, однако, она более чем в 2 раза слаще лактозы.
Целлобиоза[править | править код]
Целлобиоза 4-(β-глюкозидо)-глюкоза — дисахарид, состоящий из двух остатков глюкозы, соединённых β-гликозидной связью; основная структурная единица целлюлозы. Высшие животные не в состоянии усваивать целлюлозу, так как не обладают разлагающим её ферментом. Однако улитки, гусеницы и черви, содержащие ферменты целлобиазу и целлюлазу, способны расщеплять (и тем самым утилизовать) содержащие целлобиозу растительные остатки. Целлобиоза, как и лактоза, имеет 1→4 β-гликозидную связь и является восстанавливающим дисахаридом, но в отличие от лактозы при полном гидролизе даёт только β-D-глюкозу[6].
Невосстанавливающие (нередуцирующие) дисахариды[править | править код]
Невосстанавливающие дисахариды не имеют ОН-группы ни при одном аномерном центре, в результате чего, они не вступают в реакции с фелинговой жидкостью и реактивом Толленса.
Сахароза
Трегалоза
Дисахариды широко распространены в животных и растительных организмах. Они встречаются в свободном состоянии (как продукты биосинтеза или частичного гидролиза полисахаридов), а также как структурные компоненты гликозидов и других соединений. Многие дисахариды получают из природных источников, так, например, для сахарозы основными источниками служат либо сахарная свёкла, либо сахарный тростник.
- Энергетическая — дисахариды (сахароза, мальтоза) служат источниками глюкозы для организма человека, сахароза к тому же важнейший источник углеводов (она составляет 99,4%, от всех получаемых организмом углеводов), лактоза используются для диетического детского питания.
- Структурная — целлобиоза имеет важное значение для жизни растений, так как она входит в состав целлюлозы.
- ↑ XuMuK.ru — Дисахариды — Большая Советская Энциклопедия (неопр.). Дата обращения 20 апреля 2013.
- ↑ А. А. Петров, Х. В. Бальян, А. Т. Трощенко — Органическая химия. Под ред. А. А. Петрова. Изд. 3-е, испр. и доп. Учебник для вузов. М.: «Высш. школа», 1973. 623 с. с ил.
- ↑ Н. А. Тюкавкина, Ю. И. Бауков. Биоорганическая химия. — 2-е изд., перераб. и доп. — М.: Медицина, 1991. — 528 с. — (Учебная литература для студентов медицинских институтов). -ISBN 5-225-00863-1
- ↑ Полюдек-Фабини Р., Бейрих Т. -Органический анализ — Перевод с нем. — Л.: Химия, 1981. — 624 с.
- ↑ 1 2 Курс органической химии. Степаненко Б.Н. Учебник для мед. ин-тов. Изд. 2-е, перераб. и доп. М., «Высшая школа», 1974. 440 с. с ил.
- ↑ Сорочинская Е.И. — Биоорганическая химия. Поли- и гетерофункциональные соединения. Биополимеры и их структурные компоненты. СПб.: Изд-во СПб-госуниверситета, 1998. — 148 с
Лекция 12. Углеводы (ув)
Важнейший класс органических соединений, встречающийся в природе. Наиболее известны глюкоза, крахмал, целлюлоза, гликоген, гепарин и др., играющие важное значение в жизненных процессах человека и животных.
Углеводы – группа природных веществ, относящихся к полиоксикарбонильным соединениям, а также вещества, близкие им по строению.
В номенклатуре углеводов широко используется тривиальные названия: рибоза, фруктоза, лактоза, галактоза, глюкоза и т.д.
Классификация их основана на способности к гидролизу:
Сахара
Моносахариды (МС) Олигосахариды(ОС) Полисахариды(ПС)
(простые сахара) (низкомолекулярные) (высокомолекулярные)
не гидролизуются гидролизуются гидролизуются
пентозы, гексозы сахароза целлюлоза
(альдозы, кетозы) мальтоза, лактоза крахмал, гликоген
Важнейшие УВ: из пентоз – рибоза, дезоксирибоза, ксилоза;
из гексоз – глюкоза, фруктоза, галактоза, манноза.
Моносахариды (МС)
Изомерия
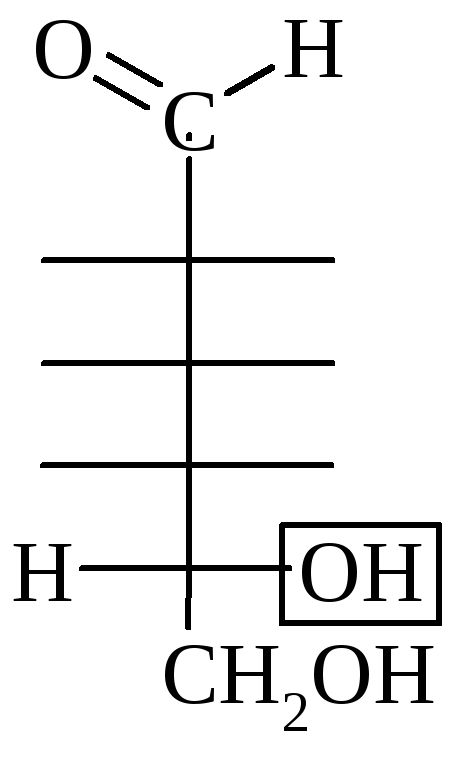
Наличие нескольких асимметрических атомов углерода обусловливает существование большого числа оптических изомеров. Это и энантиомеры (зеркальные изомеры, антиподы), и диастереомеры, и эпимеры. Понятие энантиомеров и диастереомеров Вам известны.
Эпимеры – это диастереомеры, отличающиеся друг от друга конфигурацией только одного асимметрического атома С. Все изомеры, кроме зеркальных, отличаются друг от друга свойствами и имеют свое название:
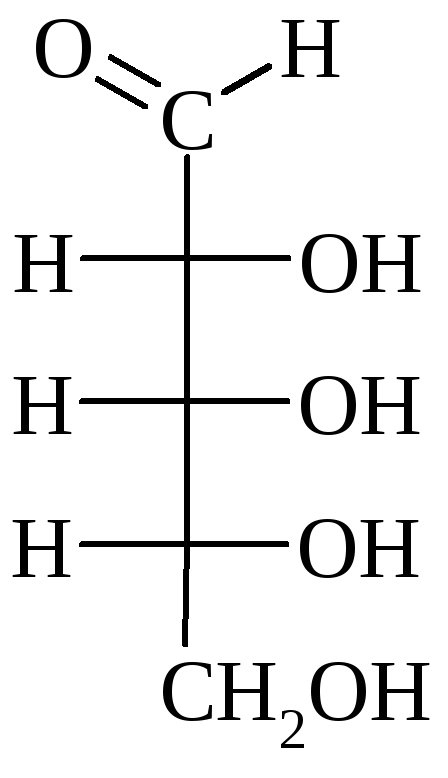
Ксилоза Рибоза
Принадлежность
МС к D-
или L-ряду
определяется по конфигурации последнего
(наиболее удаленного от 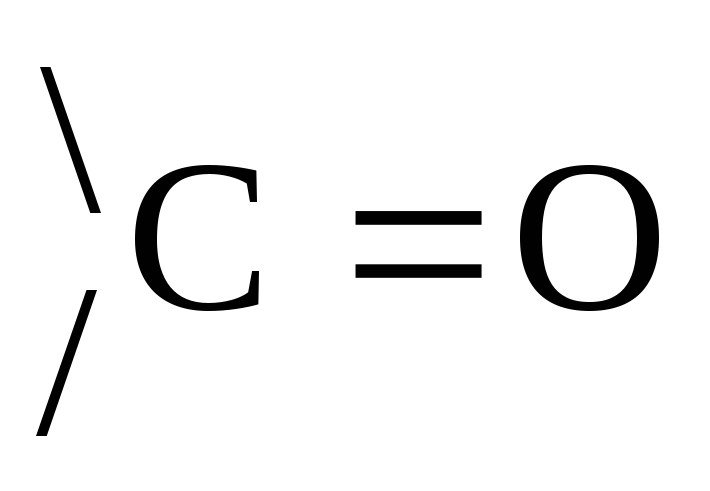 гр.) хирального атома С по аналогии со
стандартом – глицериновым альдегидом:
гр.) хирального атома С по аналогии со
стандартом – глицериновым альдегидом:
D– |
L– |
Природные сахара – D-сахара, L-сахара поступают в организм извне.
Для всех моносахаридов характерно явление цикло-оксо-таутомерии, или оксо-окси-таутомерии, т.е. наряду с не циклической формой они существуют и в циклических формах. В пространстве углерод-углеродная цепь изогнута,
 группа располагается близко к –ОН
группе 4 или 5 атома углерода. Происходит
взаимодействие этих двух групп одной
молекулы и образуется внутренний
полуацеталь.
группа располагается близко к –ОН
группе 4 или 5 атома углерода. Происходит
взаимодействие этих двух групп одной
молекулы и образуется внутренний
полуацеталь.
Вновь образовавшийся гидроксил носит название полуацетального, или гликозидного и может по-разному располагаться в пространстве относительно цикла, образуя еще один асимметрический атом углерода в циклической форме. Если полуацетальный гидроксил располагается по одну сторону с гидроксилом, определяющим принадлежность к D- или L-ряду, то такой изомер называется -изомером, а другой – -изомером. Стереоизомеры, отличающиеся друг от друга расположением только полуацетального гидроксила в пространстве, называются аномерами. (-верх, -низ – выполняйте наш каприз! Для запоминания.)

Процесс образования циклических форм называется аномеризацией. Циклическая и открытая формы легко переходят друг в друга и находятся в динамическом равновесии. При комнатной температуре преобладает циклическая, при нагревании – открытая. Для альдогексоз более характерна пиранозная форма, для пентоз и фруктоз – фуранозная. Все это отражается в названии, например, -D-глюкопираноза. В кристаллическом состоянии циклические формы закреплены и -, и -изомеры стабильны и могут быть отделены друг от друга. При растворении часть молекул переходит в открытую форму, а из нее образуются все виды циклических форм. Так как каждая форма имеет свой угол вращения луча поляризованного света, то до установления динамического равновесия угол вращения будет постоянно меняться. Изменение во времени угла вращения плоскости поляризации света свежеприготовленного раствора углеводов называется мутаротацией.
В настоящее время вместо циклических формул Колли-Толленса чаще пользуются перспективными формулами Хеуорса.
Именно циклическая форма участвуют в образовании ди- и полисахаридов.
Химические свойства
Циклическая и открытая (альдегидная) формы находятся в равновесии. Поэтому возможны,р-ции, характерные для альдегидной и циклической форм.
Р-ции по
 группе
группе
Все моносахариды взаимодействуют с НСN, РС15, NH2OH, NH2–NH2, NH2–NHC6H5, окисляются, восстанавливаются (Н2).
В зависимости от характера окислителя и реакции среды МС могут образовывать различные продукты окисления.
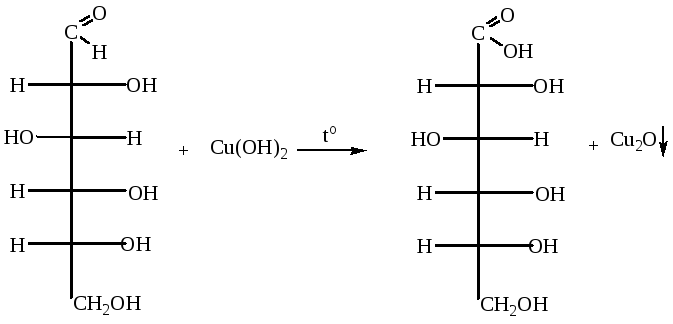
1. При действии слабых окислителей: Аg2O, NH4OH, to или Cu(ОН)2, ОН–, to идет разрушение углерод-углеродной цепи с образованием оксикислот с небольшим числом атомов С, а сами окислители при этом восстанавливаются до Аg и Сu2O (Cu) соответственно. Р-ция находит применение в биохимических анализах для количественного определения сахаров в биологических жидкостях.
Проба Толленса (реакция «серебряного зеркала»):
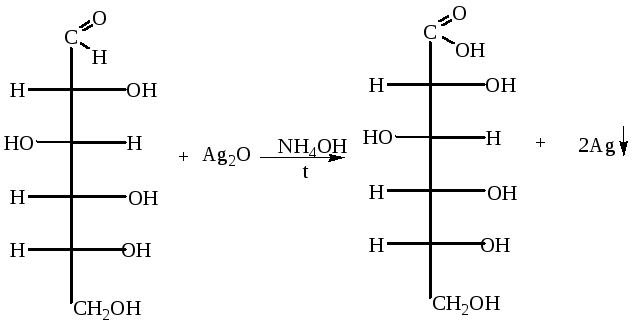
Глюкоза Глюконовая кислота
Проба Троммера (реакция медного зеркала). При окислении глюкозы Сu(OH)2 выпадает осадок Сu2O красного цвета.
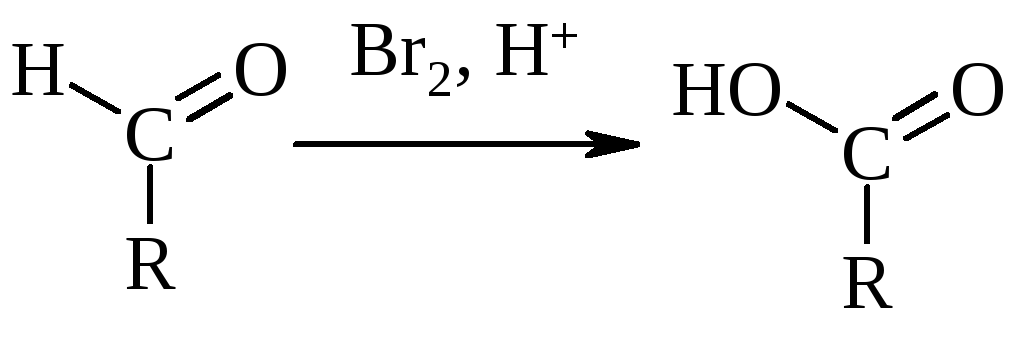
При осторожном окислении в кислой водной среде, например, бромной водой, образуются к-ты за счет окисления альдегидной группы – альдоновые кислоты:
| Глюконовая к-та, галактоновая к-та и др. |
При действии сильных окислителей (например азотной кислоты) идет окисление по первому и шестому атомам С с образованием глюкаровой кислоты:
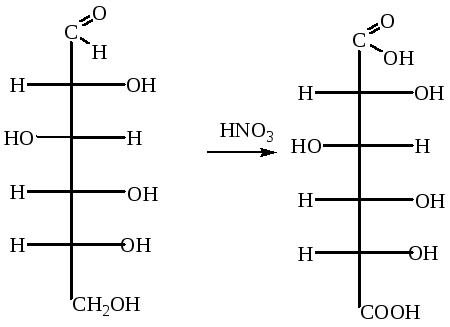
Глюкаровая кислота
При окислении только первичной спиртовой группы (по 6-ому атому С), если альдегидная группа защищена с образованием гликозида, получают уроновые к-ты. В организме этот процесс идет легко под действием ферментов. Уроновые к-ты способны к цикло-оксо-таутомерии. Они являются важной составной частью кислых гетерополисахаридов, например, гепарина, гиалуроновой к-ты.
Р-ции по спиртовым гидроксилам протекают как в открытой, так и в циклических формах.
Моносахариды взаимодействуют с Ме, Ме(ОН)2, образуя сахараты, с Сu(OH)2, с СН3I с образованием простых эфиров, с минеральными и органическими к-тами образуются сложные эфиры, с NH3 – аминосахара.
Наиболее важны фосфорные эфиры сахаров и аминосахара. Именно в виде фосфорных эфиров рибоза и дезоксирибоза входит в состав НК, соединения глюкозы и фруктозы участвуют в обмене веществ.

Фруктоза + 2Н3РО4 →1,6-Дифосфат фруктозы.
Аминосахара в организме образуются довольно легко в процессе аммонолиза. Чаще всего по второму атому С:
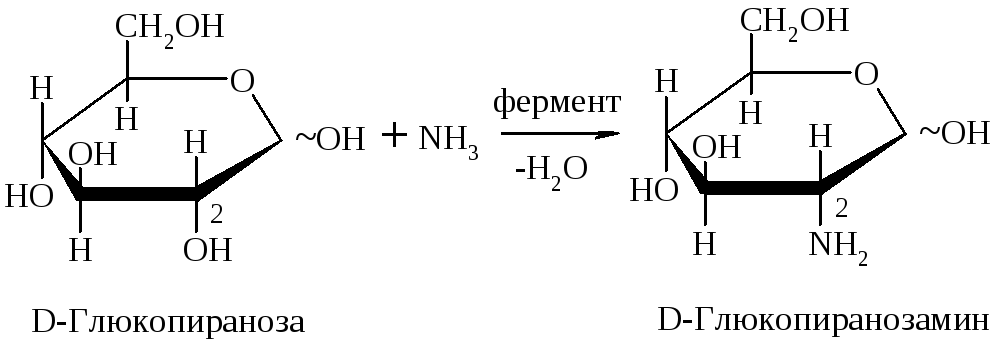
Аминосахара являются составной частью гетерополисахаридов.
Р-ции по полуацетальному гидроксилу
Эти р-ции характерны для циклической формы. При действии на моносахара спирта в присутствии газообразного НС1 происходит замещение атома Н полуацетального гидроксила на R с образованием особого типа простого эфира – гликозида. Р-ры гликозидов не мутаротируют. В зависимости от размера оксидного цикла гликозиды делятся на: пиранозиды и фуранозиды, как -, так и -форм.

Образование гликозидов служит доказательством существования циклических форм моносахаридов.
Превращение моносахарида в гликозид – сложный процесс, протекающий через ряд последовательных р-ций. Вследствие таутомерии и обратимости р-ции образования гликозида в р-ре, в равновесии в общем случае, могут находиться таутомерные формы исходного моносахарида и соответственно 4 диастереомерных гликозидов – и -аномеры фуранозидов и пиранозидов.
Гликозиды могут также образовываться при взаимодействии с фенолами или NH-содержащими алифатическими и гетероциклическими аминами.
Молекулу гликозида формально можно представить состоящей из двух частей: углеводной и агликоновой. В роли гидроксилсодержащих агликонов могут выступать и сами моносахариды. Гликозиды, образованные с ОН–содержащими агликонами, называются О-гликозидами, с NH-содержащими соединениями (например, аминами), наз-ся N-гликозидами.
Гликозиды являются составными частями многих лекарственных растений. Например, сердечные гликозиды, выделенные из наперстянки. Антибиотик стрептомицин – гликозид, ванилин – гликозид. Все ди- и полисахариды являются О-гликозидами.
С биологической точки зрения особое значение имеют N-гликозиды рибозы и дезоксирибозы, как продукты соединения с азотистыми пуриновы
ми и пиримидиновыми основаниями. Их общее название – нуклеозиды, т.к. вместе с Н3РО4 они являются нуклеиновыми к-тами – ДНК и РНК.
Все гликозиды, в том числе и нуклеозиды, легко подвергаются гидролизу в кислой среде с образованием исходных продуктов.
Гликозиды не способны к цикло-оксо-таутомерии и проявляют р-ции, характерные для спиртов.
IV. Специфические р-ции
Действие разбавленных. растворов- щелочей
Эпимеры: глюкоза, фруктоза и манноза легко превращаются друг в друга, образуя равновесные системы. Этот процесс наз-ся эпимеризацией.
Действие конц. р-ров кислот
Конц. р-ры НС1 и Н2SО4 вызывают дегидратацию моносахаридов: из пентоз образуется фурфурол, из фруктозы – 5-гидроксиметилфурфурол.
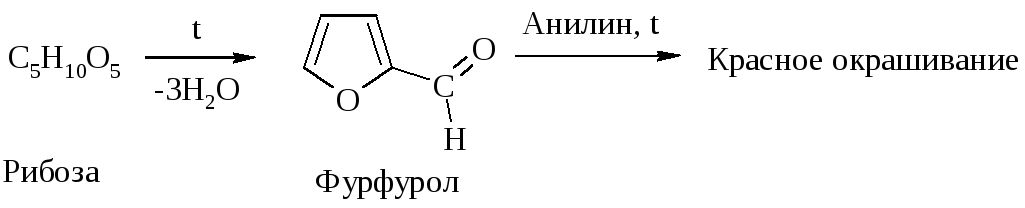
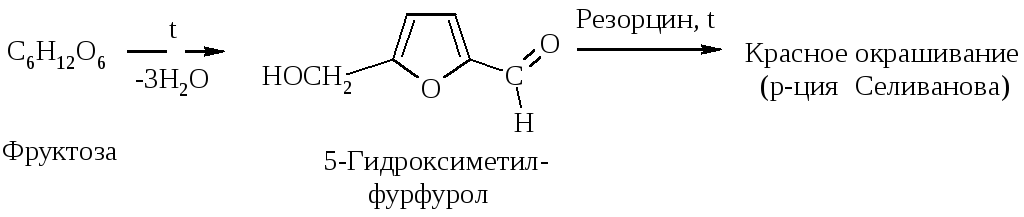
3. Брожение
Это распад моносахаридов под действием ферментов микроорганизмов, приводящий к образованию различных продуктов. В зависимости от конечного продукта различают:
а) спиртовое брожение
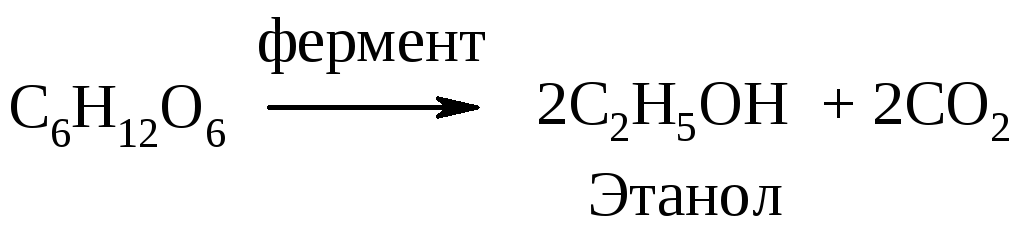
б) молочнокислое
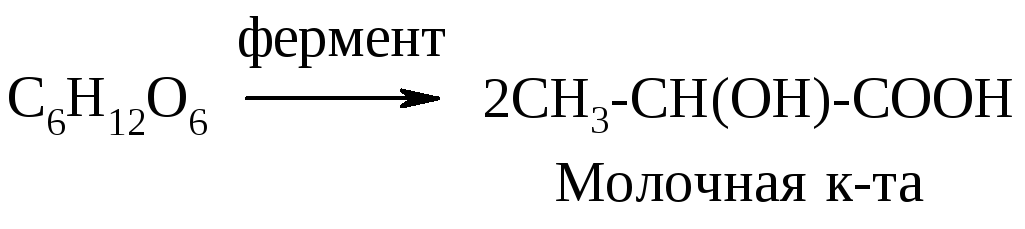
в) масляное
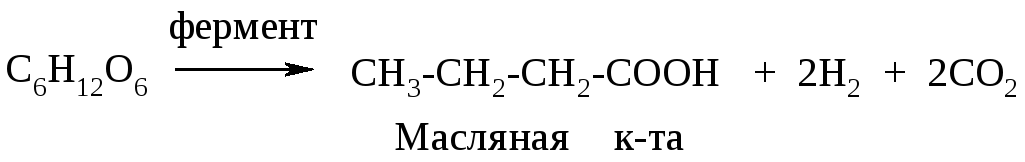
Л и т е р а т у р а
1. Тюкавкина С. 377 – 406.
Олигосахариды
Это углеводы, содержащие в молекуле 2-10 моносахаридных остатков. Наиболее важны дисахариды, то есть сахариды, содержащие два моносахаридных остатка. К ним относятся сахароза, мальтоза, лактоза и целлобиоза. При гидролизе их образуется два моносахарида. Сахароза – невосстанавли
вающий дисахарид, остальные – восстанавливающие. Все дисахариды являются гликозидами и содержат в своем составе a–D–глюкозу.
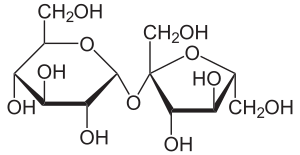
Молекула сахарозы состоит из a–D–глюкозы и b–D–фруктозы:

При образовании сахарозы оба моносахарида участвуют своими полуацетальными гидроксилами. Поэтому циклическая форма будет закреплена и оксо-форма (открытая) не образуется. Такой сахар обладает свойствами многоатомного спирта и гликозида. Восстанавливающие свойства отсутствуют: проба Троммера и реакция Толленса отрицательны. Подобно моносахаридам сахароза вступает в р-ции с Ме (активным), образует простые и сложные эфиры, дает качественную р-цию с Сu(ОН)2 – синее окрашивание:
Сахароза, как гликозид, легко гидролизуется в кислой среде с образованием a–D–глюкозы и b–D–фруктозы. При этом происходит изменение угла вращения поляризованного света. Сахароза обладает правым вращением (+66,50), образующаяся фруктоза – левым (-920), глюкоза – правым (+52,50). Разница – -400.
Это явление называется инверсией сахара. Смесь глюкозы и фруктозы – инвертным сахаром. Природный инвертный сахар – мед.
Сладость сахарозы принята за 1, тогда фруктоза имеет сладость 1,73, глюкоза – 0,74, сорбит – 0,6, маннит – 0,4.
Специфические реакции
Сахароза после гидролиза дает положительную реакцию Селиванова, так как при гидролизе образуется фруктоза.
Проба Троммера и реакция Толленса отрицательны, так как в щелочной среде сахароза не гидролизуется.
Сахароза применяется в медицине для приготовления порошков, таблеток, сиропов, микстур и пр.
Важнейшими представителями восстанавливающих дисахаридов являются мальтоза, лактоза и целлобиоза.

В растворе мальтоза существует в виде циклической и открытой формах (3 формы) за счет мутаротации:
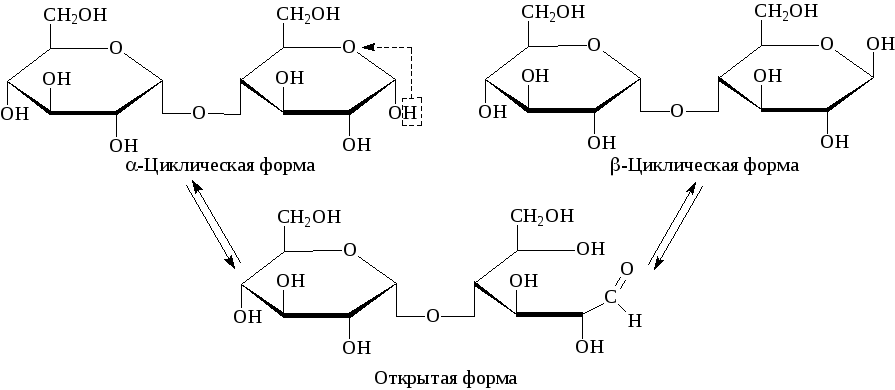
Химические свойства
Мальтоза – это альдегидо-спирто-гликозид.
I. Реакции открытой формы. Мальтоза дает все реакции по альдегидной группе с HCN, NH2OH, NH2–NH2, восстановления, окисления.
Проба Троммера и реакция Толленса положительны:
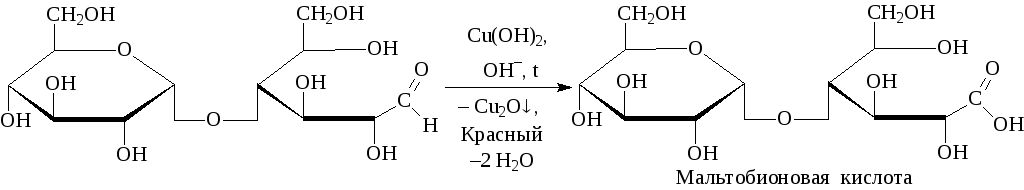
Углеводы, дающие положительную пробу Троммера, называются восстанавливающими.
II. Реакции по – ОН гр. аналогичны реакциям для сахарозы.
III. Мальтоза гидролизуется в кислой среде с образованием 2-х молекул глюкозы.
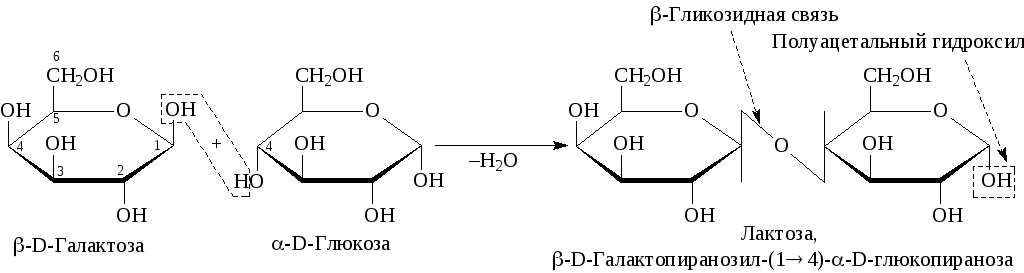
лактоза
Лактоза существует в растворе в виде трех форм: двух циклических и одной открытой. Лактоза восстанавливающий дисахарид и обладает всеми
свойствами, характерными для мальтозы. Лактоза содержится в женском молоке и способна подавлять рост бактерий.
Полисахариды
Это высокомолекулярные углеводы, содержащие сотни и даже тысячи моносахаридных остатков.
Из полисахаридов широко известны целлюлоза, крахмал и гликоген. Они построены из одного и того же моносахарида – D-глюкозы. Общая формула (С6Н10О5)n.
Целлюлоза (клетчатка) – самый распространенный не только полисахарид, но и органическое вещество в природе. Древесина примерно на 50% состоит из целлюлозы, а хлопок и лен представляют практически чистую целлюлозу.
В целлюлозе остатки D–глюкопиранозы связаны между собой b–(1®4) – гликозидной связью:
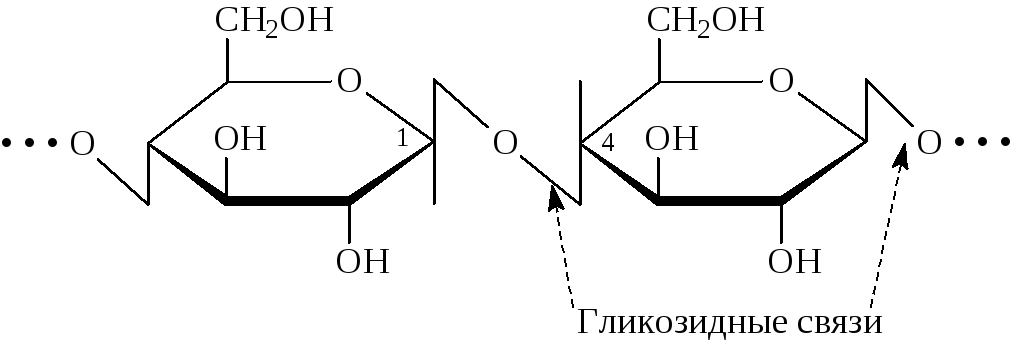
Цепь, построенная из тысячи остатков D–глюкозы, имеет линейное строение. Линейные цепи закреплены Н–связями между моносахаридными звеньями внутри одной цепи. Между параллельно уложенными цепями полисахарида также возникают Н-связи, придающие жесткость всей структуре. Отсюда высокая механическая прочность целлюлозы.
С химической позиции целлюлоза – многоатомный спирт, содержащий три гидроксильные группы в каждом моносахаридном звене, и способный образовывать с участием этих групп простые и сложные эфиры:
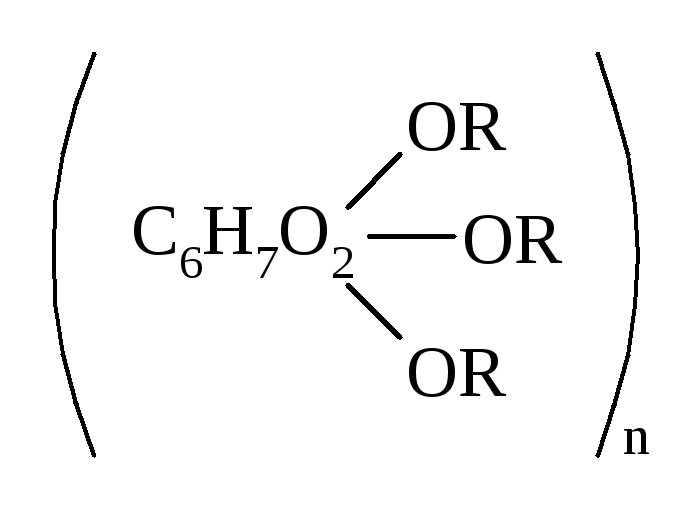
В эфирные группы могут быть превращены либо все, либо часть гидроксильных групп фрагмента полисахарида, где R–алкил или остаток органической или неоранической кислоты (в сложных эфирах). Целлюлоза не проявляет восстанавливающих свойств.
Простые эфиры целлюлозы – метилцеллюлоза R=CH3 и натрийкарбоксиметилцеллюлоза R=СН2 СООNa – образуют вязкие водные р-ры или гели и применяются в фармации в качестве загустителей, эмульгаторов и стабилизаторов мазей и эмульсий. Карбоксиметилцеллюлоза R=СН2СООН и диэтиламиноэтилцеллюлоза (сокращенно ДЭАЭ-целлюлоза) R=СН2СН2N (C2H5)2 обладают способностью ионитов и применяются в биохимических исследованиях.
Эфир уксусной к-ты (триацетат) применяют в производстве кинопленки и электроизоляционной пленки. Из этого полиэфира вырабатывают также ацетатное волокно. Из целлюлозы получают и другие искусственные волокна : вискозное и медноаммиачное.
Широко применяются эфиры целлюлозы с азотной к-той. Тринитрат целлюлозы – взрывчатое вещество, применяется в производстве пороха. Смесь моно-и динитратов целлюлозы используют в производстве целлулоида, лаков, взрывчатых вещ-в.
Гидролизом целлюлозы в промышленности вырабатывают глюкозу, брожением которой получают этиловый спирт. Другие области применения целлюлозы: строительный материал, производство бумаги, картона.
Крахмал – другой распространенный растительный полисахарид, состоящий из двух фракций: амилопектина (основной компонент – 80-90%) и амилозы. Амилоза, как и целлюлоза, построена из (1®4) – связанных остатков D–глюкопиранозы.
Однако в отличие от целлюлозы, гликозидная связь в амилозе имеет -конфигурацию, в результате чего полисахаридная цепь приобретает иное пространственное строение, напоминающее спираль.
А
Гликозидные связи
милоза + I2 ® синее окрашивание 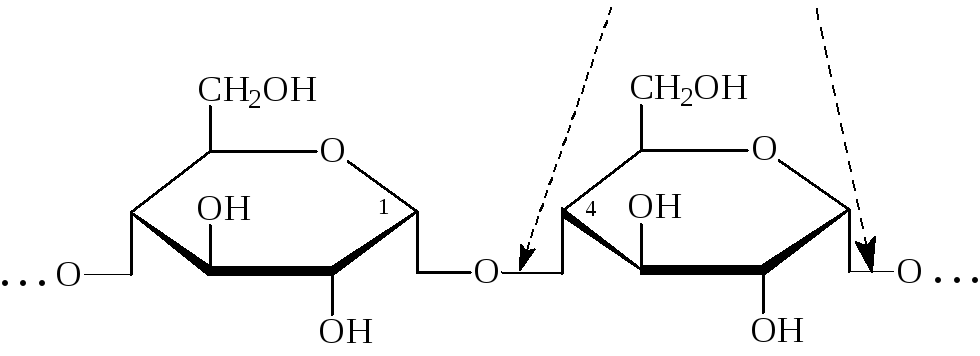
Фрагмент цепи амилозы
Амилопектин имеет разветвленное строение. В основной цепи остатки D-глюкопиранозы связаны a-(1®4) – гликозидной связью, а в местах ветвления – a-(1®6)-связью:
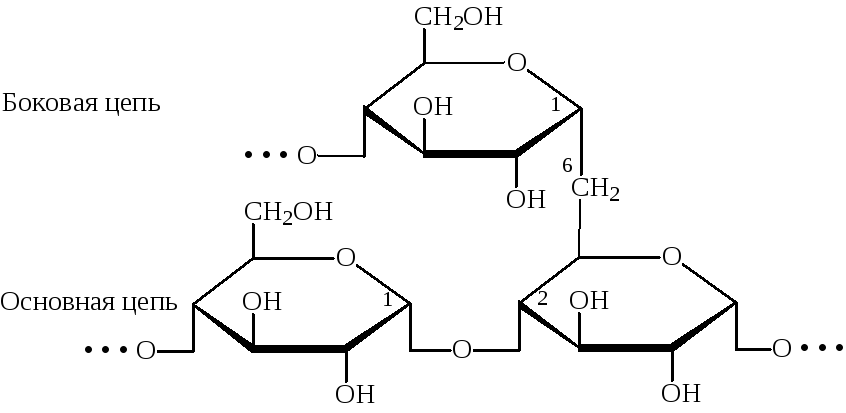
Амилопектин +I2 ® фиолетовое окрашивание
В организме крахмал подвергается гидролизу:
Амилаза слюны Желудочный сок
К
 рахмал Декстрины
крупные
рахмал Декстрины
крупные
Амилаза панкреотического сока Мальтаза кишечника
Д
 екстрины
мелкие Мальтоза α-D-глюкоза
екстрины
мелкие Мальтоза α-D-глюкоза
a–D-Глюкоза поглощается ворсинками кишечника, попадает в кровеносное русло и используется как источник энергии. Избыток глюкозы полимеризуется в гликоген и откладывается в печени про запас.
Проблема ожирения возникает потому, что количество гликогена в тканях ограничено. После синтеза 50-60г гликогена на 1кг ткани из глюкозы начинает вырабатываться жир.
Гликоген (животный крахмал) имеет сходное строение с амилопектином, однако разветвленность его больше, чем амилопектина.
Гетерополисахариды – это углеводы, при гидролизе которых образуются молекулы различных моносахаридов и их производных. К последним относятся гепарин, гиалуроновая к-та, хондроитинсерная к-та. В их состав входят аминосахара, уроновые кислоты и остатки серной и уксусной кислот.
Соединительная ткань распределена по всему организму (кожа, хрящи, сухожилия, суставная жидкость, роговица, стенки крупных кровеносных сосудов, кости) и обусловливает прочность и упругость органов, эластичность их соединения, стойкость к проникновению инфекции. Полисахариды соединительной ткани связаны с белками.
Полисахариды соединительной ткани иногда называют кислыми мукополисахаридами, т.к. они содержат уроновые к-ты, остатки серной и уксусной кислот.
Функции углеводов: 1) энергетическая; 2) строительная; 3) наследственная; 4) защитная; 5) поддержание постоянного осмотического давления и свертываемости крови; 6) лекарственные препараты и компоненты к ним.
Энергетическая функция. Потребность человеческого организма удовлетворяется за счет углеводов. При нормальной трудовой деятельности энергетические затраты человека покрываются за счет углеводов на 55-60%, жиров на 20-25%, белков на 15-20%.
Калорийность углеводов, то есть энергия, выделяемая в процессе их диссимиляции с образованием СО2 и Н2О, составляет 16-17 кДж/г. Источником глюкозы является гликоген и крахмал, поступающий с пищей. Глюкоза – обязательный компонент крови (3,3 –3,5 ммоль/л цельной крови).
Особенно чувствительны к снабжению глюкозой нервные клетки. При недостатке глюкозы возникают судороги, потеря сознания. Постоянная концентрация глюкозы зависит от двух гормонов адреналина (гормон надпочечников), регулирующего расщепление глюкозы, и инсулина (гормон поджелудочной железы), регулирующего синтез гликогена из глюкозы. При уменьшении инсулина уровень глюкозы повышается примерно в 2 раза, увеличивается давление, образуется большое количество «ацетоновых тел», изменяется рН крови. Это наблюдается при сахарном диабете.
Контрольные вопросы к теме: «Углеводы»
Какие соединения называются моносахаридами.
Классификация моносахаридов.
Оптическая изомерия. По какому хиральному атому углерода идет отнесение к D- и L- изомерам.
Что такое мутаротация.
Какие соединения относятся к дисахаридам.
Какие дисахариды называются восстанавливающими, а какие невосстанавливающими. Объясните почему?
Какие углеводы называются полисахаридами.
Перечислите функции углеводов в организме.
Упражнения:
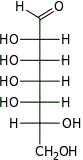
Напишите с помощью проекционных формул Фишера энантиомеры глюкозы, галактозы и маннозы. Укажите диастереомеры и эпимеры. Какие формы моносахаридов входят в организм?
Напишите циклические формы D- глюкопиранозы.
Напишите реакции глюкозы по альдегидной группе.
Напишите реакции «серебряного и медного зеркала» для глюкозы.
Напишите реакции для глюкозы по группам ОН.
Напишите реакции брожения глюкозы.
Напишите реакции образования мальтозы и лактозы. Какими дисахаридами они являются?
Напишите схему образования невосстанавливающего дисахарида.
Напишите компоненты, содержащиеся в крахмале.
10.Напишите формулы целлюлозы и гликогена
Сахароза — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 20 апреля 2019; проверки требуют 3 правки. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 20 апреля 2019; проверки требуют 3 правки. Эта статья — о химическом веществе. О пищевом продукте см. Сахар.| Сахароза | |
|---|---|
 ( {{{картинка}}}) | |
 ( ({{{изображение}}}) | |
| Систематическое наименование | (2R,3R,4S,5S,6R)-2-[(2S,3S,4S,5R)-3,4-дигидрокси-2,5-бис(гидроксиметил)оксолан-2-ил]окси-6-(гидроксиметил)оксан-3,4,5-триол |
| Сокращения | α-D-глюкопиранозил-(1,2)-β-D-фруктофуранозид |
| Традиционные названия | свекловичный сахар, тростниковый сахар |
| Хим. формула | C12H22O11 |
| Состояние | Твёрдое, кристаллическое |
| Молярная масса | 342,2965 ± 0,0144 г/моль |
| Плотность | 1,587 г/см³ |
| Температура | |
| • плавления | 186 °C |
| • разложения | 367 ± 1 °F[1] и 320 ± 1 °F[1] |
| Давление пара | 0 ± 1 мм рт.ст.[1] |
| Растворимость | |
| • в воде | 211,5 г/100 мл |
| Рег. номер CAS | 57-50-1 |
| PubChem | 5988 |
| Рег. номер EINECS | 200-334-9 |
| SMILES | |
| InChI | 1S/C12h32O11/c13-1-4-6(16)8(18)9(19)11(21-4)23-12(3-15)10(20)7(17)5(2-14)22-12/h5-11,13-20H,1-3h3/t4-,5-,6-,7-,8+,9-,10+,11-,12+/m1/s1 |
| RTECS | WN6500000 |
| ChEBI | 17992 |
| ChemSpider | 5768 |
| NFPA 704 |  |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |
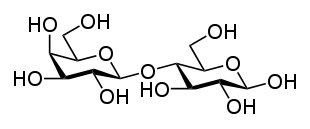
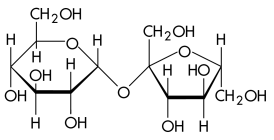
Сахаро́за (сукро́за, тростниковый сахар) C12H22O11, в быту просто сахар, — дисахарид из группы олигосахаридов, состоящий из двух моносахаридов: α-глюкозы и β-фруктозы.
Сахароза является весьма распространённым в природе дисахаридом. Она встречается во многих фруктах, плодах и ягодах. Особенно велико содержание сахарозы в сахарной свёкле и сахарном тростнике, которые и используются для промышленного производства пищевого сахара.
Сахароза, попадая в кишечник, быстро гидролизуется альфа-глюкозидазой тонкой кишки на глюкозу и фруктозу, которые затем всасываются в кровь. Ингибиторы альфа-глюкозидазы, такие, как акарбоза, тормозят расщепление и всасывание сахарозы, а также и других углеводов, гидролизуемых альфа-глюкозидазой, в частности, крахмала. Это используется в лечении сахарного диабета 2-го типа[2].
В чистом виде — бесцветные моноклинные кристаллы. При застывании расплавленной сахарозы образуется аморфная прозрачная масса — карамель. Сахароза имеет высокую растворимость. Растворимость (в граммах на 100 грамм растворителя): в воде 179 (0 °C) и 487 (100 °C), в этаноле 0,9 (20 °C). Малорастворима в метаноле. Не растворима в диэтиловом эфире. Плотность 1,5879 г/см3 (15 °C). Удельное вращение для D-линии натрия: 66,53 (вода; 35 г/100г; 20 °C). Температура плавления 186℃.
Не проявляет восстанавливающих свойств — не реагирует с реактивами Толленса, Фелинга и Бенедикта. Не образует открытую форму, поэтому не проявляет свойств альдегидов и кетонов. Наличие гидроксильных групп в молекуле сахарозы легко подтверждается реакцией с гидроксидами металлов. Если раствор сахарозы прилить к гидроксиду меди(II), образуется ярко-синий раствор сахарата меди. Альдегидной группы в сахарозе нет: при нагревании с аммиачным раствором оксида серебра(I) она не дает реакцию «серебряного зеркала», при нагревании с гидроксидом меди(II) не образует красного оксида меди(I). Из числа изомеров сахарозы, имеющих молекулярную формулу С12Н22О11, можно выделить мальтозу и лактозу.
Реакция сахарозы с водой[править | править код]
Если прокипятить раствор сахарозы с несколькими каплями соляной или серной кислоты и нейтрализовать кислоту щелочью, а после этого нагреть раствор, то появляются молекулы с альдегидными группами, которые и восстанавливают гидроксид меди(II) до оксида меди(I). Эта реакция показывает, что сахароза при каталитическом действии кислоты подвергается гидролизу, в результате чего образуются глюкоза и фруктоза:
- C12h32O11+h3O→C6h22O6+C6h22O6{\displaystyle {\mathsf {C_{12}H_{22}O_{11}+H_{2}O\rightarrow C_{6}H_{12}O_{6}+C_{6}H_{12}O_{6}}}}
Реакция сахарозы с гидроксидом меди(II)[править | править код]
В молекуле сахарозы имеется несколько гидроксильных групп. Поэтому соединение взаимодействует с гидроксидом меди (II) аналогично глицерину и глюкозе. При добавлении раствора сахарозы к осадку гидроксида меди (II) он растворяется; жидкость окрашивается в синий цвет. Но, в отличие от глюкозы, сахароза не восстанавливает гидроксид меди (II) до оксида меди (I).
Природные и антропогенные источники[править | править код]
Содержится в сахарном тростнике, сахарной свёкле (до 28 % сухого вещества), соках растений и плодах (например, берёзы, клёна, дыни и моркови). Источник получения сахарозы — из свёклы или из тростника, определяют по соотношению содержания стабильных изотопов углерода 12C и 13C. Сахарная свёкла имеет C3-механизм усвоения углекислого газа (через фосфоглицериновую кислоту) и предпочтительно поглощает изотоп 12C; сахарный тростник имеет C4-механизм поглощения углекислого газа (через щавелевоуксусную кислоту) и предпочтительно поглощает изотоп 13C.
Мировое производство в 1990 году — 110 000 000 тонн.
Статичное 3D-изображение
молекулы сахарозы-

Кристаллы коричневого
(нерафинированного тростникового) сахара

 Новости
Новости Новости
Новости Новости
Новости Новости
Новости Новости
Новости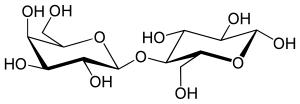
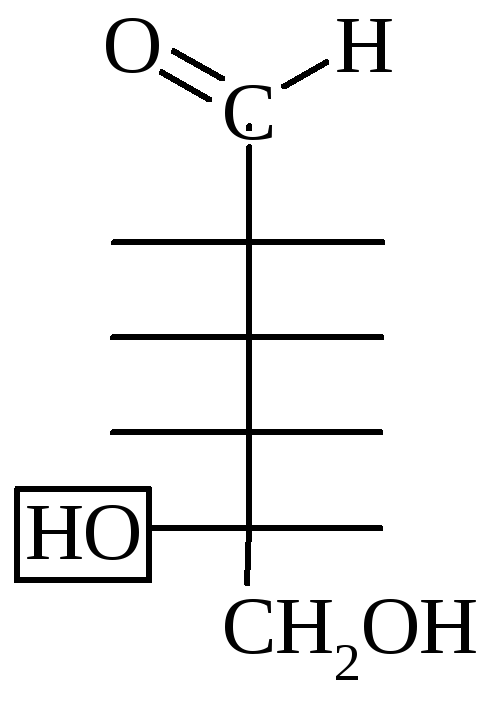
 группа располагается близко к –ОН
группе 4 или 5 атома углерода. Происходит
взаимодействие этих двух групп одной
молекулы и образуется внутренний
полуацеталь.
группа располагается близко к –ОН
группе 4 или 5 атома углерода. Происходит
взаимодействие этих двух групп одной
молекулы и образуется внутренний
полуацеталь. группе
группе