Осложнения после гастроэнтероанастомоза, резекции желудка, ваготомии и гастрэктомии
Одним из частых осложнений гастроэнтероанастомоза является развитие пептической язвы в области соустья или в тощей кишке. Пептические язвы развиваются вследствие переваривания слизистой оболочки тощей кишки желудочным соком. Это осложнение преимущественно встречается у больных с наложенным гастроэнтероанастомозом по поводу язвы двенадцатиперстной кишки.
Ведущим симптомом язвы анастомоза и тощей кишки служат постоянные боли под ложечкой, усиливающиеся после еды. При рентгеновском исследовании желудка больных с пептической язвой может быть обнаружена ниша на месте язвы (в 30%). Вспомогательное диагностическое значение имеет положительная реакция Грегерсена. Пептическая язва тощей кишки может вести к ряду осложнений, которые сходны с таковыми при язвенной болезни желудка: кровотечения, прободения, пенетрации, озлокачествление. Своеобразным осложнением является образование свища между желудком и поперечной ободочной кишкой (fistula gastro-jejunocolica). Состояние больного в этом случае становится особенно тяжелым: боли усиливаются, возникают поносы в связи с попаданием части пищи из желудка прямо в толстую кишку, отрыжка и нередко рвота каловыми массами. Все это приводит к заметному истощению больных. Распознавание указанного осложнения не встречает затруднений, поскольку при рентгеноскопии видно поступление бария из желудка не только в тощую, но и непосредственно в толстую кишку через свищ. Симптоматическое терапевтическое лечение — соответствующая диета и систематические промывания желудка — могут на некоторое время облегчить состояние больного, но радикальным лечением должна быть только операция. Хирургическое вмешательство состоит в резекции желудка, включая место анастомоза и ту часть тощей кишки, где развилась пептическая язва.
Резекция желудка, при которой удаляется почти вся малая кривизна, а по большой кривизне пересечение желудка производится на уровне верхнего или нижнего полюса селезенки, сопровождается стойкой ахилией. Анастомоз культи желудка производится или с двенадцатиперстной кишкой (способ Бильрота I), или с петлей тощей кишки (способ Бильрота II), в этом случае культя двенадцатиперстной кишки зашивается наглухо. При создании анастомоза между культей желудка и петлей тощей кишки последняя может быть «короткой» (20 см от трейцевой складки) или «длинной» (50 см от трейцевой складки). При короткой петле содержимое двенадцатиперстной кишки неизбежно проходит через культю желудка и отводящую петлю кишки, а при длинной петле создается добавочное сообщение между приводящим и отводящим коленами петли тощей кишки, и таким образом содержимое двенадцатиперстной кишки не попадет в культю желудка. Создание анастомоза культи желудка с двенадцатиперстной кишкой преследовало сохранение пассажа пищи по двенадцатиперстной кишке и приближение к физиологическим условиям пищеварения.
Каковы отдаленные результаты резекции желудка при язвенной болезни? Большинством хирургов они признаются хорошими, однако не столь уже редки и неудачи после успешно прошедшей операции резекции желудка: в 6—10% случаев возникают так называемые «болезни оперированного желудка». К ним относятся: воспаление слизистой оболочки культи желудка, пептическая язва петли тощей кишки и анастомоза, свищ между культей желудка, петлей тощей кишки и поперечной ободочной кишкой, агастральная астения, демпинг-синдром.
Хроническое воспаление слизистой оболочки культи желудка сопровождается следующими симптомами: отсутствием аппетита, чувством тяжести под ложечкой, временами поносами, потерей веса, понижением трудоспособности (Zuckschwerdt, Lindenschmidt, 1960). Воспаление слизистой оболочки культи желудка определяется или гастритом, сопутствующим язве до операции, или вновь возникшим спустя продолжительное время после нее. В происхождении воспалительных осложнений имеет значение забрасывание дуоденального содержимого в желудок как при анастомозе по Бильроту I, так и по Бильроту II на короткой петле при отсутствии межкишечного анастомоза. Пальпация подложечной области не дает каких-либо указаний на локальную болезненность. Аспирационная биопсия культи желудка может обнаружить различные стадии гастрита, чаще встречается атрофический гастрит (В. П. Салупере, 1963).
Исследование ферментативной функции поджелудочной железы показывает угнетение секреции трипсина и амилазы. При лечении воспаления слизистой оболочки культи желудка, таким образом, помимо диетотерапии и промывания желудка, необходимо применение панкреатина, витаминов группы В. Из физиотерапевтических процедур на область поджелудочной железы следует применять диатермию, УВЧ, ионофорез (Л. П. Волкова, 1960). Однако физиотерапевтические процедуры на культю желудка после резекции по поводу опухоли желудка противопоказаны.
Появление после резекции желудка в отдаленные сроки упорных болей под ложечкой, усиливающихся после еды, должно наводить на мысль о пептической язве тощей кишки. Это осложнение после резекции желудка встречается очень редко. О диагностике пептической язвы говорилось уже выше. Эффектным методом лечения следует считать операцию резекции анастомоза и части культи желудка.
Агастральная астения (А. А. Бусалов, 1961), встречающаяся после субтотальной резекции желудка, имеет общую симптоматику с хроническим воспалением слизистой оболочки культи желудка. При агастральной астении, помимо слабости, быстро наступающего утомления во время работы, имеются и диспепсические явления: пониженный аппетит, отрыжка горечью, чувство тяжести под ложечкой после еды, иногда рвота, часто поносы без болей и повышения температуры. При исследовании крови устанавливается гипохромная анемия (II. В. Демидова, 1963). У значительного большинства больных с резецированным желудком безотносительно к тому, была ли резекция произведена по поводу язвы или рака желудка, имеется выраженная гипоальбуминемия, независимо от наличия или отсутствия гипопротеинемии. Общее содержание белка крови у большинства больных с резецированным желудком обычно остается в пределах нормы.
Много внимания в отечественной и зарубежной литературе уделяется демпинг-синдрому после резекции желудка. Это понятие связано с именем Mix (1922) и включало в себя представление о «провале пищи» из желудка в кишечник после произведенной гастроэнтеростомии. Однако изучение данного явления привело к возникновению двух новых понятий: «раннего послеобеденного синдрома» и «позднего послеобеденного синдрома». Оба эти синдрома объединяет коллапсоподобное состояние, отличаются же они временем возникновения после приема пищи.
«Ранний послеобеденный синдром» у одних больных возникает сразу после приема пищи, а у других — через 10—15 минут: появляется ощущение давления и полноты под ложечкой еще во время еды или вскоре после нее, тошноты, слабости, чувство головокружения, сердцебиение и испарина. Эти явления вызываются быстрым наполнением культи желудка или начальной части тощей кишки при обильной еде. Особенно характерно возникновение такого состояния после приема сладкого чая, пирожных, шоколада, а иногда молока и жиров. Объективные признаки «раннего послеобеденного синдрома» немногочисленны: покраснение, а иногда побледнение лица, сужение зрачков, учащение пульса и дыхания, повышение артериального давления на 10—15 мм рт. ст. Все эти явления продолжаются 1—2 часа. Описываемые симптомы у некоторых больных бывают настолько тяжелыми, что они не могут вставать из-за стола после приема пищи. В большинстве случаев клинические проявления «раннего послеобеденного синдрома» сглаживаются с течением времени.
При «позднем послеобеденном синдроме», возникающем через 2—3 часа после приема пищи, появляется ощущение слабости, бледность, дрожание, испарина, чувство головокружения. Все эти явления не связаны с быстрым опорожнением культи желудка. При «позднем послеобеденном синдроме» в отличие от «раннего» наблюдается понижение АД, брадикардия, слабость и головокружение, сопровождающиеся чувством острого голода.
Какова же патогенетическая сущность «раннего послеобеденного синдрома»? Быстрое возникновение его вслед за приемом пищи выдвинуло гипотезу о рефлекторном происхождении, но некоторая связь клинических проявлений с характером пищи позволила сделать следующее предположение: молниеносный переход гипертонических растворов из резецированного желудка, лишенного привратника, в начальный отдел тощей кишки (а таким раствором практически является также и обычная пища) вызывает путем осмоса быструю резорбцию жидкостей в просвет кишки и вследствие этого непосредственное уменьшение объема плазмы крови, как при шоке. В результате развившейся гиповолемии начинается следующая фаза: меньший объем циркулирующей крови при помощи прессорных рецепторов в крупных сосудах возбуждает окончания симпатических нервов. Возникающая симпатикотония обусловливает изменения пульса, АД, ЭКГ, увеличение плазмотока в почках (полиурия с низким удельным весом мочи), возникновение мигренеподобной головной боли (Г. Доков, 1963). Приемы пипольфена или новокаина снижали или ослабляли указанные симптомы. «Ранний послеобеденный синдром» может сочетаться с «поздним послеобеденным». Развитие последнего обычно совпадало с гипогликемической фазой сахарной кривой (Б. М. Меерович, 1961).
В литературе нередко встречаются высказывания, что демпипг-синдром реже встречается после резекции желудка по способу Бильрота I.
Everson (1952) провел ряд наблюдений над двумя группами больных после резекции желудка по Бильроту I и по Бильроту II спустя в среднем 8—18 месяцев после операции. Он вызывал у них искусственный демпинг-синдром следующим образом: больные натощак выпивали 150 мл 50% раствора глюкозы, после чего у всех возникал демпинг-синдром в значительно более резкой степени, чем после обычного приема пищи. Не было отмечено никакой разницы между результатами наблюдений над больными, перенесшими операцию по Бильроту I или по Бильроту II.
В комплексе лечебных и профилактических мероприятий в отношении демпинг-синдрома после резекции желудка наиболее существенное значение имеют назначение рационального диетического питания и правильная организация режима работы. Надо считать оправданным соблюдение строгой щадящей диеты только в первые 3—4 месяца после операции. В дальнейшем ее надо постепенно расширять, включая более разнообразные блюда (см. «Язвенная болезнь»). Терапия демпинг-синдрома следующая: частые приемы небольшого количества пищи, избегая избытка углеводов, горизонтальное положение после основного приема пищи — все это с течением времени приводит к улучшению (Б. Л. Меерович, 1961).
Holler (1956) рекомендует следующий режим питания при демпинг-синдроме: прием пищи 5 раз в день небольшими постепенно возрастающими порциями. Утренний завтрак вначале состоит из сухого пайка с не очень сладким питьем. Диета должна быть богатой белками, содержать достаточное количество жира (30—40 г сливочного масла в день). Следует ограничивать потребление хлеба и мучных блюд (особенно сладких). Целесообразно включить в пищевой режим достаточное количество овощей и фруктов. Категорически запрещается курение и употребление алкоголя.
Однако за последние годы в случаях упорно не поддающегося консервативному лечению демпинг-синдрома хирургами как в СССР, так и за рубежом предлагаются различные реконструктивные операции, целью которых является направление пассажа пищи из культи желудка в двенадцатиперстную кишку (Е. И. Захаров, 1961; М. И. Петрушинский, 1962). Реконструктивные операции, предлагаемые для устранения демпинг-синдрома, еще недостаточно изучены в клинике, а сложность и травматичность пока не дают оснований широко пропагандировать их.
Ваготомия, т. е. перерезка обоих блуждающих нервов, преследует цель перерыва нервнорефлекторной дуги. Одно время (1943—1948 гг). представлялось, что подобная операция приносит существенную пользу, а выполнение ее так просто, что можно утверждать ее превосходство над всеми другими операциями, предложенными для лечения язвенной болезни. После пересечения блуждающих нервов на уровне абдоминального отдела пищевода язва, как правило, рубцуется, а боли исчезают, но вместе с этим ваготомия создает значительные расстройства желудочного пищеварения. Вследствие пареза мускулатуры желудка нарушается нормальное опорожнение желудка, и пища задерживается в нем на длительный срок. При резко ослабленной бактерицидности желудочного сока, связанной с понижением кислотности и его пептического действия, в желудке создаются условия, благоприятные для развития активной бактериальной флоры. Застаивающаяся пища подвергается брожению, что вызывает вздутие живота, отрыжку тухлым, явления интоксикации. Так как рвота у больных после ваготомии наблюдается редко, то для облегчения состояния больного приходится прибегать к промыванию желудка. Явления желудочного паралича и упорных поносов отмечены как наиболее серьезные в осложнениях после ваготомии. В итоге получается, что расстройства после перерезки блуждающих нервов иногда более тягостны, чем те, которые были до оперативного вмешательства. Лечение осложнений после ваготомии — симптоматическое. Обычно через 1/2—1 год эти неприятные расстройства могут уменьшиться и даже прекратиться. Однако по мере восстановления прерванной иннервации нередко возникает рецидив язвенной болезни.
Последствиями гастрэктомии (обычно применяемой при раке желудка) является (помимо демпинг-синдрома) падение веса у 1/3 оперированных, что объясняется целым рядом факторов. По данным Everson (1952), вес у больных после гастрэктомии из 40 оперированных, прослеженных в отдаленные сроки после операции, только у 3 вернулся к исходному уровню до операции. Причиной падения веса являются: отсутствие переваривающей и резервуарной функции желудка, отсутствие механической обработки пищи в желудке, снижение стимуляции секреции желчи и панкреатического сока, неполное перемешивание пищи с панкреатическим соком и с желчью, повышенная кишечная перистальтика. Все эти функциональные нарушения ведут к понижению усвоения жиров и белков пищи.
Основой консервативного лечения является диета. Пища должна быть достаточно калорийной (не менее 50 кал на 1 кг веса больного), содержать 100—150 г белков, до 100 г легко усвояемого жира.
Больным после гастрэктомии следует назначать панкреатин, сернокислый атропин для снятия спазмов кишечника, гексоний и другие холинолитики.
Бесспорно, большое практическое значение имеют панкреатиты, возникающие после резекции желудка по поводу язвы или рака. Возникновение послеоперационного панкреатита возможно в результате непосредственной травмы поджелудочной железы, вызванной давлением хирургических инструментов, применяемых при резекции желудка, отделением участка желудка или двенадцатиперстной кишки от поджелудочной железы. Явления застоя в культе двенадцатиперстной кишки после резекции желудка могут в свою очередь вызвать застой в протоках поджелудочной железы, что также может явиться причинным моментом для возникновения острого послеоперационного панкреатита.
Имеется довольно обширная литература о возникновении панкреатитов после резекции желудка (Л. П. Волкова, 1966). Эти панкреатиты нередко являлись непосредственной причиной смерти. Распознавание этого осложнения довольно трудно, так как оно развивается в послеоперационном периоде и нередко диагностируется на секции.
У больного после резекции желудка, осложнившейся острым панкреатитом, появляется тахикардия, может наступить коллаптоидное состояние. В моче увеличивается содержание амилазы.
С. В. Лобачев (1958) представил данные о 166 больных, у которых во время резекции желудка имелась травма поджелудочной железы при отделении от нее опухоли или пенетрирующей язвы желудка. Из 166 больных у 38 развился послеоперационный панкреатит, закончившийся летально у 19 больных. И. Б. Тейтельбаум (1966) наблюдал 7 больных с острым панкреатитом после резекции желудка.
По статистическим данным Pendower и Tanner (1959), на 1689 операций на желудке было отмечено 12 летальных исходов (0,7%) от панкреатита. Авторы указывают, что данное осложнение возникало в различные сроки после операции — через недели и даже годы. Причиной панкреатита они считают травму железы и непроходимость приводящей петли анастомоза. По клинической симптоматике послеоперационные панкреатиты в зависимости от степени морфологических изменений в поджелудочной железе можно разделить на 3 группы: I группа — легкая форма без клинических проявлений, но с диастазурией; II группа — средней тяжести с повышением температуры тела, парезом кишечника, тахикардией, диастазурией; III группа — с тяжелыми деструктивными послеоперационными панкреатитами, с явлениями острого живота, тяжелыми сердечнососудистыми расстройствами, нерезко выраженной амилазурией. Жувара и Рэдулеску (1963) выделяют две группы послеоперационных панкреатитов после резекции желудка: 1) хронические панкреатиты проточного происхождения, когда предполагается функциональное или органическое препятствие в области главного протока; 2) хронический интерстициальный панкреатит — цирроз поджелудочной железы. Первый вид возникает в первые 9 дней после операции. Второй — синдром позднего хронического панкреатита. Следует упомянуть об исходе острого панкреатита в псевдокистозный панкреатит.
Лечение острого панкреатита в стадии отека железы — консервативное: голод в течение 3—5 дней, парентеральное и прямокишечное введение в сутки до 5 л физиологического раствора и внутривенное введение 150—200 мл 0,25% раствора новокаина, Длительное откачивание желудочного содержимого с помощью тонкого зонда для предупреждения расширения желудка, поступления желудочного сока в двенадцатиперстную кишку и тем самым способствовать уменьшению панкреатической секреции. Двусторонняя паранефральная новокаиновая блокада. При нестихающих болях — промедол, пантопон. Показано применение трасилола в 5% растворе глюкозы (500 мл) в первые 3 дня по 10 000 ЕД, в течение следующих 4—6 дней — по 6000 ЕД, в последующие 3 дня — по 400 ЕД.
Хирургическому лечению подлежат некротические формы острого панкреатита, а также формы, где при проводимом консервативном лечении обозначаются осложнение и последствия острого панкреатита (абсцесс железы, абсцесс сальниковой сумки, киста железы).
Лечение хронического панкреатита с обтурационной желтухой — хирургическое и состоит в наложении соустья между желчным пузырем и пищеварительным трактом, при дуоденостазе — устранение последнего хирургическим путем (А. М. Мирзаев, 1969).
При болевом панкреатите показана операция — постганглионарная невротомия. Наряду с хирургическим лечением отдельных форм хронического панкреатита, проводится консервативное лечение: прием внутрь липокаина, гексония; рентгенотерапия; диетотерапия, направленная на улучшение функции печени и желчевыделения. Запрещается употребление жирной пищи, сдобного теста и печенья, тортов, пирожных, варенья, сильных пряностей, мясных и рыбных консервов, алкогольных напитков. Прием витаминов С, B1, В2, В6, В12.
Последствия резекции желудка — Хирургия
Значимость отдаленных последствий резекции желудка вызывает бурные дискуссии и споры. Методичный контроль за состоянием больных, контроль появления последствий резекции желудка и их лечение на отдаленных сроках после резекции обязательны, иначе пациенты не смогут достичь наилучшего качества жизни, даже если операция не позволила излечить их. Качество жизни — трудно определяемый параметр. Хотя и существует несколько «инструментов» для изучения качества жизни, они в основном эффективны при проведении исследовательской работы. Регулярное наблюдение за больным, осуществляемое хирургом или другим обученным персоналом, — наилучший путь выявления и решения проблем, влияющих на физическое и психологическое благополучие больного после больших операций.
Основные отдаленные проблемы после резекции желудка и осложнения можно подразделить на группы:
- побочные эффекты и проблемы, возникающие после еды;
- нарушения питания больных;
Последствия резекции желудка и проблемы, возникающие после еды
Чувство быстрого переполнения желудка
Потеря резервуарной функции желудка приводит к ощущению ранней насыщаемости и (у некоторых больных) болям в эпигастральной области. Хотя проксимальный отдел тощей кишки после гастрэктомии и расширяется, он никогда не может полностью заменить собою желудочный резервуар. Поэтому все больные вынуждены в какой-то мере ограничивать объем принимаемой пищи. Чтобы обеспечить прием адекватного количества калорий при более частом питании небольшими порциями пищи, важны хорошие диетические рекомендации. Роль тонкокишечных резервуаров, заменяющих собой желудок, освещена выше: они, несомненно, уменьшают частоту ранней насыщаемости. Раннее опорожнение резервуара – частое последствие резекции желудка и причина ощущения переполнения желудка после еды, в этом случае необходимы адекватные действия диетолога. Более редкая причина ощущения переполнения желудка у некоторых больных, перенесших реконструкцию пищеварительного тракта при помощи У-образного анастомоза по Ру, — нарушения перистальтики длинной бранши соустья. Вследствие этого продвижение пищи по бранше замедляется, возникает боль во время еды и непроизвольная (а иногда и намеренная) регургитация пищи.
Ранний демпинг-синдром
Это одно из самых неприятных последствий резекции желудка. Ускоренное заполнение проксимального участка тонкой кишки гипертонической пищей приводит к быстрому перемещению жидкости из внеклеточного пространства в просвет пищеварительного тракта. Оно также запускает сложную нейрогуморальную реакцию, вызывающую у некоторых больных различные неприятные желудочно-кишечные и сердечнососудистые симптомы. Важнее всего, что демпинг-синдром вызывает у больных стремление избегать еды. При тяжелых последствиях резекции желудка больной становится нетрудоспособным после еды либо страдает от профузной диареи, мешающей его нормальной активности. Качество жизни может ограничиваться очень сильно, причем у этих больных может быстро развиться недостаточность питания.
Возможно, к счастью, больные после тотальной и субтотальной гастрэктомии имеют небольшой желудочный резервуар и потому не могут съедать большое количество гипертонической пищи. Этот синдром гораздо чаще появляется (и проявления его тяжелее) у лиц с интактным желудком, у которых разрушен привратник либо наложен обходной анастомоз вокруг привратника. Также он возникает после резекции двух третей желудка. Многие больные, перенесшие гастрэктомию, испытывают проявления демпинг-синдрома в первые недели после операции, однако у большинства из них симптоматика относительно умеренная и уменьшается после простого регулирования диеты, которое больные часто «открывают» для себя самостоятельно. На ранних сроках наблюдения важно выявить значительно выраженные проявления демпинг-синдрома. Следует тщательно собрать анамнез. В неясных случаях больного просят вести записи характера принимаемой пищи и симптомов, испытываемых им после еды. У каждого больного, испытывающего послеобеденные боли в течение первых месяцев после гастрэктомии, нужно подозревать демпинг-синдром, поскольку он гораздо более вероятен, чем рецидив заболевания. Нередко «послеобеденные» симптомы ошибочно интерпретируются как признаки раннего рецидива, автор встречал больных, начавших принимать наркотические анальгетики, чтобы контролировать свои боли. Большинству больных с последствиями резекции желудка можно помочь, лишь подобрав подходящую диету. При ведении больных с демпинг-синдромом важно привлечь опытного диетолога.
Реактивные гипогликемические приступы
Нередко реактивные гипогликемические приступы неверно называют «поздним демпинг-синдромом». У многих больных такие последствия резекции желудка возникают без симптомов раннего демпинг-синдрома. Признаки гипогликемии, включающие в наиболее тяжелых случаях обмороки и аналоги эпилептических припадков, возникают через 2 ч после приема пищи. Часто больному в начале приступа хочется сладкого.
Первый шаг в лечении последствий резекции желудка — оценка диеты, после чего больному рекомендуют уменьшить прием углеводов во время основного приема пищи и употреблять небольшое количество углеводов в промежутках между основной едой. Подробного объяснения сути проблемы обычно достаточно, чтобы убедить больного в том, что у него нет тяжелого заболевания. Те же пациенты, у которых приступы повторяются часто, должны иметь при себе таблетки декстрозы, чтобы принимать их при первых признаках гипогликемии.
Диарея
Понос после резекции желудка может возникать в силу нескольких причин. Нередко диарея возникает в конце или после приступа демпинг-синдрома, как часть комплекса симптомов. В отличие от постваготомической диареи приступ бывает спровоцирован приемом большого количества гипертонической пищи и сопровождается другими признаками демпинг-синдрома.
Избыточный рост бактерий
Возникает достаточно часто после гастрэктомии, во время которой производят сложные реконструкции либо создают резервуары со «слепой» браншей. Избыточный рост бактерий в проксимальном отделе тонкой кишки также может произойти после реконструкции с У-образным анастомозом по Ру. Сочетание утраты желудочного сока, разрушающего проглоченные патогенные бактерии, и образования «слепых петель» кишечника способствует размножению как аэробных, так и анаэробных бактерий, в норме происходящему только в толстой кишке. Эти фекальные бактерии синтезируют токсины, разрушающие энзимы ворсинчатого эпителия, жизненно важные для пищеварения. Они также могут поглощать важные питательные вещества, например витамины группы В. Патогенные анаэробные микроорганизмы вызывают деконъюгирование и дегидроксилирование желчных кислот, необходимых для нормальной абсорбции жира в проксимальном отделе тонкой кишки.
Содержание жира в каловых массах значительно увеличивается. В худших случаях у больного возникают стеаторея и быстрая потеря массы тела. Диагноз этого последствия рака желудка может быть подтвержден путем интубации проксимального отдела тощей кишки с аспирацией кишечного сока для посева на культуру бактерий. Наилучший неинвазивный тест для определения размножения бактерий — определение 14С-глюкохолата в выдыхаемом воздухе. Доказанный избыточный рост бактерий, вызывающий диарею и недостаточность питания, можно лечить пероральным приемом антибиотиков, таких как неомицин или метронидазол. Во время курса лечения антибиотиками и после него следует назначать свежий непастеризованный йогурт и препараты из лактобактерий для подавления повторной колонизации кишечника патогенными бактериями. Лишь в крайне резистентных случаях можно решаться на повторные операции.
Стеаторея
Причинами этого последствия резекции желудка могут быть размножение бактерий и относительная недостаточность поджелудочной железы, вызванная плохим перемешиванием дуоденального содержимого с пищей при реконструктивных операциях с выключением двенадцатиперстной кишки из пассажа кишечного содержимого. Больные с нарушением всасывания жиров жалуются на метеоризм и толстокишечные колики. Стул у них объемный, жирный, всплывающий, его трудно смывать. Тщательно собранный анамнез позволяет выявить проблему. Если исключено избыточное размножение бактерий либо оно излечено, тогда персистирующая мальабсорбция жиров может поддаться лечению препаратами, содержащими панкреатические энзимы, принимаемыми до еды (а лучше в смеси с пищей).
Рефлюкс желчи
Заброс желчи и щелочных соков в оставшуюся часть желудка или пищевод может вызвать дискомфорт в эпигастральной области, изжогу и рвоту либо регургитацию желчи. В худшем случае больной отказывается от пищи, опасаясь усиления симптомов. Персистирующий пищеводный рефлюкс может вызвать стриктуру.
Диагноз обычно устанавливают на основании клинических данных. Объективно его можно подтвердить путем сканирования с технецием-99-HIDA. Необходима гастроскопия для выявления возможного повреждения слизистой оболочки и исключения иной причины симптомов.
Лечение зачастую неэффективно, поэтому на первое место выступает решение проблемы путем реконструктивной операции, изменяющей путь прохождения желчи. Сохранение симптомов становится основанием для последующей операции, направляющей дуоденальное содержимое в ином направлении или удлиняющей браншу У-образного анастомоза по Ру.
Статью подготовил и отредактировал: врач-хирург Пигович И.Б.
Видео:
Полезно:
Ранние осложнения после операции на желудке
Характер и размер ранних осложнений зависит в большей степени от оперативного вмешательства, чем от основного заболевания.
Послеоперационное кровотечение может возникнуть из артерий в области анастомоза после операции резекции
желудка или гастроэнтеростомии или, реже, из просмотренной язвы желудка, или из изъязвившейся раковой опухоли после паллиативной операции гастроэнтеростомии.
При ранних желудочных послеоперационных кровотечениях показано промывание желудка небольшими порциями воды температуры 50° С или раствором 0,15% хлористого железа. Необходимо следить за показателями гемоглобина и гематокрита. Их изменения определяют показания к применению гемостатических (50,0—100,0) или заместительных (250,0—500,0) доз трансфузий крови.
При поздних послеоперационных кишечных кровотечениях речь может идти о кровотечениях из язвы двенадцатиперстной кишки после операции резекции желудка для выключения. В этом случае кровавой рвоты не будет, но возникают симптомы внутреннего кровотечения и дегтеобразный стул. Показаны гемостатические и заместительные трансфузии крови.
Если консервативные мероприятия по остановке желудочного кровотечения оказываются неэффективными, то показана операция гастротомии для обнаружения источника кровотечения и его ликвидации.
Послеоперационная атония желудка. В происхождении послеоперационной атонии культи желудка важную роль играют две группы причин: механические и функциональные. К первым относятся острый отек слизистой оболочки желудка в области анастомоза, редко возникающая инвагинация отводящей петли кишки в культю желудка и слишком узкое отверстие анастомоза. Ко второй группе принадлежит преходящая блокада вагуса с нарушением перистальтики желудка.
Первым симптомом развивающейся атонии желудка является уменьшение суточного диуреза до 200—400 мл с последующим развитием хлорипривной азотемии, нарушается электролитный баланс, что проявляется гипохлоремией и гипокалиемией. Доказано, что при послеоперационной атонии желудка имеет место дефицит калия, который обусловливает мышечную слабость, истощение, вялость кишечника, олигурию, сгущение крови, сердечную недостаточность. Гипокалиемия развивается быстро, вместе с тем происходит потеря ионов хлора и накопление ионов натрия, что приводит к алкалозу.
Все это побуждает к ежедневному контролю в сыворотке крови и в моче ионов калия и хлора и введению внутривенно растворов солей калия и натрия. Эти вливания способствуют выравниванию гипохлоремической (экстраренальной) азотемии. Надо избегать введения излишков калия.
Кишечная непроходимость. После резекции желудка через несколько дней или через несколько лет может возникнуть инвагинация тощей кишки в желудок, причем внедрившаяся в желудок кишечная петля отекает и образует внутри желудка пальпируемую «опухоль». Чаще инвагинация возникает остро, и ее сопровождают симптомы высокой желудочной или желудочно-кишечной непроходимости: коллапс, рвота с примесью крови или желчи, симптомы перитонита от прободения. Важность рентгеновского контрастного исследования становится очевидной. Лечение — срочная операция, попытка девагинации и при неуспехе ее — резекция внедрившейся части кишки.
Нарушение проходимости желудочно-кишечного анастомоза может возникнуть и вследствие заворота приводящей или отводящей петли тощей кишки с поворотом на 180 или 360°. Симптоматика заворота весьма похожа на вышеописанную при инвагинации. Лечение — оперативное и состоит в развертывании заворота кишечной петли или в освобождении ее из места ущемления. При некрозе петли кишки показана резекция некротически измененной ее части (М. М. Левин, 1961; М. Э. Комахидзе и Т. И. Ахметели, 1963).
Желтуха после операции на желудке. Развивается через несколько дней после операции, может быть обусловлена двумя причинами: 1) непроходимостью общего желчного протока в результате перевязки его или пересечения на уровне верхнего края двенадцатиперстной кишки и 2) небольшими кровотечениями и повышенным распадом эритроцитов, ведущим к повышению свободного билирубина сыворотки крови (резорбционная желтуха). Механическая желтуха с каждым днем будет нарастать, чего не будет при резорбционной желтухе. Механическая желтуха служит показанием для срочной операции по восстановлению проходимости желчного протока.
Порочный круг (Circulus vitiosus). Порочным кругом принято называть состояние, при котором желудочное содержимое при наличии гастроэнтероанастомоза переходит из желудка через привратник в двенадцатиперстную кишку в приводящее колено петли тощей кишки, участвующей в образовании анастомоза. Отсюда при наличии препятствия в анастомозе для перехода содержимого желудка в дистальную часть петли тощей кишки оно вновь возвращается в желудок.
При гастроэнтероанастомозе с брауновским энтероанастомозом механизм образования порочного круга будет несколько иной: пища из желудка быстро переходит в приводящее колено петли тощей кишки, образующей анастомоз, и сдавливает межкишечный анастомоз, что ведет к обратному поступлению желудочного содержимого в желудок.
В клинических симптомах, имеющих много общего с вышеописанными явлениями высокой непроходимости, преобладают постепенное возникновение ощущения тяжести под ложечкой, переходящее в чувство распирания, обильные рвоты непереваренной пищей. Контрастное рентгеновское исследование желудка устанавливает истинную причину высокой непроходимости.
Лечение — оперативное, направленное на устранение непроходимости.
Резекция желудка — послеоперационный период .МЦПК. Русаков В.И. 1996
Успех выполненных операций во многом зависит от лечения в послеоперационном периоде. В основе ведения послеоперационного периода должно лежать представление о том, что больному по поводу серьезного заболевания, вызвавшего существенные изменения в организме, выполнена большая травматичная операция. На первом плане в первые двое суток должна быть борьба с послеоперационным шоком, регуляция гомеостаза и обеспечение функции сердечно-сосудистой и легочной систем при продолжающейся коррекции функций печени, почек, поджелудочной железы и кишечника.
После операции больного целесообразно поместить в палату интенсивной терапии на функциональную кровать с теплыми (но не горячими) грелками у ног. До утра больной лежит ровно, без подушки. Со следующего дня его надо уложить в наиболее физиологичное положение по Фовлеру.
Положение больного по Фовлеру

Резекция желудка – послеоперационный период .МЦПК. Русаков В.И. 1996
Тотчасже обеспечивается подача кислорода, который надо увлажнять, пропуская через сосуд с водой. Кислород следует давать в течение 2—3 дней с перерывами. Постоянная дача кислорода приводит к угнетению дыхания, высыханию слизистой оболочки Дыхательных путей, что может способствовать возникновению легочных осложнений.
Надо предусмотреть снятие болевых ощущений, что в первые два дня обеспечивается подкожным введением 1 мл 1—2%-ного раствора промедола или пантопона каждые 4—6 часов. В последующие дни обезболивающие средства вводят 1—2 раза в день, а на 3—4 день отменяют. При появлении признаков шока (падение артериального давления, слабый пульс, холодный пот, резкая бледность и т. д.) немедленно начинают переливание крови, под кожу вводят 2—3 мл 20%-ного камфорного масла и 1 мл 10%-ного раствора кофеина. При падении сердечной деятельности хороший эффект дает внутривенное вливание 40%-ного раствора глюкозы (40—50 мл) с добавлением 1—2 капель настойки строфанта (раствор надо вводить очень медленно). Целесообразно введение 30%-ного раствора винного спирта, приготовленного на 40%-ном растворе глюкозы (50—60 мл). Непременным условием является дача кислорода и выключение болевой импульсации инъекциями обезболивающих средств, внутривенным вливанием 0,25%-ного раствора новокаина (50—100 мл), межреберными блокадами.
Больной доставляется в послеоперационную палату с неотключенной капельницей. При тяжелых операциях лучше пунктировать подключичную вену и катетеризировать ее. Путем внутривенных вливаний обеспечиваются регуляция водно-солевого обмена, борьба с шоком и при надобности парентеральное питание.
В первые сутки после операции целесообразно перелить 150—200 мл крови. В сутки больной должен получить около ‘3000—3500 мл жидкости, часть которой вводят внутривенно, а часть — через зонд. При удовлетворительном состоянии больного и быстрой компенсации функций жизненно важных органов вены перегружать не следует.
Для обеспечения парентерального питания А. Н. Филатов (1963), Н. Ф. Кошелев (1975) рассчитали количество необходимых больному веществ (в сутки на 1 кг веса): воды — 60мл, хлористого натрия — 0,2 г, хлористого калия — 0,01 г, глюкозы — 1 г, белка — 1 г (в виде белковых растворов), жира — 1 — 1,5 г. Значит, для больного весом 60—65 кг в среднем необходимо ввести за сутки 60—65 г глюкозы, 12 г хлористого натрия, 0,6 г хлористого калия, 60—65 г белка, 60 г жира и 3000— —3500 мл воды. Эти данные нашли подтверждение в исследованиях М. Н. Логаткина (1963) и других авторов.
Необходимое количество глюкозы вводят в виде 5%-ного и 40%-ного растворов, соли — в виде жидкости Дарроу, раствора Рингера или физиологического раствора поваренной соли, белки — в виде плазмы или белковых растворов, жир — в виде 10%-ной эмульсии. Введение глюкозы надо сочетать с подкожными инъекциями инсулина из расчета 4—5 ЕД на 10 г сухой глюкозы. Дефицит калия можно восполнять внутривенным вливанием 3%-ного раствора хлористого калия (по 10—15 мл).
При осуществлении коррекции водного баланса надо иметь и виду, что вода в организме человека составляет около 70% веса.
Контролировать правильность коррекции необходимо по количеству выделяемой в сутки воды почками, кожей и легкими, а также регулярным исследованием сахара крови, электролитов, кислотно-щелочного равновесия.
Желательно обеспечить выполнение исследований, позволяющих точно регулировать состояние гомеостаза. В. С. Маят и соавт. (1975) представили основные показатели гомеостаза.
Выполнять расчеты коррекции гомеостаза представляется порою затруднительным, поэтому большое практическое значение имеют результаты исследований Э. Н. Айтакова, И. В. Егорова и А. А. Орлова (1974), которые установили, что суточные потери калия с мочой после радикальных операций на желудке составляют 60—80 мэкв, что корригируется введением 1500—2000 мл 5—10%-ного раствора глюкозы (с инсулином), содержащего 40 мэкв/л калия; метаболический ацидоз хорошо корригируется добавлением 10 мл 4%-ного раствора бикарбоната натрия на каждые 100 мл перелитой цитратной крови.
Большое значение в послеоперационном периоде следует уделять обеспечению больного витаминами. Эффективной витаминотерапия бывает только при хорошей обеспеченности белками. При недостатке белков витамины могут выводиться с мочой как ненужные вещества (Н. Ф. Кошелев). Особое значение придают аскорбиновой кислоте, которую целесообразно вводить в больших дозах (500 мг) внутривенно до операции и в послеоперационном периоде. Аскорбиновая кислота повышает защитные реакции организма и, в частности, повышает функцию коры надпочечников (Т. Н. Мордвинкина, 1970).
Питание через зонд можно начинать с первого дня после операции, вводя небольшие порции жидкости (чай, кипяченая вода, 5%-ный раствор глюкозы по 20—30 мл) шприцем. Жидкость надо вводить очень медленно, без насилия. Если нет не приятных ощущений (боли, вздутие живота, тошнота), то такие вливания жидкости постепенно увеличивают, доводя их за сутки до 500, а затем до 1000—1500 мл, уменьшая соответственно количество внутривенных вливаний. Перед введением в зонд жидкости необходимо откачать содержимое из кишки. Откачивание содержимого через зонд мы проводим 2—3 раза в сутки. Правда, это в основном сводится к попыткам, так как при наличии содержимого оно вытекает через зонд, опущенный в сосуд ниже уровня тела больного.
После резекции желудка зонд мы держим 2—3 дня, а после гастрэктомии — 6—7 дней. Прием жидкости и питание через рот у больных после дистальных резекций разрешаем на следующий день после операции (если нет пареза и застоя содержимого в культе желудка): чай, затем простокваша, несладкий кисель, слабый бульон и т. д. Больному объясняем необходимость делать маленькие глотки и прислушиваться к ощущениям в животе. При малейших признаках неприятных ощущений задерживаем питание через рот. Rachlin (1973) рекомендует раннее кормление через рот без компрессии желудка. Автор утверждает, что никакое парентеральное питание не может заменить кормления через рот; дает схему питания: через 24 часа 60 мл воды или чая каждый час и внутривенно 1000 мл 5%-ного раствора глюкозы, через двое суток — жидкие каши, вегетарианские супы, компот. Rachlin делает вывод, что раннее физиологическое питание препятствует нарушению электролитного баланса, что предупреждает парезы кишечника.
После гастрэктомии и проксимальных резекций разрешаем питание через 6—7 дней в присутствии врача. У больных после трансторакальных операций строго контролируется функция левого легкого. Ежедневно через трубку откачивают содержимое плевральной полости. При гладком течении через 2—3 дня трубку удаляют.
Непременным условием является контроль за состоянием сердечно-сосудистой деятельности. С первого дня назначают подкожные инъекции камфорного масла по 2 мл (в подогретом виде) 3 раза в сутки. Камфорное масло не только благоприятно влияет на сердечно-сосудистую деятельность, но и улучшает вентиляцию легких, в определенной степени обеспечивая профилактику бронхитов и пневмонии. При надобности назначают кордиамин, коргликон и другие сердечно-сосудистые средства.
В первые 3—5 дней после операции у всех больных следует определять активность амилазы крови и мочи. Это необходимо для своевременного распознавания послеоперационных панкреатитов и раннего применения ингибиторов протеиназ (тразилола, цалола, контр икала и т. п.) и других средств лечения панкреатита.
Важнейшее значение имеет лечебная гимнастика с первого дня послеоперационного периода. Мы разрешаем больному шевелить руками и ногами в первый день операции. Со следующего дня проводится 2—3 раза в день комплекс дыхательных упражнений с минимальной нагрузкой. Постепенно, сообразуясь с состоянием больного и временем, прошедшим с момента операции, расширяют объем и нагрузку лечебной гимнастики. Мы – за самое раннее вставание с постели. После обычной резекции желудка разрешаем больным садиться и вставать через 2—3 дня. а после гастрэктомии и проксимальной резекции — через 4—5 дней, конечно, при учете состояния больного, показателей гемодинамики, состояния живота, эмоционального состояния и т. д. Лечебная гимнастика — это лучший способ профилактики тромбозов, эмболии, легочных и других осложнений.
Антибиотики назначаем в небольших дозах и непременно в сочетании с метилурацилом, который вводим вначале внутри¬венно, затем через трубку и, наконец, через рот в течение всего послеоперационного периода из расчета 1 — 1,5 г в сутки. При показаниях делают повторные переливания крови, плазмы и кровезаменителей.
Если возникает вздутие живота, задержка газов и стула, то назначают гипертоническую или солевую клизму. При малом эффекте внутривенно вливают 20—80 мл 10%-ного раствора поваренной соли, под кожу прозерин (1 мл 0,05%-ного раствора) пли питуитрин (1 мл — 5—10 ЕД). Хороший эффект оказывает новокаиновая поясничная блокада но Вишневскому.
При гладком течении послеоперационного периода через 3—4 дня больного переводят в общую палату. Через 6—7 дней снимают швы, еще через 2 3 дня делают контрольное рентгенологическое исследование и выписывают из клиники.
В течение всего послеоперационного периода необходим контроль за состоянием свертывающей системы крови и немедленная коррекция при отклонениях от нормы. Для профилактики паротитов нужен ежедневный туалет ротовой полости. Надо уделять внимание общим гигиеническим мероприятиям и ю мере улучшения состояния больного привлекать его к самостоятельному их выполнению.
Послеоперационный период с первых дней опасен рядом серьезных осложнений, особенно часто встречающихся после, гастрэктомии и проксимальной резекции желудка. Б. Е. Петерсон (1972) па 203 гастрэктомии и проксимальные резекции осложнения получил у 45% больных, а А. И. Саенко (1973) на 500 гастроэктомий – у 26,8%- Осложнения делят па ряд групп:
1) Осложнения со стороны операционного поля: а) шок, б) кровотечение, в) несостоятельность анастомоза, г) несостоятельность культи двенадцатиперстной кишки, д) перитонит, с) эмпиема плевры (плеврит), ж) медиастинит, з) ограниченные абсцессы (разной локализации), и) парез культи желудка и кишечника, к) анастомозит, л) нагноение раны.
2) Осложнения со стороны сердечно-сосудистой деятельности: а) недостаточность сердечно-сосудистой деятельности, б) тромбозы и эмболии, в) фибринолиз.
3) Осложнения со стороны органов дыхания: а) бронхиты, б) пневмонии, в) ателектаз легкого, г) дыхательная недостаточность.
4) Осложнения со стороны других органов: а) острый панкреатит, б) печеночная недостаточность, в) механическая желтуха, г) почечная недостаточность, д) острые паротиты, е) задержка мочи, ж) острые психозы.
Подробное описание причин, патогенеза, диагностики и лечения приведенных послеоперационных осложнений потребовало бы специального руководства. Поэтому остановимся на характеристике наиболее важных осложнений и дадим некоторые рекомендации по их лечению.
Противошоковые мероприятия проводятся в палате интенсивной терапии. Основные элементы диагностики и лечения Шока представлены выше.
Наибольшую опасность представляют следующие три послеоперационные осложнения: несостоятельность анастомоза, культи двенадцатиперстной кишки и перитонит. Эти осложнения среди других занимают первое место. Понятно, что основной Причиной перитонита является несостоятельность швов.
В. А. Иванов. Т. В. Котлукова (1967) при изучении причин смерти у 400 больных, оперированных по поводу рака кардиального отдела желудка в хирургических отделениях Москвы с 1945 по 1966 год, установили, что 148 (37%) умерли от недостаточности анастомоза, а 82 (21%)—от пневмонии. Б. А. Королев и соавт. (1973) после чресплевральных комбинированных резекций при раке проксимального отдела желудка несостоятельность анастомоза получили у 8% больных, что явилось причиной смерти 41,2% умерших. Э. Н. Ванцян и соавт. (1974) после 121 радикальной операции (из которых 31 была комбинированной) несостоятельность швов получили у 18 (14,8%) больных, из которых 15 умерло. А. А. Русанов, Ю. Ю. Зубовский (1974) но материалам 116 отечественных и иностранных авторов за период с 1947 года по 1970 год суммировали осложнения, приведшие к смерти 2067 больных с кардио-эзофагеальным раком. Среди них у 22,1% была несостоятельность швов анастомоза. Среди своих 774 радикально оперированных больных А. А. Русанов получил осложнения у 154 больных; несостоятельность анастомоза составляла 20%. Ghosh, Goldsmith (1972) после 393 операций по поводу рака получили несостоятельность анастомоза у 22 (5,6%) больных: у 4 — после гастрэктомии, у 10 — после субтотальной резекции желудка, у 8 – после комбинированных резекций.
Первое место среди других осложнений несостоятельность швов занимает и в материале В. А. Конджария и соавт. (1971), Б. Е. Петерсона (1972), Р. Б. Бороздиной, А. А. Пономарева (1975) и других авторов. Как видно из приведенных статистик, несостоятельность швов с первых операций и до настоящего времени встречается часто и является основной причиной смерти больных после резекции желудка любого объема. На нашем материале несостоятельность швов после гастрэктомий и проксимальных резекций составила 4,7%, после обычных резекций — 1 6%, после обходных анастомозов несостоятельности швов не было.
Несостоятельность швов проявляется в первые 3—6 дней после операции. У этих больных, как правило, имеются предвестники грозного осложнения: беспокойство, боли в животе или за грудиной (в области анастомоза), повышенная температура, изменение в формуле белой крови, вялое течение послеоперационного периода. Несостоятельность проявляется чаще всего внезапным появлением болей в животе или в левой половине грудной клетки (после трансплевральных операций), напряжением мышц живота, беспокойным поведением, резким учащением пульса, падением артериального давления. При поздней несостоятельности швов клиническая картина утяжеляется и на этом фоне начинают вырисовываться симптомы нарастающего перитонита после трансабдоминальных операций, плеврита или медиастинита (ограниченного или тотального) — после трансплевральных операций.
При малейшем подозрении на несостоятельность швов, при отсутствии ощутимого эффекта от интенсивной противовоспалительной, противомикробной и дезинтоксикационной терапии надо немедленно брать больного в операционную, ревизовать область бывшего вмешательства и обеспечить при наличии свища свободный отток содержимого наружу. Если представляется возможность, то надо ушить образовавшийся дефект анастомоза, культи двенадцатиперстной кишки или желудка. При несостоятельности пищеводно-желудочного или пищеводно-кишечного анастомоза может стать рациональным наложение еюностомы.
К сожалению, повторные оперативные вмешательства часто оказываются запоздалыми или неэффективными и большинство больных с несостоятельностью швов погибает. Лучшие результаты даст своевременное оперативное вмешательство при несостоятельности культи двенадцатиперстной кишки. Дать рецепт о тактике в каждом отдельном случае этих осложнений невозможно. Перспективы на успех открывает самое раннее повторное оперативное вмешательство, направленное на предотвращение разлитого перитонита или эмпиемы плевры.
При парезе культи желудка и кишечника первым мероприятием должно быть откачивание содержимого и промывание желудка, эвакуация содержимого кишечника и стимуляция тонуса и перистальтики.
Все эти осложнения в нашей клинике, так же как и нагноение раны, встречаются редко. Нам совершенно непонятны огромный процент нагноений после резекций желудка (29,6%!), приведенный в статье Р. Б. Бороздиной и А. А. Пономаревым (1975),и большое число (до 20%) абсцессов около анастомозов, о которых пишут Kossetti (1963) и А. А. Русанов (1974). Кровотечения после операций на желудке бывают редко. Принципы лечения понятны: промывание ледяной водой, холод на живот, кровоостанавливающие средства (включая применение эпсилонаминокапроновой кислоты, ингибиторов протеиназ), переливание крови. При отсутствии эффекта — повторное оперативное вмешательство.
Тромбозы и эмболии надо не лечить, а предупреждать их возникновение. При первых признаках повышения свертывания крови необходимо назначать в небольших дозах антикоагулянты непрямого пли прямого действия, а при симптоматике тромбоза и эмболии — большие дозы гепарина и фибринолизина. У нас они бывают исключительно редко. Самым эффективным средством при лечении фибринолиза является прямое переливание крови (в сочетании с комплексом средств, повышающих свертываемость крови).
Бронхиты и пневмонии лечат совместно с терапевтом. При ателектазе, несмотря на тяжелое состояние больного, надо делать бронхоскопию, откачать содержимое бронхиального дерева и раздуть легкое при обеспечении выхода воздуха и жидкого содержимого из плевральной полости.
Все другие осложнения должны быть в памяти у хирурга и реаниматолога. Диагностика их не представляет труда, общие принципы лечения одних изложены в первом томе «Основ частной хирургии», а других – в специальных руководствах. Острые психозы встречаются редко. В эти периоды больные ведут себя беспокойно, вырывают зонды, систему для внутривенного вливания, вскакивают. При появлении симптоматики психоза надо иметь в виду возможную связь этих симптомов с острой печеночной недостаточностью.
ИСХОДЫ. ОТДАЛЕННЫЕ РЕЗУЛЬТАТЫ
Результаты резекций желудка должны быть лучшими. Даже после обычных резекций летальность еще очень высокая. Цифры летальности, приводимые в литературе, пестрые, но преимущественно весьма высокие. Б. Г. Печерская, Я. И. Гринберг, В. Д. Мирончик (1973) сообщают о 7,8% летальности после радикальных резекций желудка. У А. А. Русанова (1974) после субтотальных резекций летальность составила 3,5%, у Г. H. Захаровой и В. Ф. Чуенкова (1971) — 5,5, у Н. П. Соинова (1973) — 7% .
После гастрэктомии и проксимальных резекций летальность значительно выше: Ю. Е. Березов (1957) сообщал о 21,8%, Ю. И. Юдаев, А. С. Кочан (1959) — о 10,5—19,1, Megyeri, Bodrogi (1969) — о 35,4%. У Б. А. Королева и соавт. (1970, 1973) после трансторакальных операций летальность составила 10,2%, после трансабдоминальных — 8,6, а после комбинированных — 18,1%. А. А. Русанов (1974) после трансторакальных операций получил летальность у 24% больных, после трансабдоминальных — у 11,3.
После гастрэктомии и проксимальных резекций мы получили летальность у 21,8% больных и объясняем это прежде всего запущенностью процесса и необратимыми изменениями в печени, почках и других жизненно важных органах. Есть основания сделать вывод, что у этих больных были исчерпаны все резервы защитных реакций, и операция стала непереносимой даже после самой тщательной предоперационной подготовки с применением средств, направленных на восстановление и компенсацию Жизненных функций организма. Причинами смерти были пневмония и отек легких, сердечно-сосудистая недостаточность, эмболия ветвей легочной артерии. Несостоятельность швов анастомоза была причиной смерти у 4,7% больных. Все умершие больные были старше 60 лет, летальность у которых выше. Так, на материале Всесоюзного научно-исследовательского института клинической и экспериментальной хирургии у больных пожилого и старческого возраста она составляет 23,1% (Э. Н. Ванцян и соавт., 1974). По данным Г. Н. Захаровой, В. Ф. Чуенкова (1971), послеоперационная летальность после гастро-энтероанастомоза составляет 10,9%, после пробной лапаротомии—6,1 %. На материале Megyeri, Bodrogi (1969) летальность после паллиативных операций составляет 9,1%. Б. А. Королев, А. М. Архипов, А. Н. Симонович (1972) после обходных чресплевральных анастомозов получили летальность у 9,9% больных, 70,9% больных умерли в сроки от 1 до 6 месяцев, а 21,8% — от 7 до 12 месяцев, Р. Б. Бороздина и А. А. Пономарев (1975) после паллиативных резекций получили летальный исход у 5,6% больных.
Мы на 40 паллиативных операций, из которых лишь у двоих были наложены свищи, летальный исход получили у 5 при локализации рака в области кардии. При локализации рака в дистальном отделе желудка летальных исходов не было.
Сведения об отдаленных результатах разноречивы, но больше малоутешительных данных. Е. Л. Березов (1960) пятилетнюю выживаемость получил у 32,5% больных, Lanrer и соавт. (1962) пишут о 44% — при раке I—II стадии и о 16% — при раке III стадии. С. А. Холдин (1965) писал, что после радикальных операции 5 лет живет 10—12% больных. Wangcnsteen (i960) пятилетнюю выживаемость получил у 15% больных, из которых половина своевременно радикально оперированы. По данным Б. Г. Печерской и соавт. (1973), более 5 лет жили 386%, причем оперированные во второй стадии — 37,1, а в третьей — 18%. По сведениям Л. А. Шустера (1973), через 5 лет после радикальной операции остались живы 30—40% больных. Э. Н. Ванцян, О. К. Скобелкин (1969) опубликовали хорошие результаты лечения рака кардии у двух больных при сроке наблюдения около 20 лет.
Lempinen, Paile, Hjelt (1973) установили, что при локализации рака в слизистой оболочке желудка более 5 лет живут 100% больных, при прорастании подслизистой — 50, при прорастании мышечной и серозной оболочек 21—20%.
Большой интерес представляют данные Koga (1970), который при раке слизистой желудка пятилетний срок жизни после операции установил у 100% больных, а при вовлечении в процесс подслизистой оболочки— у 87,5%. Этими сведениями подтверждается основная задача современного лечения рака — самое раннее распознавание заболевания.
По данным Е. Л. Березова (1960), после комбинированных резекций три года живет 15,2% больных, после паллиативных операций больные могут жить 2—3 года. По данным Б. А. Королева и соавт. (1973), после комбинированных операции по поводу рака проксимального отдела желудка пятилетняя выживаемость составила 22%. Однако авторы подчеркивают, что этот показатель определяется за счет операций с удалением селезенки; после резекции 2—3 органов показатель выживаемости снижается до 10%. Lempinen(1971Jпишет, что после паллиативных операций 94% больных умирает в первый год после операции.
В заключении можно отметить, что в последние два десятилетия результаты лечения больных раком желудка существенно не улучшились. Большие перспективы открывает ранняя диагностика рака желудка, что может обеспечить выздоровление большинству больных. Поздняя обращаемость больных, запоздалая госпитализация, большой процент неоперабельных больных и необходимость выполнения сложнейших операций в связи с распространенностью процесса являются основным тормозом в осуществлении больших сдвигов в проблеме лечения рака желудка. П. В. Власов (1974), ссылаясь на данные М. Г, Гринберга (1968) и А. Ю. Соловко (1971) о том, что в общей системе здравоохранения распознанный рак I—II стадии составляет от 2 до 10%, сетует на ничтожно малый удельный вес в общей массе больных, которые могут рассчитывать на хорошие отдаленные результаты. Однако в некоторых лечебных учреждениях, пишет далее автор, с хорошо поставленной диспансерной службой число больных с I—II стадией рака может превышать 50%. Это уже очевидные перспективы, которые должны в дальнейшем предусматривать почти 100%-ное раннее выявление рака желудка. В получении лучших результатов лечения ничтожно малое внимание уделяется необходимости повышения общих и местных защитных реакций организма, от чего прежде всего (при технически правильно выполненной операции) зависят непосредственные и отдаленные результаты.
Ранние осложнения после операций на желудке, их выявление, лечение и предупреждение
К ранним осложнениям относятся осложнения, возникающие на 2-7 день после операции.
Желудочное кровотечение возникает из швов на малой кривизне, желудочно-кишечного анастомоза, а также из оставшихся или вновь образовавшихся язв, эрозий на слизистой культи желудка. Чаще оно умеренное.
Поставленный на операции тонкий желудочный зонд позволяет распознать это состояние и оценить динамику кровотечения. Незначительная (до 50 мл) потеря свежей крови требует консервативных действий (местно холодный физиологический раствор, аминокапроновая кислота) при контроле за гемодинамикой и анализами крови. Гастродуоденоскопия, проведенная в неотложном порядке независимо от сроков операции с целью диагностики и эндоскопического гемостаза, облегчает ведение больного.
Ревизия желудка при экстренной релапаротомии выполняется через продольное гастротомическое отверстие на 4-5 см выше анастомоза с прошиванием кровоточащих участков под визуальным контролем.
Кровотечение в брюшную полость. Наиболее тяжелая причина — интраоперационная травма селезенки, печени, поджелудочной железы, коагулопатия. Важен контрольный дренаж после операции. Отделение более 200-250 мл свежей крови требует принятия энергичных мер.
Несостоятельность культи дуоденум — наиболее частое и грозное осложнение после операций по способу Бильрот-2 (при язвах встречается чаще).
Решающие факторы: плохое кровоснабжение из-за язвенно-склеротических изменений в зоне формирования культи и интраоперационной мобилизации дуоденум, гипертензия в культе, некроз головки поджелудочной железы (операционная травма или дуоденостаз). Кроме того, имеют значение общие причины: гипопротеинемия и анемия, раковая интоксикация, септические нарушения — все то, по поводу чего производится операция.
При диагностике несостоятельности необходима операция. Воздержаться от экстренной операции можно при хорошем оттоке по улавливающему дренажу и спокойном животе при удовлетворительном состоянии пациента.
Задачи релапаротомии: санация перитонита и формирование изолированного свища. Принципиальные позиции: при отсутствии разлитого перитонита действия должны быть локальны в верхнем этаже брюшной полости — подведение к отверстию дренажа для активной длительной аспирации. При дефекте большого размера применим способ типа Вельха: введение трубчатого дренажа (лучше обрезанного катетера Петцера) с кисетом и укутыванием сальником также для активной аспирации.
Полезно проведение назогастрального зонда через анастомоз в приводящую кишку.
Анастомозит возникает вследствие грубо наложенных швов некачественным шовным материалом, раздавливания и грубого манипулирования, небольшой длине желудочно-кишечного анастомоза, наличии воспалительного процесса в стенке желудка и дуоденум (обострение язвы, послеожоговый гастрит). Проявляется на 4-5 день обильным отделяемом по зонду, невозможностью питья и приема пищи. Лечение предусматривает противовоспалительные мероприятия, коррекцию обменных нарушений и восстановление энтерального питания. Ключевым является эндоскопическое проведение зонда за анастомоз для питания.
К ранним осложнениям также относятся ТЭЛА, пневмония, ателектаз, плеврит, острое расширение желудка, гастроплегия, поддиафрагмальный абсцесс, абсцессы брюшной полости, ранняя спаечная непроходимость, панкреатит.
34. Болезни оперированного желудка. Классификация. Клиника. Диагностика. Методы консервативного и оперативного лечения.
Болезни оперированного желудка – Патологические состояния, развивающиеся в отдаленном периоде послде резекции 2/3 –3/4 желудка или ваготомии и антрумэктомии, функциональные и органические нарушения в гастродуоденальной гепатобилиарной, кишечной зонах, с изменениями общего состояния и обмена веществ, проявляющиеся астеновегетативным, диспепсическим болевым синдромом. Классификация:
1) Синдромы с нарушением нейрогуморальной регуляцией: демпинг-синдром, синдром гипогликемии, синдром приводящей петли, постваготомические расстойства.
2) Функциональные: гепатобиллиарные , кишечные, нарушения функции культи желудка, деятельности поджелудочной железы, рефлюксэзофагит.
3) органические: рецидивы я.б. полипоз, рак.
4) смеш.
Демпинг-синдром –после резекции желудка, вследствие быстрого поступления желудочного содержимого из культи желудка в тонкую кишку, что вызывает гиперосмотический эффект и гиповолемию с возбуждением симпато- адреналовой системы и поступление в кровь катехоламинов. При возбужд. парасимпатической системы – поступление серотонина, кининов.что приводит к развитию клиники раннего демпинг-синдрома. В просвет кишки из сосудистого русла поступают жидкость и электролиты, что приводит к вазомоторным проявлениям. Клиника –демпинг-синдром возникает в первые шесть месяцев после операции. 1 степень – после сладкой и молочной пищи – слабость, потливость, головокружение, сердцебиение иногда боли в животе, Симптоматика не более 30 минут, пульс и АД почти не изменяются. При второй степени – присоединение шума в ушах, тошноты, тахикардии, длительность 30-60 минут, пульс и АД меняются на 15 ударов в минуту и мм.рт.ст. При третьей степени после любой пищи признаки вегетативного криза, обмороки, страх смерти. Длительность 1-2 часа. После окончания криза – обильное мочеиспускание. Пульс и АД меняются на 2о соответственно. Истощение. Диагностика: ОАК – анемия, копрограмма – стеаторея, креаторея. ФЭГДС с биопсией. Эндоскопия желудка, УЗИ. анамнез, клиника, рентген (быстрое опорожнение желудка, ускоренный пассаж бария, дискинезия тонкой кишки). Лечение: Диета. Мед: При выявлении хеликобактер – антихеликербактерная терапия; коррекция микрофлоры; седативные; препараты железа; при дистрофии анаболические средства, витамины; антиферментная терапия; антисеротониновая терапия, по показаниям – хир.коррекция. Длительность лечения 2-3- недели. Профилактика: питание не менее 5 раз в день, диета, общие рекомендации.
Гипогликемический синдром – развивается вместе с демпинг-синдромом. Заключается в: избыточный сброс пищи, богатой углеводами, гипергликемия, поступление в кровь избытка инсулина, снижение уровня глюкозы в крови. Г.с. начинается через 2-3- часа после еды. Длится 5-10 минут. Клиника: слабость, потемнение в глазах, головокружение, потливость, тремор, чувство голода, брадикардия и гипотония. Снижение сахара в крови, инсулин – выше, чем был натощак. Леч – купирование приемом простых углеводов – основное лечение – как при демпинг-синдроме.
Синдром приводящей петли— развивается после резекции желудка по способу Бильрот 2, когда образуется приводящая петля (Слепой отдел кишечника, состоящий из ДПК и сегмента тощей кишки до соединения с желудком). Механизм: нарушение эвакуации содержимого из приводящей петли как функциональной так и органической природы. Клиника 1 степень – распирающие боли в правом подреберье, срыгивание желчью с облегчением. Частота приступов не более 2 раз в месяц. При второй степени частота приступов 2-3- раза в неделю, уменьшение массы тела, снижение трудоспособности. При третьей степени – обильная рвота желчью, выраженная диспепсия, нарушение всасывания жиров, истощение. Диагностика: рентген ( заполнение всей приводящей петли, ее расширение и гипотония или гипертоническая дискинезия приводящей и отводящей петель). Эндоскопия. Лечение: диета – в зависимости от вида дискенезии. Нормализация моторно-эвакуаторной функции желчевыделительной системы (спазмалитики или прокинетики). Лечение дисбактериоза. Хир.лечение – создание гастроэнтероанастомоза с энтероэнтероанастомозом по Ру. ДЛ надежного дренирования ДПК. Постваготомические расстройства – после стволовой ваготомии в результате нарушения иннервации желудка и других органов ЖКТ – реже — после селективной проксимальной ваготомии: постваготом. гастростаз, рецидив я.б., постваготомическая дисфагия, постваготомическая диарея. Причины диареи: застой в желудке с гнилостным брожением, усиление моторики, дисбактериоз, денервация тонкой кишки, вызывающая ускоренный пассаж пищи. Лечение: при гастростазе и диспогии – регуляторы моторики. При рецидиве я.б. – противоязвенная терапия. При диарее диета, полиферментные, обволакивающие препараты, энтеросорбенты. Профилактика БОЖ – обоснованный выбор методы операции, адекватная послеоперационная реабилитация.
После резекции желудка: Хирургия | medikacentr.ru

Резекция желудка – это операция, при которой удаляют от четверти до двух третей желудка. Обычно такая операция проводится при раке желудка, тяжелой форме язвенной болезни, прободении желудка или других серьезных заболеваниях.
Как и любое хирургическое вмешательство, оно несет в себе определенные риски, возможность развития осложнений и требует соблюдения специальной диеты после проведения.
Питание после резекции желудка
Правильная диета после резекции желудка очень важна, поскольку позволяет быстрее восстановить пищеварительные функции и обмен веществ в организме.
Первые два дня после резекции нельзя принимать пищу через рот. Вместо этого больному вводят инъекции 5% раствора глюкозы с инсулином, физиологический раствор и другие жидкости для нормализации крови.
Только на третий день после операции можно выпить 2-3 стакана чая, употребляя их чайными ложками (ни в коем случае не целиком сразу). На следующий день больной питается с соблюдением диеты «ноль а».
Диета после резекции желудка заключается в приеме только жидкой и желеобразной пищи в небольшом количестве. Это необходимо для того, чтобы не возникало большой нагрузки на желудок и не начался метеоризм.
Можно употреблять кисели, фруктовое желе и сок, отвар риса, некрепкий бульон, отвар шиповника, сладкий чай. Нельзя употреблять молоко и молочные продукты, творог, цельные фрукты, овощи и ягоды, рыбу и мясо, яйца, хлеб.
Эти продукты запрещено употреблять даже в виде пюре. Должно быть не менее 7 приемов пищи в сутки, небольшими порциями. Либо можно питаться каждые 2-3 часа в течение суток. Такую диету следует соблюдать в течение 2-3 дней.
Далее больной переходит на диету «ноль б». Она отличается от вышеописанной диеты тем, что разрешается употребление жидкой (10%) рисовой, манной, гречневой каши, вареного яйца, белкового омлета. Питание по-прежнему происходит небольшими порциями, но сокращается до 6 раз в день.
Еще через несколько дней в рацион добавляется протертый творог, супы-пюре, пюре из паровых овощей и фруктов, отварной рыбы и мяса. Можно начать употреблять кисломолочные продукты. По-прежнему следует принимать пищу 6 раз в день.
Если больной чувствует себя хорошо и осложнений не возникает, то через 12 дней переходят на диету №1.
Эта диета также применяется для питания при гастрите, язве двенадцатиперстной кишки и желудка. Она разрешает употребление отварного или парного мяса и рыбы, подсушенных хлебобулочных изделий из пшеничной муки (несдобных), супов с протертыми овощами, паровых овощей, молочных продуктов, яиц, каш и пудингов, макарон, киселей и компотов из некислых ягод.
Запрещены такие продукты как сдобная и свежая выпечка, густые мясные бульоны, жирное мясо и рыба, консервы, жареные яйца, свежая белокочанная капуста, редька, щавель, огурцы, кислые ягоды, газированные напитки, алкоголь, кофе, шоколад.
Такую диету следует соблюдать не менее 4 месяцев. В дальнейшем можно постепенно вводить в рацион сдобную выпечку, сладости и прочее, за исключением молоко. Срок реабилитации после резекции желудка составляет 2-5 лет.
Возможные осложнения после резекции желудка
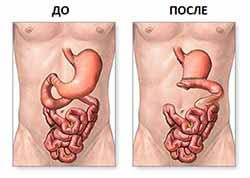 Одним из частых осложнений после резекции желудка является развитие демпинг-синдрома. Этот синдром связан с тем, что нарушается ферментативная и нервная регуляция пищеварительного тракта, из-за чего происходит слишком быстрое сбрасывание пищи из желудка в кишечник.
Одним из частых осложнений после резекции желудка является развитие демпинг-синдрома. Этот синдром связан с тем, что нарушается ферментативная и нервная регуляция пищеварительного тракта, из-за чего происходит слишком быстрое сбрасывание пищи из желудка в кишечник.
Демпинг-синдром часто возникает после употребления продуктов, богатых углеводами. Характеризуется схватками в животе, отрыжкой, болями в подложечной области, диареей, слабостью и головокружением, частым пульсом, сонливостью.
Симптомы развиваются примерно через час после еды. Для того чтобы снизить вероятность развития демпинг-синдрома, пищу нужно принимать маленькими порциями по 8 раз в день, снизить количество продуктов с углеводами, после приема пищи лежать в течение получаса. Могут быть назначены такие препараты как лоперамид иди дифеноксилат.
Другим частым осложнением после резекции желудка является потеря веса. Она связана с нарушением обмена веществ, уменьшением объема желудка, небольшими порциями съедаемой пищи, а также демпинг-синдромом с нарушением всасывания.
Нарушения всасывания также могут быть разными:
Нарушение всасывания железа при низком выделении соляной кислоты. Если была проведена резекция по Бильроту II,то может произойти нарушение всасывания железа, фолиевой кислоты и кальция. Это в свою очередь, может привести к остеопорозу и анемии.
Возможно нарушение всасывание витамина В12, это происходит при развитии хронического гастрита после удаления части желудка.
Для диагностики нарушения всасывания используется анализ крови и анализ кала. По результатам анализов врач вводит некоторые изменения в диету, может назначить лечение тетрациклиновыми препаратами.
Осложнением после гастрэктомии по Бильроту II может стать синдром приводящей петли. При этом в двенадцатиперстной кишке происходит ухудшение оттока жидкости (желчи и панкреатического сока), из-за чего идет растяжение приводящей петли.
Симптомом является сильная боль и приступ рвоты, после чего состояние улучшается. Для диагностики данного состояния используется сцинтиграфия или рентген с контрастным веществом (барием).
Лечение в большинстве случаев является хирургическим, т.к. лекарства в данном случае неэффективны.
В крайне редких случаях (менее 5% больных) после резекции возникает рак культи желудка. Он характеризуется потерей аппетита, потерей веса, желудочным кровотечением и рвотой.
КЛИНИКА, ДИАГНОСТИКА, ЛЕЧЕНИЕ. — Студопедия.Нет
Характер и размер ранних осложнений зависит в большей степени от оперативного вмешательства, чем от основного заболевания.
Послеоперационное кровотечение может возникнуть из артерий в области анастомоза после операции резекции желудка или гастроэнтеростомии или, реже, из просмотренной язвы желудка, или из изъязвившейся раковой опухоли после паллиативной операции гастроэнтеростомии.
При ранних желудочных послеоперационных кровотечениях показано промывание желудка небольшими порциями воды температуры 50°С или раствором 0,15% хлористого железа. Необходимо следить за показателями гемоглобина и гематокрита. Их изменения определяют показания к применению гемостатических (50,0—100,0) или заместительных (250,0—500,0) доз трансфузий крови.
Если консервативные мероприятия по остановке желудочного кровотечения оказываются неэффективными, то показана операция гастротомии для обнаружения источника кровотечения и его ликвидации.
Послеоперационная атония желудка. В происхождении послеоперационной атонии культи желудка важную роль играют две группы причин: механические и функциональные. К первым относятся острый отек слизистой оболочки желудка в области анастомоза, редко возникающая инвагинация отводящей петли кишки в культю желудка и слишком узкое отверстие анастомоза. Ко второй группе принадлежит преходящая блокада вагуса с нарушением перистальтики желудка.
Первым симптомом развивающейся атонии желудка является уменьшение суточного диуреза до 200—400 мл с последующим развитием хлорипривной азотемии, нарушается электролитный баланс, что проявляется гипохлоремией и гипокалиемией. Доказано, что при послеоперационной атонии желудка имеет место дефицит калия, который обусловливает мышечную слабость, истощение, вялость кишечника, олигурию, сгущение крови, сердечную недостаточность. Гипокалиемия развивается быстро, вместе с тем происходит потеря ионов хлора и накопление ионов натрия, что приводит к алкалозу.
Все это побуждает к ежедневному контролю в сыворотке крови и в моче ионов калия и хлора и введению внутривенно растворов солей калия и натрия. Эти вливания способствуют выравниванию гипохлоремической (экстраренальной) азотемии. Надо избегать введения излишков калия.
Кишечная непроходимость. После резекции желудка может возникнуть инвагинация тощей кишки в желудок, причем внедрившаяся в желудок кишечная петля отекает и образует внутри желудка пальпируемую «опухоль». Чаще инвагинация возникает остро, и ее сопровождают симптомы высокой желудочной или желудочно-кишечной непроходимости: коллапс, рвота с примесью крови или желчи, симптомы перитонита от прободения. Важность рентгеновского контрастного исследования становится очевидной. Лечение — срочная операция, попытка девагинации и при неуспехе ее — резекция внедрившейся части кишки.
Нарушение проходимости желудочно-кишечного анастомоза может возникнуть и вследствие заворота приводящей или отводящей петли тощей кишки с поворотом на 180 или 360°. Симптоматика заворота весьма похожа на вышеописанную при инвагинации. Лечение — оперативное и состоит в развертывании заворота кишечной петли или в освобождении ее из места ущемления. При некрозе петли кишки показана резекция некротически измененной ее части.
Желтуха после операции на желудке. Развивается через несколько дней после операции, может быть обусловлена двумя причинами: 1) непроходимостью общего желчного протока в результате перевязки его или пересечения на уровне верхнего края двенадцатиперстной кишки и 2) небольшими кровотечениями и повышенным распадом эритроцитов, ведущим к повышению свободного билирубина сыворотки крови (резорбционная желтуха). Механическая желтуха с каждым днем будет нарастать, чего не будет при резорбционной желтухе. Механическая желтуха служит показанием для срочной операции по восстановлению проходимости желчного протока.
Порочный круг (Circulus vitiosus). Порочным кругом принято называть состояние, при котором желудочное содержимое при наличии гастроэнтероанастомоза переходит из желудка через привратник в двенадцатиперстную кишку в приводящее колено петли тощей кишки, участвующей в образовании анастомоза. Отсюда при наличии препятствия в анастомозе для перехода содержимого желудка в дистальную часть петли тощей кишки оно вновь возвращается в желудок.
При гастроэнтероанастомозе с брауновским энтероанастомозом механизм образования порочного круга будет несколько иной: пища из желудка быстро переходит в приводящее колено петли тощей кишки, образующей анастомоз, и сдавливает межкишечный анастомоз, что ведет к обратному поступлению желудочного содержимого в желудок.
В клинических симптомах, имеющих много общего с вышеописанными явлениями высокой непроходимости, преобладают постепенное возникновение ощущения тяжести под ложечкой, переходящее в чувство распирания, обильные рвоты непереваренной пищей. Контрастное рентгеновское исследование желудка устанавливает истинную причину высокой непроходимости.
Лечение — оперативное, направленное на устранение непроходимости.
