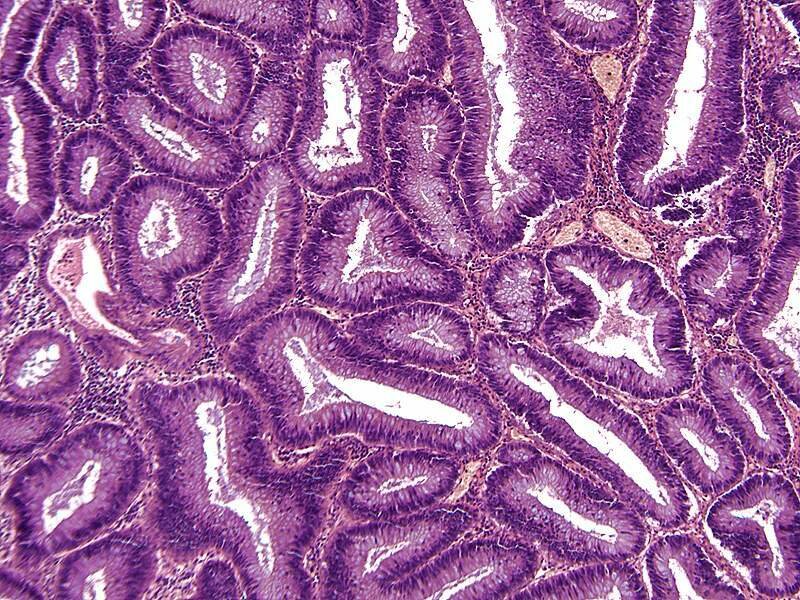
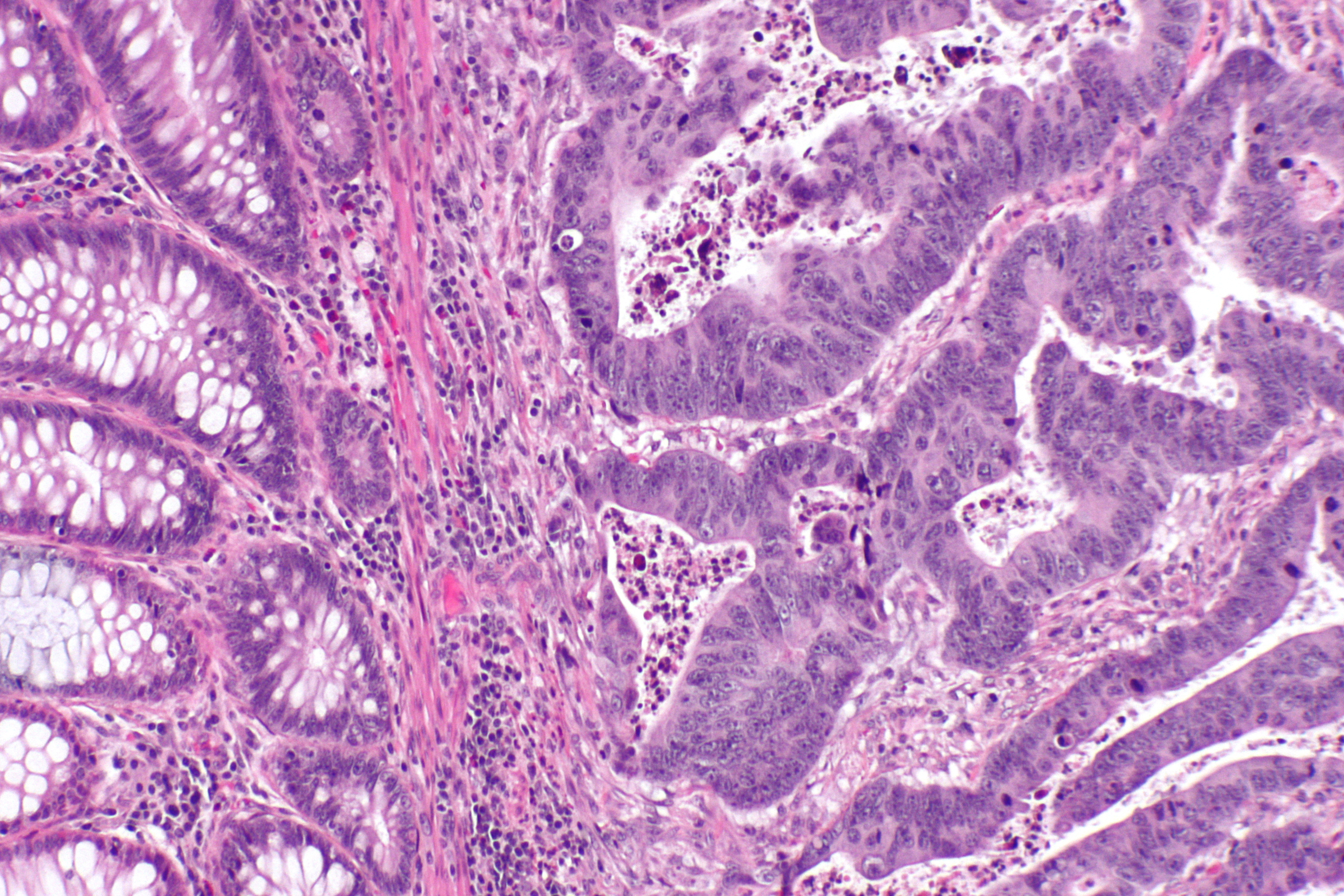
Аденокарцинома кишечника — онкологический центр «Sofia»
Стадии заболевания
Если поставлена аденокарцинома кишечника, стадии определяются при помощи разных классификаций. Есть более простая – английская, но в российской практике часто используют ту классификацию, которая была установлена еще во времена СССР. Она предполагает, что аденокарцинома кишечника имеет четыре основных стадии с дополнительными вариантами:
- I (первая). Опухоль находится на слизистой оболочке, а также в подслизистой части органа. Метастаз нет, расположение новообразования таково, что оно занимает меньше половины окружности кишки;
- IIа (вторая а). Раковое образование охватывает больше половины окружности, но не выходит за кишечную стенку. Метастазов в лимфоузлах нет;
- IIб (вторая б). Все то же самое, что и стадия «а», но уже наблюдаются метастазы в ближайших лимфоузлах;
- IIIа (третья а). Опухоль разрастается более, чем на полукруг, а также прорастает в стенку.

- IIIб (третья б). Эта стадия ставится, если в лимфатических узлах обнаруживаются многочисленные метастазы. Опухоль может быть любого размера;
- IVа (четвертая а). Большая опухоль, которая выходит за пределы кишечника, множественные регионарные метастазы;
- IV (четвертая б). Опухоль любых параметров, обнаруживаются удаленные метастазы.
Как и в случае с любым другим раком, аденокарцинома толстого кишечника усложняется по мере повышения стадии, поэтому с каждой ступенью требует все более серьезного лечения.
Факторы риска
К серьезным факторам риска относятся полипы толстой кишки, из которых нередко развивается аденокарцинома кишечника. На такую трансформацию влияет множество факторов, например, площадь основания самих полипов, их количество. Наиболее опасны множественные образования.
К факторам риска в плане заболеваний относятся и хронические воспаления толстой кишки, в том числе неспецифический язвенный колит.
Также есть и другие факторы риска:
- неправильное питание с недостаточным количеством клетчатки и обилием жирного, мучного;
- ожирение и гиподинамия – каждый из этих факторов способствует застаиванию каловых масс, что вредно для кишечника и его здоровья;
- пожилой возраст. С каждым этапом жизни иммунитет организма все слабее борется с опухолями;
- долгий контакт с излучением, канцерогенными веществами;
- сильные и регулярные стрессы, когда психическое состояние бьет по общему иммунитету;
- заболевания, связанные с обменом веществ, например, сахарный диабет;
- болезни, идущие «фоном», но связанные с различными воспалениями кишечника, органов малого таза.

Все, перечисленное списком, в отличие от конкретных заболеваний, не становится причиной рака напрямую. Это лишь те факторы, из-за которых аденокарцинома толстого кишечника рискует развиться с большей вероятностью.
Симптомы аденокарциномы кишечника
Рак кишечника аденокарцинома не имеет специфических проявлений, поэтому у него будут общие симптомы:
- слизь с примесью крови во время опорожнения кишечника;
- дискомфортные и болевые ощущения, которые пациент испытывает регулярно, но сильнее всего – в процессе дефекации;
- ощущение, что кишечник опорожнен не полностью, даже если человек только что сходил в туалет;
- регулярные запоры или поносы;
- повышенная слабость, утомляемость, общее недомогание.
Опасность заключается в том, что аденокарцинома кишечника имеет проявления, которые очень похожи, например, на геморрой. То есть без участия врача и тщательной диагностики обнаружить у себя такую проблему нельзя. Вот почему при обнаружении любых из перечисленных неспецифических симптомов необходимо обращаться к проктологу.
Вот почему при обнаружении любых из перечисленных неспецифических симптомов необходимо обращаться к проктологу.
Диагностика
Диагностика такого рака проводится по нескольким направлениям:
- осмотр врачом, сбор анамнеза;
- лабораторные исследования;
- колоноскопия. Является одним из самых информативных инструментов;
- УЗИ, КТ, эндосонография, МРТ, ПЭТ;
- гистологическое исследование – помогает дифференцировать виды рака.
Большое значение для выявления такого типа рака имеют скрининговые исследования. Регулярные дополнительные исследования рекомендуются людям старше 50 лет, а также лицам, у которых были обнаружены геморрой, разные воспалительные заболевания толстой кишки, новообразования другого характера. Также в процессе самого исследования важно дифференцировать разные заболевания и правильно поставить диагноз.
Лечение аденокарциномы кишечника
Когда поставлена аденокарцинома кишки, стадии определены и выявлены все особенности заболевания, назначается лечение.
Хирургическое вмешательство
Если поставлен диагноз аденокарцинома, операция требуется во многих ситуациях. Чаще всего, если опухоль поразила не только слизистый, но и подслизистый слой кишки. При небольших размерах опухоли ее удаление производится через задний проход. Также операция делается одномоментно или поэтапно – второй вариант характерен для тех случаев, когда вторжения метастазов довольно обширны и захватывают другие органы.
Лучевая терапия
Данный метод используют перед хирургическим вмешательством, если опухоль выросла через все слои кишки либо обнаружены метастазы. Курс лучевой терапии занимает несколько дней, после чего делается операция. Также есть ситуации, когда данный вид терапии применяется более длительное время с перерывами, а вопрос об операции решается отдельно.
Химиотерапия
Если обнаружена аденокарцинома кишечника на третьей или четвертой стадии, химиотерапия назначается в виде самостоятельного вида лечения или в комплексе с лучевой терапией.
Если удалена аденокарцинома кишечника, после операции нужно находиться в больнице под наблюдением врачей. А после лечения пациент еще два года наблюдается у врача каждые 6 месяцев, сдает анализы и проходит обследования. Это нужно для того, чтобы избежать рецидивов, вовремя принять необходимые меры.
Прогнозы
Вначале статьи мы уже вкратце упомянули о прогнозах в зависимости от типа рака (см. «Классификация аденокарциномы кишечника»), но немного уточним этот момент. Если поставлена аденокарцинома кишечника, прогноз зависит как от стадии, так и от особенностей, течения самого заболевания. На самых первых этапах, если рак обнаружен вовремя, процент излечения может достигать 97-99% случаев. Ко второй стадии этот показатель снижается примерно на 7%, а начиная с третьей стадии риски сильно возрастают – излечение происходит в 60-70% случаев.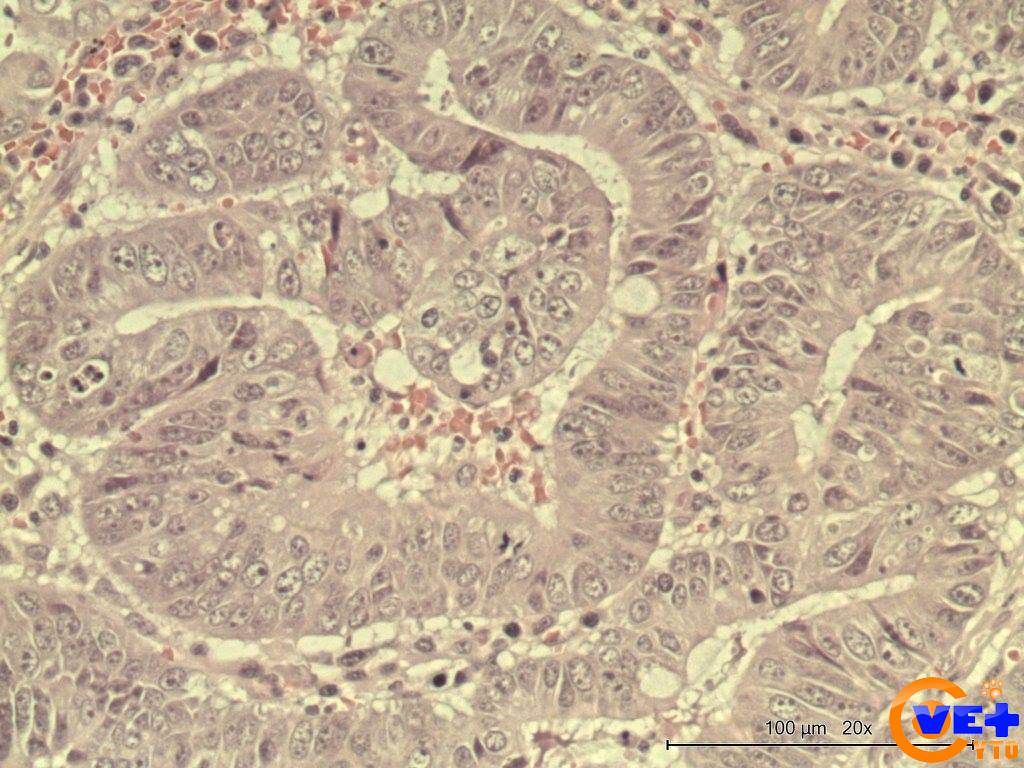
Однако важно помнить: какой бы ни была стадия, всегда есть индивидуальный фактор. При наличии диагноза аденокарцинома кишечника, прогноз может быть не самым благоприятным, а исход более удачным. Очень многое в лечении зависит и от настроя самого пациента, от его окружения.
Профилактические мероприятия
Профилактика в данном случае максимально простая: чтобы избежать проблем с кишечником, приводящих к раку, нужно правильно питаться, соблюдать питьевой режим, обязательно двигаться и следить за весом. Если среди родственников кто-то болел раком, проконсультируйтесь у специалистов. При отсутствии такой наследственности не забывайте о скрининговых исследованиях, начиная с 50 лет.
Бережно и внимательно относиться к своему здоровью, а также вести здоровый образ жизни – лучшая профилактика. Это не гарантирует того, что аденокарцинома никогда не разовьется, но риски такой проблемы будут намного меньше.
Как записаться к специалисту в онкоцентр «София»
Записаться на прием к специалистам онкологического центра «София» можно на сайте – пациенту необходимо внести в соответствующие поля свое имя, номер телефона и адрес электронной почты. Администраторы клиники совершат ответный звонок после обработки полученных данных.
Администраторы клиники совершат ответный звонок после обработки полученных данных.
Специалисты информационной службы клиники готовы ответить на любые вопросы и забронировать удобную для пациентов дату визита по телефону +7(495)995-00-34.
Онкологический центр «София» расположен на территории центрального административного округа Москвы по адресу 2-й Тверской-Ямской переулок, дом 10. Удобная локация позволит пациентам быстро добраться до клиники от станций метро «Маяковская», «Новослободская», «Тверская», «Чеховская» и «Белорусская».
Рак прямой кишки
Вам поставили диагноз: рак прямой кишки?
Наверняка Вы задаётесь вопросом: что же теперь делать?
Подобный диагноз всегда делит жизнь на «до» и «после». Все эмоциональные ресурсы пациента и его родных брошены на переживания и страх. Но именно в этот момент необходимо изменить вектор «за что» на вектор «что можно сделать».
Очень часто пациенты чувствуют себя безгранично одинокими вначале пути. Но вы должны понимать — вы не одни. Мы поможем вам справиться с болезнью и будем идти с Вами рука об руку через все этапы вашего лечения.
Но вы должны понимать — вы не одни. Мы поможем вам справиться с болезнью и будем идти с Вами рука об руку через все этапы вашего лечения.
Рак прямой кишки прогрессирует среди онкологических заболеваний. В 2017 году было выявлено 29918 новых случаев данного заболеваний у мужчин и у женщин в Российской Федерации. Смертность от этого заболевания также остаётся очень высокой. В 2017 году от этой локализации умерло 16360 человек.
Предлагаем Вашему вниманию краткий, но очень подробный обзор рака прямой кишки. Его подготовили высоко квалифицированные специалисты Абдоминального отделения МНИОИ имени П.А. Герцена – филиала ФГБУ «НМИЦ радиологии» Минздрава России.
Рак прямой кишки. ЭпидемиологияРак прямой кишки становится одной из наиболее распространенных форм злокачественных новообразований.
Эта тенденция за последние десятилетия все отчетливее проявляет себя во всех экономически развитых странах Европы и Северной Америки.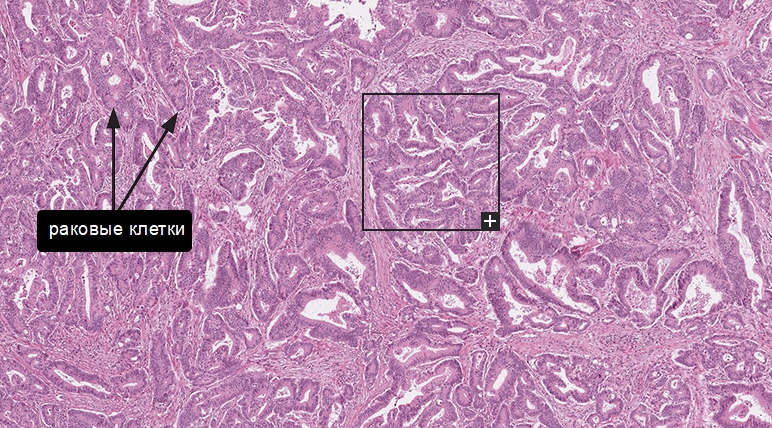
По данным одного из крупнейших исследований по эпидемиологии рака, World Cancer Report, заболеваемость раком прямой кишки стоит на третьем месте среди всех онкологических новообразований.
Анатомия прямой кишки
Прямая кишка (rectum) является дистальным отделом толстой кишки. Ее верхняя граница находится на уровне верхнего края 3-го крестцового позвонка , внизу прямая кишка переходит в анальный канал. Длина прямой кишки колеблется от 12 до 18 см, в месте перехода сигмовидной кишки в прямую ее диаметр составляет 3—4 см, ниже кишка значительно расширяется (ампула прямой кишки). Ампулу прямой кишки делят на верхний, средний и нижний отделы. Форма и ширина просвета ампулы во многом зависят от наполнения кишки. Верхний отдел прямой кишки расположен в брюшной полости, он смещен во фронтальной плоскости и располагается немного левее срединной линии, являясь как бы продолжением сигмовидной ободочной кишки.
1. Возраст старше 50 лет. Риск возникновения рака прямой кишки увеличивается с возрастом. Более 90 % случаев диагностируется у людей после 50 лет, причём он в равной степени касается мужчин и женщин. Риск развития рака прямой кишки удваивается с каждым прожитым десятилетием.
2. Наследственный фактор. Около 5% раков толстой кишки составляет наследственный рак, предрасположенность к которому передаётся по аутосомно-доминантному типу. Так, если риск возникновения рака толстой кишки у лиц, не имеющих предрасполагающих факторов, составляет 1–3%, то при его наличии у родственников первого порядка, риск повышается до 5%.
3. Генетические изменения. Изменения в определенных генах также повышают риск развития рака прямой кишки.
4. Наличие онкологического заболевания в прошлом. В некоторых случаях возможно повторное возникновение рака.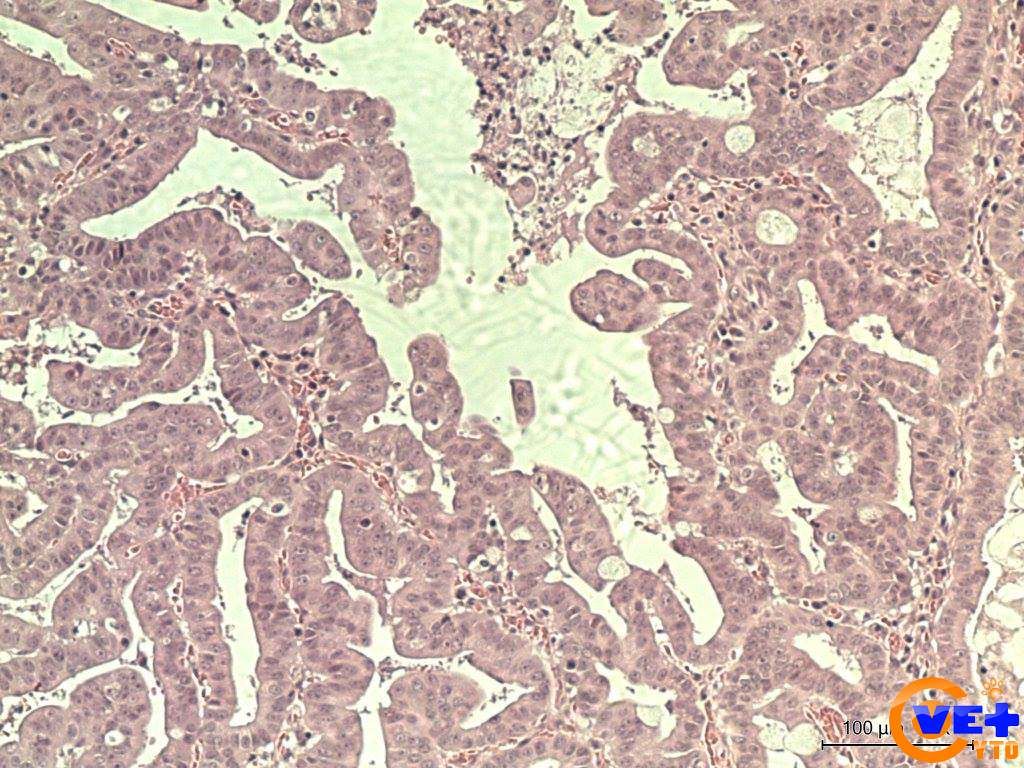 К факторам риска также следует относить злокачественные опухоли других органов. Так, у женщин, имеющих рак молочной железы или репродуктивной системы, риск заболеть раком толстой кишки значительно увеличивается.
К факторам риска также следует относить злокачественные опухоли других органов. Так, у женщин, имеющих рак молочной железы или репродуктивной системы, риск заболеть раком толстой кишки значительно увеличивается.
5. Хронические неспецифические воспалительные заболевания толстой кишки. У больных с хроническими воспалительными заболеваниями толстой кишки, особенно с язвенным колитом, частота возникновения колоректального рака значительно выше, чем в общей популяции.
6. Питание. Исследования показали, что прием пищи с высоким содержанием жиров, недостаток кальция, фолиевой кислоты и клетчатки, ограниченное количество фруктов и овощей увеличивает риск развития колоректального рака.
КлассификацияВ настоящее время рак прямой кишки классифицируют:
- — по стадии опухолевого процесса (TNM, Dukes, Dukes в модификации Aster et Coller)
- -по гистологической структуре опухоли
- — по типу роста опухоли.

Классификация TNM, 8-издание.
| Т | первичная опухоль |
| ТХ | первичный очаг невозможно выявить. |
| Т0 | отсутствие признаков первичной опухоли. |
| Tis | неинвазивный (карцинома in situ, внутриэпителиальный) рак (без прорастания собственной пластинки слизистой оболочки). Сюда относят и элементы опухоли в пределах кишечных желёз при отсутствии поражения мышечного слоя слизистой оболочки и подслизистого слоя. |
| Т1 | опухоль инфильтрирует подслизистый слой. |
| Т2 | прорастание собственной мышечной оболочки. |
| Т3 | опухоль прорастает субсерозный слой или неперитонизированные отделы стенки с выходом в прилежащую ткань (брыжейку ободочной кишки). |
| T4 | опухоль распространяется на соседние органы или структуры и/или прорастает висцеральную брюшину. |
| Т4а | опухоль прорастает висцеральную брюшину |
| Т4b | опухоль непосредственно прорастает другие органы и/или структуры |
| N | регионарные лимфатические узлы |
| NX | состояние регионарных зон оценить невозможно. |
| N0 | регионарных метастазов нет. |
| N1 | метастатическое поражение от 1 до 3 регионарных лимфоузлов; |
| N1a | в одном лимфоузле |
| N1b | в 2-3 лимфоузлах |
| N1c | опухолевые отсевы в субсерозном слое без наличия поражения лимфоузлов* |
| N2 | метастазы определяются в 4 и более регионарных ЛУ. |
| N2a | 4-6 поражённых лимфоузла |
| N2b | 7 и более поражённых лимфоузлов |
| М | отдалённые метастазы |
| Mx | отдалённые метастазы не могут быть подтверждены. |
| М0 | отдалённых метастазов нет. |
| M1a | поражение одного органа |
| M1b | поражение более одного органа или диссеминация по брюшине |
| M1c | Перитонеальные метастазы самостоятельные или с метастазами в другие органы или анатомические участки. |
| Duke`s А | рост опухоли ограничен стенкой кишки. |
| Duke`s В | опухоль распространена на окружающие ткани; метастазы в лимфатических узлах отсутствуют. |
| Duke`s С | опухоль с любой степенью местного распространения при наличии метастазов в регионарных лимфатических узлах. |
При разделении опухолей по гистологическому строению учитывается преобладание тканевой структуры паренхимы, характер клеточных элементов и их способность к секреции.
Ниже представлены четыре наиболее распространённые формы рака прямой кишки.
Аденокарцинома — наиболее часто встречаемая форма рака прямой кишки.
Выделяют три степени ее дифференцировки: высокодифференцированная; умеренно дифференцированная; низкодифференцированная.
Клиническая картина рака прямой кишки находится в прямой зависимости от уровня расположения опухоли, характера ее роста, стадии заболевания. В начальных стадиях симптомокомплекс выражен слабо.
Выделяют несколько симптомокомплексов при раке прямой кишки. Наиболее частым являются патологические выделения из прямой кишки. Кровь темного цвета со сгустками выделяется до кала, во время тенезмов, или вне акта дефекации. Кроме крови при раке прямой кишки из заднего прохода может выделяться слизь. При распространенных формах и вовлечении в опухолевый процесс соседних органов и тканей возможно выделение гноя с калом.
Другим частым симптомокомплексом является нарушение функции толстой кишки. Характерным являются ложные позывы к дефекации – тенезмы. При тенезмах вместо кала выделяется кровь, слизь. При обтурации опухолью просвета кишки развивается запор. При этом изменяется вид кала – он становится лентовидный или «овечий». При вовлечении в процесс сфинктеров прямой кишки может развиться недержание.
Развитие болевого синдрома является характерным симптомом лишь при вовлечении в опухолевый процесс анального канала. Выше аноректальной линии болевых рецепторов в слизистой оболочке прямой кишки нет. Поэтому при ампулярном раке боль появляется в поздних стадиях, при прорастании опухолью соседних органов.
К неспецифическим клиническим проявлениям относится нарушение общего состояния пациента. Снижение массы тела, изменение цвета кожных покровов (бледный, землистый, иногда чуть желтушный) связано с хронической опухолевой интоксикацией. Анемия развивается из-за длительной кровопотери. Однако эти симптомы развиваются в поздних стадиях опухолевого процесса. Возникновение регионарных и отдаленных метастазов, как правило, изменение клинической картины не сопровождаются и специальной симптоматики не имеют.
Одним из основных методов обследования пациентов раком прямой кишки является пальцевое исследование прямой кишки и/или бидигитальное исследование через прямую кишку и влагалище (у женщин). При исследовании оценивается высота расположения нижнего полюса опухоли над уровнем аноректальной линии, протяженность и форму роста опухоли, состояние регионарных лимфатических узлов. При локализации нижнего полюса опухоли в верхне-среднеампулярных отделах прямой кишки необходимо выполнение ректороманоскопии. При этом удается осмотреть все отделы прямой кишки (до 25 см). Во время исследования проводится визуализация патологического процесса и объективизации данных пальцевого исследования. В ходе исследования, с целью определения гистологического строения первичной опухоли, производится забор материала для цитологического и/или гистологического исследования.
Колоноскопия выполняется с целью выявления патологических изменений толстой и прямой кишки проксимальнее опухоли.
Рентгенологическое исследование толстой и прямой кишок проводится методом трехэтапной ирригоскопии в прямой и боковой проекциях (полутугое-тугое наполнение, двойное контрастирование после опорожнения кишки, двойное контрастирование с нагнетанием воздуха). При исследовании оценивается протяженность опухолевого процесса и наличие сопутствующих заболеваний толстой кишки на участках, расположенных проксимальнее опухоли (синхронный рак, дивертикулез и др.).
Ультрасонография органов брюшной полости и малого таза позволяет оценить глубину инвазии первичной опухоли, вовлеченность в процесс соседних органов и тканей, наличие увеличенных регионарных лимфатических узлов, наличие отдаленных метастазов.
Рентгенологическое исследование органов грудной клетки в прямой и боковой проекции осуществлялось в условиях рентгенологического отделения на стандартном рентгенологическом оборудовании с целью выявления патологических изменений в легких и органах средостения.
КТ органов брюшной полости используют для диагностики наличия отдаленных метастазов.
МРТ органов малого таза следует выполнить для оценки вовлеченности смежных органов в опухолевый процесс. Также методика позволяет оценить латеральный клиренс распространения опухоли и поражение параректальных лимфатических узлов.
Определение уровня онкомаркёров. Наиболее часто используемые в практике при раке прямой кишки — раковоэмбриональный антиген (РЭА) и СА19-9. Маркеры неспецифичны и их концентрация не всегда коррелирует с распространённостью процесса и степенью дифференцировки опухоли, хотя чаще повышается при распространённом раке, особенно при метастазах в печени.
Хирургический метод
Единственным радикальным методом лечения рака прямой кишки является хирургический. При локализации опухоли в нижнеампулярном отделе прямой кишки в стадии сT3-4 с поражением регионарных лимфатических узлов перед оперативным вмешательством, при отсутствии противопоказаний, возможно проведение предоперационной лучевой/химиолучевой терапии.
Выбор объема операции зависит от:
— Локализация опухоли
— степени распространенности опухолевого процесса
— общее состояние больного.
Для радикального удаления опухоли прямой кишки при ее резекции необходимо отступать в проксимальном направлении от верхнего края новообразования на 12-15см, в дистальном до 2- 5см.
Лучевая / химиолучевая терапия
Основными задачами применения лучевой / химиолучевой терапия на дооперационном этапе при раке прямой кишки являются уменьшение распространенности опухолевого процесса и улучшение местного контроля.
При локализации опухоли в нижнеампулярном отделе прямой кишки, прорастанием всех слоев кишечной стенки и выходом в мезоректальную клетчатку, при наличии поражения регионарных лимфатических узлов, при отсутствии противопоказаний, всем пациентам на дооперационном этапе проводится предоперационная лучевая терапия.
Послеоперационное облучение призвано снизить частоту возникновения локальных рецидивов, особенно у пациентов с R1-R2 резекцией.
Лекарственная терапия
Цель адъювантной терапии после радикальной операции является уничтожение отдаленных микрометастазов, что приводит к увеличению общей и безрецидивной выживаемости. Вопрос о её назначении следует решать с учётом исходной стадии заболевания. Показанием для проведения адьювантной химиотерапии больным раком прямой кишки служит III стадии (Dukes C) опухолевого процесса.
Минимальный объем адъювантной химиотерапии включает в себя назначение фторпиримидинов, которые можно применять в различных вариантах: струйном (режим клиники Mayo, Roswell Park), инфузионном (режимы DeGramont, AIO) или пероральном (капецитабин).
Оптимальный объем адъювантной химиотерапии включает в себя комбинацию оксалиплатина с фторпиримидинами. Наиболее оптимальными являются режимы FOLFOX или XELOX.
Основной целью диспансерного наблюдение за пациентами, перенесших радикальное лечение по поводу рака прямой кишки, является ранняя диагностика рецидива и метастазов опухоли. Все больные, перенесшие оперативное вмешательство по поводу рака прямой кишки, должны находится под строгим динамическим контролем.
КОМПЛЕКСНОЕ ЛЕЧЕНИЕ РАКА ПРЯМОЙ КИШКИ
Комплексного лечения больных раком прямой кишки включает предоперационную лучевую терапию, хирургическое вмешательство и адъювантную химиотерапию. Использование подобного подхода позволяет снизить частоту местных рецидивов, увеличить 5-летнюю выживаемость, улучшить качество жизни больных раком прямой кишки. Комплексное лечение с предоперационной лучевой (химиолучевой) терапией и адъювантной полихимиотерапией показано при наличии прорастания опухоли за пределы стенки кишки либо при метастатическом поражении лимфатических узлов.
После завершения предоперационной лучевой терапии выполняют хирургический этап лечения. После завершения данного этапа и полной реабилитации пациента через 3-4 недели проводят адъювантную химиотерапию. Проведение адъювантной химиотерапии показано пациентам при III стадии рака прямой кишки, а также ее можно рассматривать у отдельных больных при II стадии и наличии высокого риска рецидива заболевания.
ФГБУ «НМИЦ радиологии Минздрава России обладает всем спектром методик проведения комплексного лечения у больных раком прямой кишки, что позволяет достигнуть таких же результатов лечения пациентов, как в ведущих мировых клиниках.
НЕРВОСБЕРЕГАЮЩИЕ ОПЕРАЦИИ
Наряду с усовершенствованием методики и техники операций, обеспечивающих радикальность оперативного вмешательства, в последнее время все большее внимание уделяется разработке комплекса мер, направленных на профилактику ранних и отсроченных осложнений, в частности, проблеме послеоперационной мочеполовой дисфункции у оперированных больных. По данным разных авторов частота нарушения функции мочевого пузыря в послеоперационном периоде может достигать 40% и более. Основными признаками нарушения уродинамики являются: увеличение емкости мочевого пузыря, увеличение остаточного объема мочи, ослабление чувства наполнения пузыря, снижение внутрипузырного давления и другие. Все это зачастую приводит к необходимости больным производить самокатетеризацию мочевого пузыря или постановке постоянного катетера.
Указанные осложнения снижают качество жизни, а также социальную, психо-эмоциональную и семейную реабилитацию у оперированных больных. Одной из причин развития подобного рода осложнений является травма нервных стволов, отвечающих за иннервацию мочевого пузыря.
В ФГБУ «НМИЦ радиологии Минздрава России используется техника нервосберегающих операций при раке нижне — и среднеампулярного отделов прямой кишки, которая включает в себя выполнение стандартного хирургического вмешательства с использованием приемов, направленных на максимально возможное сохранение элементов вегетативной нервной системы таза.
СФИНКТЕРОСОХРАНЯЮЩИЕ ОПЕРАЦИИ
Стремление любого онкопроктолога при вмешательствах на прямой кишке направлено с одной стороны на попытку улучшения онкологических результатов лечения, а с другой – выполнение органосохраняющих операций, что позволило бы улучшить качество жизни пациентов. В связи с этим, на протяжении долгого времени, не ослабевает интерес к определению оптимальной дистальной линии резекции, разработке подходов, обеспечивающих сохранение интактных от опухолевого процесса тканей, и вместе с тем расширению объема оперативного вмешательства с целью максимально возможной санации тканей с высоким риском опухолевого поражения.
До настоящего времени, во многих медицинских учреждениях, единственным радикальным оперативным вмешательством при раке средне- и нижнеампулярного отдела считалось выполнение брюшно-промежностной экстирпации прямой кишки с формированием противоестественного заднего прохода на передней брюшной стенки. Однако, многочисленные исследования, проведенные как в России, так и за рубежом, показали, что при определенных показаниях, возможно сохранение сфинктерного аппарата прямой кишки, что позволяет в последующем сохранить естественный пассаж по кишечнику у оперированных пациентов.
ФГБУ «НМИЦ радиологии Минздрава России в абдоминальной онкологии активно применяются современные методики оперативных вмешательств, направленные на сохранение «жома» прямой кишки, что позволяет улучшить качество жизни и психо-социальную адаптацию оперированных пациентов.
Филиалы и отделения Центра, в которых лечат рак прямой кишкиФГБУ «НМИЦ радиологии» Минздрава России обладает всеми необходимыми технологиями лучевого, химиотерапевтического и хирургического лечения, включая расширенные и комбинированные операции. Все это позволяет выполнить необходимые этапы лечения в рамках одного Центра, что исключительно удобно для пациентов. Однако надо помнить, что тактику лечения определяет консилиум врачей.
Рак прямой кишки можно лечить:
В Абдоминальном отделении МНИОИ имени П.А. Герцена – филиала ФГБУ «НМИЦ радиологии» Минздрава России
Заведующий отделения – д.м.н. Дмитрий Владимирович Сидоров.
Контакты: (495) 150 11 22
В Отделении лучевого и хирургического лечения заболеваний абдоминальной области МРНЦ имени А.Ф. Цыба — филиала ФГБУ «НМИЦ радиологии» Минздрава России
Заведующий отделением — к.м.н. Леонид Олегович Петров
Контакты: (484) 399-30-08
Колоректальный рак. Рак толстой кишки
Факторы риска развития колоректального рака
Основным фактором риска развития рака толстой кишки у формально здорового человека является возраст.
Так, заболеваемость РТК у пациентов в возрасте 40 лет и меньше составляет 8 на 100 000 населения, а у людей 60 лет и старше — 150 на 100 000 населения, причем это относится и к мужчинам и к женщинам.
95 % заболевших колоректальным раком в Великобритании — пациенты старше 50 лет.
Lynch H.T. et. аl. подсчитали, что риск развития колоректального рака:
- у формально здорового человека составляет 1-3 %;
- если родственник I порядка родства болел РТК, то риск повышается до 5 %;
- среди больных язвенным колитом риск развития колоректального рака составляет 15-30 %;
- среди пациентов с болезнью Крона — 15 %;
- с неполипозным наследственным колоректальным раком — 15-20 %;
- с наследственным семейным полипозом — 30-100 %
К факторам риска развития колоректального рака относятся полипы толстой кишки, которые сами по себе почти никогда не представляют угрозы для жизни. Однако, чрезвычайно важное клиническое и социальное значение определяется возможностью их малигнизации. По данным многих исследователей именно из полипов, в большинстве случаев развивается рак ТК. Исследования, проведенные в разных клиниках, свидетельствуют, что с увеличением размеров полипов возрастает пролиферативная активность в них, вплоть до злокачественной трансформации.
В аденоматозных полипах размером менее 10 мм фокусы аденокарциномы обнаруживаются редко, в 0,5-1% случаев, с увеличением размера полипа до 20 мм возрастает и риск малигнизации до 5-10 %.
Большие полипы малигнизируются в 20-30 % случаев. В результате проведенных нами исследований, было определено, что частота малигнизации ворсинчатых опухолей прямой кишки четко зависит от площади ее основания.
Если площадь основания опухоли менее 16 см2, то риск озлокачествления ее составляет 18,2 %, если же площадь основания более 16 см2, то риск малигнизации составляет 56.3 % (И.М.Русейкин, 2002). Множественные полипы более опасны, так как каждый из них имеет шанс малигнизироваться.
Хронические воспалительные заболевания толстой кишки, особенно длительно существующий неспецифический язвенный колит, представляют реальную угрозу развития РТК. У больных с неспецифическим язвенным колитом, длительность заболевания которого более 20 лет, риск развития рака достигает 50 %. У пациентов с болезнью Крона, также существует риск развития колоректального рака, который достигает 15-20 %, в зависимости от длительности заболевания.
Больные, которые были оперированы по поводу колоректального рака, тоже составляют группу риска развития рака в оставшихся отделах толстой кишки, так как злокачественные новообразования этого органа часто развиваются метахронно (последовательно). У 50 % больных вновь могут образоваться полипы, которые в 5 % случаев малигнизируются.
Безусловно, к группе риска относятся пациенты с диффузным семейным полипозом толстой кишки. При этом заболевании, как известно, появляются тысячи полипов во всех отделах толстой кишки, часть из которых малигнизируется в 100 % случаев. За развитие этого заболевания ответственен ген АРС (аденоматозный полипоз кишки), идентифицированный в длинном плече 5-ой хромосомы.
Пациенты с наследственным неполипозным колоректальным раком, как правило, имеют родственников с такой же патологией не менее чем в двух генерациях. При этом заболевании наиболее часто встречаются мутации hMLh2 и hMSh3 генов, затем hMSH6, hPMS1 и hPMS2 генов. У 70 % пациентов с наследственным неполипозным колоректальным раком злокачественное новообразование развивается в возрасте 45-65 лет. При этом заболевании могут образоваться так же неопластические процессы в других органах: мозге, (синдром Тюрко), матке, яичниках, желудке, почках, щитовидной железе и др. (синдром Гарднера). У 60 % таких пациентов раковая опухоль развивается в проксимальных отделах толстой кишки.
Диета и её влияние на развитие колоректального рака
В связи с тем, что толстая кишка является составляющей единой системы пищеварительного тракта, то роль этиологического фактора питания на развитие неопластических процессов в этом органе велика. О влиянии диеты на развитие колоректального рака можно судить по тем фактам, что мигранты, переехавшие из регионов с исходно низкой заболеваемостью раком толстой кишки в страны Северной Америки и Европы, употребляя пищу местного населения, заболевают колоректальным раком так же часто, как жители этих стран. Следует отметить, что у вегетарианцев весьма низкий уровень заболеваемости колоректальным раком. В современной литературе, в связи с этим обсуждаются в основном три гипотезы влияния факторов питания на развитие колоректального рака:
- Повышенное употребление животных белков
- Повышенное употребление животных жиров
- Повышенное употребление рафинированных углеводов
Многие исследователи придают важное значение в развитии колоректального рака употреблению в пищу большого количества животных белков. В конце прошлого века Gregor et. al. проанализировали сведения из 28 стран и определили, что там, где на душу населения употребляли большое количество мяса, возрастала заболеваемость КРР и, повышался уровень смертности от рака толстой кишки. Это связывали с распадом животных белков и внутрикишечным синтезом канцерогенных и коканцерогенных веществ, таких как метаболиты триптофана, нитрозамины и гетероциклические амины, содержащиеся в жареном мясе. Однако, более поздние исследования показали, что само употребление протеинов достоверно не способствует развитию колоректального рака, тогда как, процесс приготовления мяса (или плохо перевариваемая пища) может генерировать образование гетероциклических аминов, обладающих выраженной канцерогенной активностью.
Во многих статьях отмечается, что увеличение доли насыщенных жирных кислот способствует развитию колоректального рака. Так, изучение состава кала у населения разных стран показало, что у американцев, не соблюдающих диету, в среднем, в кале содержится около 800 мг стеролов, а у вегетарианцев — около 300 мг. Содержание желчных кислот (потенциальных канцерогенов) в кале американцев в 2.5 — 5 раз выше, чем у людей, не употребляющих в пищу животные жиры. Заболеваемость колоректальным раком у вегетарианцев значительно ниже. Высказывается предположение, что на развитие рака толстой кишки оказывает влияние изменение секреции желчи, метаболизм желчных кислот и состав микрофлоры толстой кишки. Процессы выделения и превращения желчных кислот во вторичные желчные кислоты зависят от количества клетчатки в пище, синтеза витаминов, уровня эстрогенов крови, от концентрации и соотношения микроорганизмов в толстой кишке. В современных статьях, посвященных этой проблеме, обсуждается вопрос о влиянии холецистэктомии на развитие колоректального рака, в связи с повышением уровня желчных кислот в кале. Мнения высказываются различные. Однако, проведенные специальные исследования не определили достоверную связь развития рака толстой кишки с удалением желчного пузыря.
Известно, что на образование канцерогенных соединений значительное влияние оказывает микрофлора толстой кишки и соотношение анаэробных и аэробных бактерий в ней. В странах с низкой заболеваемостью колоректальным раком такое соотношение микроорганизмов в кале составляет 0.5-1.5, а в регионах с высокой частотой развития рака толстой кишки 2.1-2.7 Лидирующее значение в этом отводится анаэробу clostridium paraputrificum, который способен разрушать желчные кислоты с образованием канцерогенных или коканцерогенных соединений.
На развитие колоректального рака оказывает влияние дефицит витаминов, особенно А и С, недостаток в пище такого элемента, как селениум и влияние химически вредны веществ, таких как асбест, афлотоксин и др. Рак ободочной кишки ассоциируется с многолетним курением, а развитие рака прямой кишки у мужчин связывают с злоупотреблением пива и другого алкоголя.
Некоторым протективным действием обладает кофе, за счет снижения секреции желчи, а так же употребление овощей, фруктов и морепродуктов.
Обобщая влияние факторов питания на развитие колоректального рака, можно представить следующую схему развития неопластических процессов в толстой кишке: повышенное потребление животных жиров, белков и рафинированных углеводов при малом количестве растительной клетчатки, создают условия для поступления в кишку химуса содержащего высокие концентрации желчных и жирных кислот. Это приводит к нарушению микробного пейзажа слизистой и изменению состава ферментов микробного происхождения, что способствует разрушению стероидов, желчных кислот с образованием канцерогенных или коканцерогенных соединений. Замедление пассажа по кишке создаёт лучшие условия для более длительного контакта канцерогенов со слизистой оболочкой толстой кишки.
Скрининг рака толстой кишки
Раннее выявление рака толстой кишки среди населения имеет 2 направления:
А. Обнаружение РТК у формально здоровых людей
Б. Обнаружение РТК в группах высокого риска.
Возраст — основной фактор риска развития колоректального рака у формально здоровых людей. Заболеваемость раком толстой кишки у пациентов разного возраста. 40 лет — 8 на 100 000 населения; 60 лет — 150 на 100 000 населения. Лица старше 50 лет составляют 37 % населения Великобритании. Именно на эту группу приходится 95 % от общего числа заболевших раком толстой кишки.
Риск развития колоректального рака
Лица без предрасполагающих обстоятельств -1 — 3 %
Рак толстой кишки у родственника 1 порядка — 5 %
Пациенты с НЯК и болезнью Крона — 15 — 30 %
Пациенты, перенесшие ранее операции по поводу рака толстой кишки, молочной железы,
яичника — 8 — 10 %
Пациенты с одиночными и групповыми полипами — 20 %
Пациенты с семейным полипозом — 30 — 100 %
Тесты на скрытую кровь в кале, проводимые в качестве скрининговых программ у здорового населения старше 40 лет, привели к противоречивым результатам из-за большого числа ложноположительных и ложноотрицательных ответов, а также из-за влияния диеты на результаты. Кроме того, сбор кала у формально здорового населения эстетически многими не воспринимается. Лишь 38% людей откликается на приглашение выполнить тест. После скрининга 2-6% формально здоровых людей имеют положительную реакцию на скрытую кровь в кале и в этой группе в 5-10% случаев выявляется РТК, железистые аденомы в 20-40% случаев. Вместе с тем многие исследователи считают, что сигмоскопия, проведенная у лиц с положительной реакцией на скрытую кровь, + пальцевое исследование прямой кишки, приводят к снижению смертности от РТК на 30%, за счет диагностики болезни на ранней стадии ее развития.
Пальцевое исследование прямой кишки позволяет выявить до 10% рака толстой кишки;
Ректороманоскопия — до 40% РТК;
Сигмоскопия проведенная до 60 см от анального края, позволяет выявить до 70% всех видов РТК.
На основании сказанного Американское Раковое Общество рекомендует лицам старше 50 лет пройти тестирование на скрытую кровь и раз в год подвергаться сигмоскопии.
Маркеры рака толстой кишки
Наиболее известный маркер рака толстой кишки — карциноэмбриональный антиген (СЕА) был открыт в 1965 году Gold end Freedman.
Опухоли толстой кишки получают потенциал метастазирования после прорастания подслизистого слоя кишки, богатого лимфатическими сосудами. Если опухоль не прорастает все слои кишки, метастазы в лимфоузлы обнаруживаются лишь в 10%, если пенетрируется серозная оболочка — в 60%. Если в лимфоузлах обнаруживается реактивная гиперплазия — это хороший прогностический признак. Рак толстой кишки после метастазирования в печень, может широко диссеминироваться по органам и тканям — легкие, кости и т.д. Метастазы в печени обнаруживаются на секции в 40% случаев.
Английский патолог Dukes еще в тридцатых годах ХХ века описал очередность этапов диссеминации рака прямой кишки. После возникновения опухоли в слизистой ее инвазия осуществляется в поперечном направлении (не по длиннику), т.е. опухоль растет преимущественно в сторону просвета кишки. Эта же закономерность характерна и для ободочной кишки.
Лимфатическая диссеминация колоректального рака может быть и при опухолях не прорастающих все слои толстой кишки. При хирургических манипуляциях по поводу рака толстой кишки возможна имплантация раковых клеток на новое место.
Классификация колоректального рака
Главным прогностическим фактором является стадия рака толстой кишки в момент первичной диагностики. От четкости и единого отношения к классификации рака ободочной кишки (РОК) во многом зависят показания к назначению адъювантного метода лечения и возможность сравнивать результаты предпринимавшихся оперативных вмешательств и способов комбинированного лечения. В настоящее время приняты и широко используются на практике несколько классификаций рака ободочной кишки.
В России, как и во всем мире, принято стадировать раковые опухоли по Международной TNM классификации злокачественных опухолей, разработанной Международным Противораковым Союзом. В 2002 г. вышло в свет 6 издание этой классификации. Предложено различать 5 стадий (O, I, II, III и IV).
Система TNM принята для описания анатомического распространения поражения всех отделов и изгибов ободочной кишки, от слепой, включая аппендикс, до сигмовидной включительно (ректосигмоидный выделяют отдельно). Во всех случаях необходимо иметь гистологическое подтверждение диагноза. До начала лечения используется клиническая классификация, основанная на данных различных исследований (рентгенологических, эндоскопических, ультразвуковых, биопсионных и др.). Эта классификация позволяет определиться в выборе того или иного метода лечения. После исследования операционного материала описывается патологическая классификация с оценкой первичной опухоли (рТ), состояния регионарных лимфоузлов (рN) и отдаленных метастазов (рМ). Эта классификация позволяет определиться с необходимостью выбора адъювантного метода лечения, высказаться о прогнозе результатов лечения.
Т — первичная опухоль
- Тх — Недостаточно данных для оценки первичной опухоли
- Т0 — Первичная опухоль не определяется
- Тis — Интраэпителиальная или с инвазией слизистой оболочки
- Т1 — Опухоль прорастает слизистую и подслизистую оболочки
- Т2 — Опухоль прорастает мышечный слой стенки кишки
- Т3 — Опухоль прорастает субсерозу или неперитонизированные участки ободочной кишки
- Т4 — Опухоль прорастает висцеральную брюшину, или непосредственно распространяется на соседние органы и структуры.
N — Регионарные лимфатические узлы
- NХ — Недостаточно данных для оценки регионарных лимфатических узлов
- N0 — Нет признаков метастатического поражения лимфатических узлов
- N1 — Метастазы в 1 — 3 регионарных лимфатических узлах
- N2 — Метастазы в 4 и более регионарных лимфатических узлах
При гистологическом анализе должны быть исследованы не менее 12 регионарных лимфатических узлов. Метастазы в лимфоузлах расположенных по ходу аорты и в зоне наружных подвздошных сосудов расценивают как М1.
М — Отдаленные метастазы
- МХ — Недостаточно данных для определения отдаленных метастазов
- М0 — Нет признаков отдаленных метастазов
- М1 — Имеются отдаленные метастазы
G — Гистопатологическая дифференцировка
- GХ — Степень дифференцировки не может быть установлена
- G1 — Высокая степень дифференцировки
- G2 — Средняя степень дифференцировки
- G3 — Низкая степень дифференцировки
- G4 — Недифференцированные опухоли
R — резидуальные опухоли
- RХ — Недостаточно данных для определения резидуальной опухоли
- R0 — Резидуальная опухоль отсутствует
- R1 — Резидуальная опухоль определяется микроскопически
- R2 — Резидуальная опухоль определяется макроскопически
Группировка по стадиям
- Стадия 0 — Тis, N0 M0
- Стадия I — Т1, Т2 N0 M0
- Стадия IIА — Т3 N0 М0
- Стадия IIВ — Т4 N0 M0
- Стадия IIIА — Т1, Т2, N1 М0
- Стадия IIIВ — Т3, Т4, N1 М0
- Стадия IIIC — Любая Т, N2 M0
- Стадия IV — Любая Т, Любая N, М1
В особых случаях используются дополнительные дескрипторы m, y, r, a. Символ mуказывает на первичную множественность опухоли, r — о рецидиве опухоли после полной ремиссии. Префикс a свидетельствует, что стадия заболевания установлена после аутопсии, а символ y используется, когда классификация определяется во время и после применения различных методов лечения.
Морфологический тип опухоли
Наиболее часто встречается аденокарцинома (более 80 % всех раковых опухолей толстой кишки), а так же слизистый рак, коллоидный, перстневидноклеточный, аденосквамозный, недифференцированный.
Приводим так же Международную морфологическую классификацию рака ободочной кишки:
- Аденокарцинома:
- высокодифференцированная;
- умеренно дифференцированная;
- низкодифференцированная.
- Слизистая аденокарцинома:
- мукоидный;
- слизистый;
- коллоидный рак.
- Перстневидно-клеточный рак — мукоцеллюлярный.
- Недифференцированный рак (carcinoma simplex, медуллярный, трабекулярный).
- Неклассифицируемый рак.
В России используется классификация рака толстой кишки, утвержденная ещё Минздравом СССР в 1980 году, которая подразделяет опухоль в зависимости от распространенности по кишке на IV стадии.
- I стадия — опухоль занимает менее половины окружности кишки локализуется в слизистой оболочке и подслизистом слое кишки, без регионарных метастазов.
- IIа стадия — опухоль занимает не более полуокружности кишки, не выходит за пределы кишечной стенки, без регионарных метастазов в лимфатических узлах.
- IIб стадия — опухоль занимает не более полуокружности кишки, прорастает всю ее стенку, но не выходит за пределы кишки, с наличием метастазов в ближайших регионарных лимфатических узлах.
- IIIa стадия — опухоль занимает более полуокружности кишки, прорастает всю ее стенку, поражения лимфатических узлов нет.
- IIIб стадия — опухоль любого размера при наличии множественных метастазов в регионарных лимфатических узлах.
- IVа стадия — обширная опухоль, прорастающая в соседние анатомические структуры и органы с множественными регионарными метастазами,
- IVб стадия — опухоль любого размера с наличием отдаленных метастазов.
Широкое распространение во многих странах мира получила классификация колоректального рака по С.Е.Dukes.
В 1929 г. английский патолог С.Е.Dukes предложил выделять три стадии при КРР в зависимости от степени распространенности онкологического процесса в кишке:
- А — инвазия опухоли ограничивается подслизистым слоем,
- В — распространение опухолевой инвазии на мышечный слой
- С — прорастание всей стенки кишки и распространение онкологического процесса в околокишечную клетчатку (С1 — без метастазов в лимфоузлы и С2 — с метастазами в лимфоузлы).
Эта классификация оказалась простой и практически очень удобной.
В 1932 г. С.Е.Dukes сообщил о втором варианте своей классификации, при которой:
- стадия А предусматривает поражение всей толщи стенки, но без поражения лимфоузлов;
- при стадии В — прорастание всей стенки и периректальных тканей, но без поражения лимфоузлов;
- стадия С — метастазы в лимфоузлах при любом размере опухоли.
В 1947 г. С.Е.Dukes ввел IV стадию, при которой обнаруживаются отдаленные метастазы стадия D. Во многих работах настоящего времени приводятся данные в соответствии с классификацией С.Е.Dukes
Потенциал многопрофильного стационара и возможность участия на операции специалистов различного профиля, позволяет проводить резекции смежных органов и удалять значительные по распространенности рецидивы заболевания в пределах здоровых тканей.
Профессор И.А.Нечай
Аденокарцинома прямой кишки: лечение в лучших клиниках
Восемь из 10 аденокарцином развивается в средней части — ампуле прямой кишки, где всасывается вода и окончательно формируется кал. Кишка 16-18 см одинакова по длине и ширине. На часть перед заднепроходным сфинктером приходится одна шестая длины, переходящую в сигмовидную кишку часть — две шестых, остальное и есть ампула прямой кишки.
Определяет степень злокачественности аденокарциномы зрелость её клеток — дифференцировка. Раковые клетки похожи на клетки органа, но степень их схожести может быть очень разной. Когда злокачественная клетка более похожа на свою прародительницу стволовую клетку, чем на зрелую железистую клетку, то тогда она называется недифференцированной. Чем агрессивнее опухоль, тем меньше в ней клеток похожих на «родные» железистые.
Если клетки рака преимущественно сохраняют железистое строение, то такая аденокарцинома считается высокодифференцированной. В умеренно дифференцированной аденокарциноме половина клеток рака похожи на железистые клетки прямой кишки. От половины до двадцатой части клеток — низкодифференцированная. А уж когда в опухоли менее 5% клеток похожи на родные клетки прямой кишки, то это недифференцированный рак.
Подразделение по стадиям
Стадии аденокарциномы прямой кишки определяют по степени вовлечения в раковый процесс стенки кишки. Если опухолевые клетки поселились только в самых поверхностных слоях слизистой оболочки, то это 0 стадия рака, в подслизистом или мышечном слое — I стадия, при II стадии рак может прорасти через всю кишечную стенку, но лимфатические узлы должны быть чистыми. При III стадии первичная опухоль может быть любой и лимфоузлы поражены раком. Определяющий критерий IV стадии — метастазы в других органах.
Клинические проявления
Аденокарцинома мешает кишке выполнять функцию формировать и выводить каловые массы, поэтому симптомы заболевания -нарушения стула. Это запоры или поносы, выраженность которых нарастает с течением времени — всё хуже и хуже. К примеру, слабило один раз в день, через некоторое время уже трижды на день отмечается жидкий стул, а после и того больше, тогда как без лекарств не бывает кала нормальной консистенции.
Возникают ложные позывы на низ и ощущение неполноценности дефекации, болезненность её. В кале появляется кровь, сначала прожилками, потом она начинает выделяться тёмными почти чёрными сгустками, к ней может примешиваться слизь. Если опухоль растёт близко от анального отверстия, может возникать недержание кала и газов. Боли в прямой кишке появляются при аденокарциноме, прорастающей нервные сплетения. Вовлечение в раковый конгломерат мочевого пузыря вызывает симптомы вялотекущего и устойчивого к лечению цистита. При прорастании в клетчатку влагалища появляются боли при половом акте.
При далеко зашедшем процессе и хронической кровопотере из-за прорастания аденокарциномой сосудов развивается анемия, ухудшается самочувствие, нарастает слабость. А потеря веса присоединяется на поздней стадии аденокарциномы, когда она разбросала по организму метастазы.
Обнаружение и лечение
Аденокарциному прямой кишки обнаруживают при пальцевом исследовании, для получение анализа выполняется её эндоскопическое исследование, обязательна колоноскопия для исключения второй синхронной опухоли в другом отделе толстой кишки. Перед началом лечения МРТ малого таза определит истинные размеры аденокарциномы.
Радикальное лечение аденокарциномы прямой кишки — только хирургическое, при необходимости дополняется лучевой терапией и химиотерапией. При малом раке прямой кишки хорошие результаты достигаются эндоскопической операцией, максимально щадящей и сохраняющей орган. При распространённой аденокарциноме проводят химиолучевое лечение. Применяют фотодинамическую терапию, она уменьшает воспаление вокруг опухоли и улучшает проникновение в неё химиопрепаратов.
Прямая кишка небольших размеров и совсем не стерильная, операции в интимной зоне с частичным или полным выключением органа на время или навсегда тягостны для пациентов. Но ещё невыносимей больному отказ от операции из-за обширного распространения аденокарциномы прямой кишки, в этом случае паллиативные вмешательства могут улучшить качество жизни пациента.
Мы готовы организовать диагностику и лечение аденокарциномы кишки в лучших клиниках Москвы и зарубежья. Для подбора клиники позвоните нам по телефону: +7 (495) 023-10-24.
умеренно дифференцированная и низкодифференцированная аденокарцинома толстой кишки
Аденокарцинома толстой кишки — это злокачественная опухоль, развивающаяся из железистого эпителия. В структуре всех онкологических новообразований толстого кишечника она занимает первое место, на ее долю приходится до 95% раков данной локализации.
Причины развития аденокарциномы толстой кишки
Причины развития аденокарциномы до конца не ясны, но есть некоторые данные, позволяющие определить факторы риска, увеличивающие вероятность развития данной патологии:
- Характер питания — избыточное потребление животных жиров, высокобелковых продуктов и недостаток в рационе клетчатки, а также переедание, злоупотребление алкоголем.
- Наличие полипов толстого кишечника. В большинстве случаев аденокарциномы развиваются из уже имеющихся полипов, причем чем дольше он существует и больше его размер, тем выше риски малигнизации. Во многих странах людям старше определённого возраста (50 лет) рекомендуют проходить периодическую колоноскопию с одновременным удалением полипов. На сегодняшний день это наиболее эффективное средство профилактики.
- Генетическая предрасположенность. В большинстве случаев аденокарцинома толстой кишки является спорадическим заболеванием, т. е. не связана с наследственными факторами, но есть два случая, где генетика имеет ключевую роль. Это семейный аденоматозный полипоз и наследственный неполипозный рак толстого кишечника (он же синдром Линча).
- Наличие неспецифического язвенного колита и болезни Крона.
- Наличие в анамнезе рака женских половых органов.
- Иммунодефицитные состояния.
Классификация аденокарциномы толстой кишки
В зависимости от гистологического типа, выделяют следующие виды аденокарцином:
- Тубулярная. Состоит из специфических трубчатых структур. Опухоль, как правило, имеет малые размеры и нечеткие границы.
- Муцинозная. Характеризуется секрецией большого количества слизи. Во время гистологического исследования видно, что слизь занимает до половины объема злокачественных клеток. Опухоль относится к низкодифференцированным формам аденокарциномы, характеризуется быстрым ростом и ранним метастазированием.
- Перстневидноклеточная. Также относится к высокой степени злокачественности, на момент постановки диагноза, как правило, обнаруживаются отдаленные метастазы. Чаще диагностируется у молодых людей.
В зависимости от степени зрелости опухолевых клеток, аденокарциномы делят на следующие типы:
- Высокодифференцированная аденокарцинома. Характеризуется относительно «нормальным» строением клеток, в которых отмечается увеличение размеров ядер. Клеточные функции сохранены. Опухоль характеризуется относительно благоприятным прогнозом, поскольку растет медленно. Но в то же время ее тяжело диагностировать на ранних стадиях, поскольку внешне клетки сходны с нормальной тканью.
- Умереннодифференцированная аденокарцинома характеризуется более неблагоприятным прогнозом. Клетки полиморфны, склонны к быстрому делению и, как следствие, быстрому росту опухоли.
- Низкодифференцированная и недифференцированная аденокарцинома наиболее неблагоприятны. Клетки отличаются высоким полиморфизмом, опухоль не имеет четких границ, инфильтрирует (прорастает) кишечную стенку и характеризуется быстрым агрессивным ростом и ранним метастазированием.
В зависимости от распространенности опухолевого процесса выделяют следующие стадии аденокарциномы:
- 1 стадия — раковые клетки обнаруживаются только в слизистой оболочке кишечной стенки.
- 2 стадия — опухоль прорастает все слои стенки кишки.
- 3 стадия — рак дает метастазы в регионарные лимфатические узлы.
- 4 стадия — обнаруживаются отдаленные метастазы, которые поражают внутренние органы.
Симптомы аденокарицномы толстой кишки
Аденокарцинома толстой кишки долгое время никак себя не проявляет. Первые симптомы могут появиться, когда опухоль достигает больших размеров и затрагивает другие органы. В ряде случаев имеются косвенные признаки наличия злокачественных новообразований:
- Необъяснимое снижение веса.
- Потеря аппетита.
- Упадок сил.
- Анемия, которая развивается на фоне скрытого кровотечения из опухоли.
Симптоматику определяет и место локализации аденокарциномы. Если опухоль расположена в правом отделе ободочной кишки, то, как правило, из первых симптомов наблюдаются явления диспепсии, связанные с нарушением работы соседних органов (желудок, поджелудочная железа, печень и желчный пузырь). Возможны скрытые кровотечения, на фоне которых развивается анемия и слабость. Поскольку в этом месте кишка имеет широкий просвет и жидкое содержимое, обтурация (закупорка просвета) развивается только на последних стадиях и то, не во всех случаях. Если опухоль имеет большие размеры, ее можно прощупать через стенку живота.
Левый отдел ободочной кишки имеет меньший диаметр, а кишечное содержимое более плотную консистенцию, поэтому опухоли данной локализации чаще проявляются явлениями кишечной непроходимости. Застой кишечного содержимого приводит к усилению процессов гниения и брожения, что вызывается вздутие живота и коликообразные боли. На смену запору приходит диарея со зловонным стулом. В ряде случаев кале могут обнаруживаться примеси крови.
Обследование при аденокарциномах толстого кишечника
Золотым стандартом обнаружения аденокарциномы толстой кишки на ранней стадии является тотальная колоноскопия. Специалисты Европейской онкологической клиники рекомендуют ее делать всем людям старше 50 лет раз в десятилетие. Это позволит предотвратить озлокачествление существующих доброкачественных полипов. Данный метод доставляет пациентам определенный дискомфорт, поэтому зачастую выполняется под внутривенным наркозом. Стоимость такого обследования довольно высока, к тому же оно требует специальной подготовки.
Далеко не всегда пациенты готовы к данной процедуре, поэтому есть более простой и доступный вариант, хотя и менее точный — исследование кала на скрытую кровь. Если результат анализа оказывается положительным, пациента направляют на тотальную колоноскопию.
Диагностика аденокарцином толстой кишки
Диагноз аденокарцинома толстой кишки выставляется только на основании гистологического заключения — исследования кусочка опухолевой ткани под микроскопом. Процесс изъятия фрагмента ткани называется биопсия, ее проводят с помощью эндоскопической техники во время проведения колоноскопии. Если диагноз подтверждается, назначается дальнейшее обследование, которое направлено на определение гистологического типа опухоли, ее молекулярно-генетических особенностей. Также проводится комплексное обследование, направленное на установление степени распространенности злокачественного новообразования. С этой целью проводится КТ, МРТ, УЗИ. Все вместе это позволит выбрать оптимальную тактику лечения. Также назначаются анализы на онкомаркеры: РЭА, СА19-9, СА-72-4. Они хоть и не помогают в обнаружении опухоли как таковой, но отслеживание динамики их концентрации позволяет оценить эффективность дальнейшего лечения и вовремя определить рецидив заболевания.
Лечение аденокарциномы толстой кишки
Для лечения аденокарциномы применяют хирургические операции и химиотерапию. При расположении опухоли в прямой кишке возможна лучевая терапия.
Хирургическое лечение
Хирургическое лечение предполагает удаление аденокарциномы в пределах здоровых тканей кишки. В зависимости от объема удаляемого кишечника выделяют следующие виды операции:
- Резекция толстой кишки. Иссекается опухоль в пределах здоровых тканей. Концы сшиваются, образуя анастомоз.
- Гемиколэктомия. Удаляется половина толстого кишечника. Соответственно, выделяют правостороннюю и левостороннюю гемиколэктомию.
- Колэктомия — удаляется вся толстая кишка.
Если опухоль проросла на соседние органы, выполняется комбинированная операция с удалением всех пораженных тканей единым блоком с соблюдением правил абластики. Как правило, это обширные травматичные вмешательства.
Отдаленные одиночные метастазы (в печени, легких, яичниках) также удаляются оперативным путем, единовременно с основной опухолью или отдельной операцией, которая проводится через несколько недель. Этот вопрос решается консилиумом.
В ряде случаев после удаления аденокарциномы не удается наложить анастомоз, тогда вышележащий отдел кишки выводят на брюшную стенку, это называется колостомой. Она может быть временной или постоянной. В первом случае через некоторое время после удаления опухоли проводят реконструктивные вмешательства, восстанавливающие целостность кишечника.
Альтернативой колостоме может стать эндоскопическое стентирование — установка специальной конструкции, поддерживающей просвет кишки в месте поражения опухолью в расправленном состоянии. Его могут выполнять в двух вариантах:
- Предоперационная декомпрессия. Она позволяет подготовить пациента к одномоментной операции без наложения колостомы. Расправление кишки устраняет явления кишечной непроходимости, нормализует водно-электролитный баланс и подготавливает кишечную стенку к наложению анастомоза. Кроме того, стентирование дает время для проведения адьювантной химиотерапии, что позволит уменьшить размер опухоли и провести операцию, не удаляя большой объем кишки.
- Паллиативное лечение — эндоскопическое стентирование может стать альтернативой постоянной колостоме или наложению обходного анастомоза для пациентов, которым по каким-либо причинам невозможно провести хирургическое вмешательство.
Химиотерапия
Химиотерапия при аденокарциномах толстой кишки проводится в двух режимах:
- Неоадъювантный, который назначается на дооперационном этапе. Его целью является уменьшение размеров опухоли, что позволяет легче удалить ее во время хирургического вмешательства. Неоадъювантная терапия в некоторых случаях позволяет перевести опухоль из нерезектабельного состояния в резектабельное и провести операцию, которая изначально была невозможна.
- Адъювантный режим предполагает применение химиопрепаратов в послеоперационном периоде. Его целью является уничтожение оставшихся раковых клеток и предотвращение развития рецидивов заболевания.
Для химиотерапевтического лечения аденокарциномы имеется несколько протоколов, все они включают цитостатики на основе фторпиримидинов.
Также может использоваться и таргетная терапия, которая действует на молекулярные механизмы, обеспечивающие опухолевый рост. Используются препараты, подавляющие действие фактора роста эндотелия сосудов (бевацизумаб, рамуцирумаб) или блокаторы рецептора эпидермального фактора роста (цетуксимаб). Их назначение происходит в соответствии с молекулярно-генетическим тестированием.
Лучевая терапия
Лучевая терапия используется только при лечении аденокарцином прямой кишки, поскольку остальные отделы толстого кишечника обладают высокой подвижностью, что не позволяет произвести разметку поля облучения. Лучевая терапия может использоваться на дооперационном и послеоперационном этапе. В первом случае преследуется цель уменьшения опухолевой массы, а во втором — уничтожение раковых клеток в окружающих тканях.
Иммунотерапия аденокарциномы при наличии микросателлитной нестабильности
Около 15% случаев аденом толстой кишки развивается в результате поломки системы восстановления ошибочно спаренных нуклеотидов — особой системы, которая призвана своевременно распознавать и устранять мутации ДНК. Если она не работает, генетический код не защищен и клетки активно накапливают мутации, которые выявляются в повторяющихся нуклеотидных последовательностях — микросателлитах. Такое состояние называется микросателлитной нестабильностью. Опухоли, имеющие данную особенность, хорошо отвечают на иммунотерапию.
В норме иммунная система должна уничтожать чужеродные клетки и агенты, но раковой опухоли удается избежать этого процесса с помощью особых процессов взаимодействия с иммунитетом. Иммунотерапия блокирует эти процессы и делает опухоль заметной мишенью, что позволяет уничтожить ее. За разработку данного метода лечения в 2018 году была вручена Нобелевская премия.
Одним из иммунологических препаратов является пембролизумаб. Его назначение позволяет значительно улучшить результаты лечения пациентов с метастатической формой аденокарциномы толстой кишки, характеризующейся микросателлитной нестабильностью.
Метастазирование аденокарциномы
Метастазирование аденокарциномы осуществляется несколькими способами:
- Лимфогенный — с током лимфы опухолевые клетки сначала попадают в регионарные лимфатические узлы, а оттуда в более отдаленные группы, например, в надключичные.
- Гематогенный способ метастазирования предполагает рассеивание раковых клеток с током крови. Чаще всего образуются метастазы в печени (по воротной вене) и легких. При низкодифференцированных и недифференцированных аденокарциномах возможно поражение костного мозга.
- Если аденокарцинома толстой кишки проросла окружающие органы, возможно имплантационное метастазирование в результате контакта опухоли с воспринимающей поверхностью. В этом случае возможны множественные метастазы по брюшине (канцероматоз).
Осложнения аденокарциномы толстой кишки
Осложнения аденокарциномы обычно развиваются на распространенных стадиях онкологического процесса, однако бывают случаи, что именно они и являются первыми признаками заболевания:
- Кишечная непроходимость. Она может быть компенсированная, субкомпенсированная и декомпенсированная. Декомпенсированная кишечная непроходимость (полная обтурация) наблюдается в конечных отделах толстой кишки, чаще всего на уровне сигмовидной или прямой кишки, поскольку в этих местах кишечный просвет уже, чем в выше расположенных отделах, а кишечное содержимое имеет плотную структуру. В любом случае кишечная непроходимость требует оперативного лечения. Раньше с этой целью накладывалась колостома — вышележащий отдел кишки выводится на живот. Сейчас же предпочтение отдается резекции участка кишечника вместе с опухолью, с наложением анастомоза. Если это невозможно, тогда уже прибегают к стомированию.
- Перфорация стенки кишки. Очень грозное осложнение, поскольку способствует выходу кишечного содержимого в брюшную полость или забрюшинное пространство с развитием тяжелейших перитонитов.
- Воспалительные процессы в опухоли. Чаще встречается перифокальное воспаление, реже внутриопухолевое. Воспаление связано с наличием в просвете кишки патогенной микрофлоры, которая инфицирует опухоль. Опасность таких процессов заключается в образовании инфильтратов, флегмон, абсцессов, а также перфорации кишечной стенки и развитием перитонита.
- Кровотечение. Хроническая кровопотеря приводит к развитию железодефицитной анемии и, как следствие, к снижению гемоглобина, общей слабости, головокружению. Клиническая картина будет определяться местом локализации опухоли. При выраженных кровотечениях опухоли вышележащих отделов наблюдается черный стул. Если кровоточит опухоль терминальных отделов толстого кишечника, в кале обнаруживаются алая кровь или ее сгустки. Многие пациенты принимают их за проявления геморроя.
- Прорастание опухоли в соседние органы, сопровождающееся нарушением их работы. Например, при прорастании опухоли в печень могут развиваться симптомы холецистита. Если аденокарцинома толстой кишки прорастает в полые органы, возникают свищи.
Прогноз
Главным образом, прогноз аденокарциномы зависит от гистологического типа опухоли и стадии заболевания на момент начала лечения. Наиболее благоприятная ситуация при начальных стадиях, когда еще нет регионарных и отдаленных метастазов. Пятилетняя выживаемость таких пациентов составляет 95% при первой стадии и 75% при второй стадии (учитываются все типы опухоли, даже самые злокачественные). Пятилетний рубеж при третьей стадии переживает только половина пациентов, при четвертой — около 5%.
Таким образом, чем скорее начато лечение, тем более благоприятный будет прогноз. Европейская онкологическая клиника проводит лечение аденокарциномы толстой кишки на всех стадиях заболевания, в том числе и в терминальных. Если излечение невозможно, мы направляем свои усилия на улучшение качества жизни пациентов.
прогнозы и стадии, причины возникновения, виды аденокарцином
Аденокарцинома — это злокачественное новообразование, которое развивается из клеток железистого эпителия. Из всех раковых опухолей сигмовидной кишки она занимает лидирующие позиции. На ее долю приходится более 90% всех злокачественных новообразований данной локализации.
Причины возникновения аденокарциномы
Аденокарцинома, как и любая злокачественная опухоль, развивается из-за генетических поломок в клетке, в результате которых они начинают бесконтрольно расти и размножаться. Причин возникновения данных мутаций множество. Среди них стоит отметить воздействие некоторых вирусов, химических веществ и др.
В настоящее время принято говорить о факторах риска, при наличии которых увеличивается вероятность развития рака сигмовидной кишки:
- Наличие аденоматозных полипов. В подавляющем большинстве случаев рак развивается из-за малигнизации (злокачественного перерождения) аденоматозных полипов. Чем больше размер полипа, и чем дольше он существует, тем выше вероятность его злокачественной трансформации.
- Особенности питания. Переедание, повышенное содержание в рационе жиров животного происхождения, недостаток растительной пищи — все эти факторы достоверно повышают риск развития аденокарциномы толстого кишечника. Существует мнение о том, что канцерогеном для кишечника является мясо. Однако научных доказательств на сегодняшний день данная теория пока не имеет. Действительно, у вегетарианцев количество случаев рака сигмовидной кишки существенно ниже, чем у мясоедов. Однако это связывают не с отказом от мяса как такового, а с большим количеством пищевых волокон в их рационе. Они как щетка очищают стенку кишки от действия потенциальных канцерогенов, тем самым уменьшая вероятность злокачественной трансформации эпителия.
- Возраст старше 50 лет.
- Генетическая предрасположенность. Приблизительно 5-7% случаев аденокарциномы сигмовидной кишки развивается на фоне семейных заболеваний. Это семейный аденоматозный полипоз и наследственный неполипозный рак толстой кишки.
- Воспалительные заболевания толстого кишечника: неспецифический язвенный колит, болезнь Крона.
- Иммунодефициты.
Группа риска по развитию аденокарциномы сигмовидной кишки
- Возраст старше 50 лет.
- Люди с избытком в рационе питания мяса, маринадов, копченостей, приверженцы блюд с большим количеством специй.
- Лица, злоупотребляющие алкоголем.
Симптомы рака сигмовидной кишки
Коварство аденокарциномы заключается в том, что на первых стадиях она никак себя не проявляет. Проблемы возникают, когда опухоль достигает больших размеров или распространяется на другие органы.
Первые признаки болезни неспецифичны. Это может быть быстрая потеря веса, снижение аппетита, тошнота. Постепенно присоединяются более специфичные симптомы:
- Нарушение стула — запоры, которые сменяются зловонными поносами.
- Боли в животе.
- Наличие в стуле патологических примесей: кровь, слизь.
- На фоне хронических кровотечений из опухоли, развивается анемия.
- При больших размерах первичного опухолевого очага может возникнуть обтурационная кишечная непроходимость.
Методы диагностики аденокарциномы сигмовидной кишки
Главным методом, позволяющим обнаружить опухоль сигмовидной кишки является эндоскопическое исследование толстого кишечника. Это можно сделать во время тотальной колоноскопии (осмотра поверхности всего толстого кишечника), либо сигмоидоскопии — осмотра прямой и сигмовидной кишок.
В некоторых странах колоноскопию рекомендуют делать всем людям старше 50-60 лет, хотя бы один раз в десять лет. Эта процедура позволит вовремя обнаружить полипы и произвести их удаление, тем самым предотвратить возникновение злокачественной опухоли. Или же обнаружить рак на ранней, досимптоматической стадии, когда есть шансы на полное излечение.
Окончательный диагноз аденокарциномы выставляется только после гистологического исследования опухолевого материала. Для этого необходимо провести биопсию — изъятие фрагмента ткани. Она проводится во время колоно- или сигмоидоскопии. Гистологическое исследование позволит идентифицировать тип опухоли и сделать молекулярный профиль. Эти данные необходимы для подбора оптимального лечения.
Если диагноз злокачественного новообразования сигмовидной кишки подтверждается, пациенту назначается дальнейшее обследование, которое позволит установить степень распространения рака, его взаимодействие с окружающими тканями и органами, а также позволит обнаружить отдаленные метастазы. С этой целью проводят УЗИ, КТ, МРТ, ПЭТ-КТ и другие методы, позволяющие визуализировать очаги опухоли. Помимо этого, доктор может назначить определение уровней онкомаркеров (РЭА и СА 19-9). Они помогут отслеживать динамику процесса, держать под контролем ход лечения, возникновение рецидива или прогрессирование заболевания.
Классификация заболевания
Выделяют следующие типы аденокарциномы сигмовидной кишки:
- Высокодифференцированная аденокарцинома сигмовидной кишки. Клетки данной опухоли по строению «похожи» на нормальные и способны выполнять их функции. Такого вида опухоли растут очень медленно (годами), однако их сложно обнаружить на ранних стадиях, поскольку опухоль визуально не отличается от здоровой ткани сигмовидной кишки.
- Умеренно-дифференцированная аденокарцинома сигмовидной кишки. Здесь клетки полиморфны, т. е. имеют разный размер, форму и структуру. Такой вид рака является менее благоприятным, поскольку клетки быстро растут и размножаются.
- Низкодифференцированная аденокарцинома — самый агрессивный вариант. Данная опухоль быстро прорастает сквозь стенки кишки и распространяется на соседние ткани, рано дает метастазы.
Стадии заболевания рака сигмовидной кишки
- 0 стадия аденокарциномы — признаки злокачественности обнаруживаются только у клеток слизистого слоя кишечной стенки.
- 1 стадия — рак начинает инфильтрировать кишечную стенку, прорастая сквозь ее подслизистую основу и мышечный слой.
- 2А стадия — рак прорастает сигмовидную кишку по всей толщине ее стенки.
- 2 В — новообразование выходит за пределы кишечной стенки, поражая рядом расположенные ткани, но метастазов в лимфоузлы пока нет.
- 3 стадия — рак начинает давать метастазы, пока они обнаруживаются в регионарных лимфатических узлах.
- 4 стадия — имеются метастазы в отдаленные группы лимфоузлов или внутренние органы. Если это единичный метастаз во внутренние органы, говорят о 4а стадии, если имеется поражение нескольких отдаленных групп лимфатических узлов, выставляют 4b стадию, и, если злокачественный процесс распространился по поверхности брюшины (канцероматоз), это соответствует 4с стадии.
Осложнения рака сигмовидной кишки
Осложнения аденокарциномы сигмовидной кишки можно условно разделить на три группы:
- Осложнения, связанные с поражением кишечника. Опухоль может вызывать сужение просвета кишки, вплоть до полной обтурации. При этом развиваются симптомы кишечной непроходимости: боль и вздутие живота, отсутствие стула, нарастание симптомов интоксикации. Вторым типом осложнения является распад опухоли, который сопровождается кровотечением и/или перфорацией кишечной стенки с развитием разлитого перитонита. Все эти осложнения являются жизнеугрожающими и требуют немедленного хирургического вмешательства.
- Осложнения, связанные с повреждением опухолью рядом расположенных органов. Рак сигмовидной кишки может прорастать в мочевой пузырь, матку или предстательную железу у мужчин. Нередко образуются свищи между сигмовидной кишкой и прямой кишкой. Может затрагиваться и анальный сфинктер.
- Осложнения, связанные с наличием метастазов во внутренние органы. Чаще всего поражается печень и легкие. Несколько реже — головной мозг.
Лечение рака сигмовидной кишки
Основным методом лечения рака сигмовидной кишки является операция. На ранних стадиях можно ограничиться только ею. В более запущенных случаях требуются дополнительные методы воздействия в виде химиотерапии или таргетной терапии.
Операция
Как мы уже говорили, на ранних стадиях (рак in situ или 1 стадия) опухоль сигмовидной кишки можно удалить во время проведения колоноскопии. Это малоинвазивное вмешательство, которое легко переносится пациентом и не требует длительного восстановления. К сожалению, провести такое лечение не всегда представляется возможным, поскольку рак диагностируется на распространенных стадиях.
В этих случаях требуется удаление пораженного сегмента кишечника в пределах здоровых тканей. В идеале удаляется около 20-30 см кишки, т. к. край отсечения должен отступать от границы опухоли на 5 см. Операция может проводиться в один или два этапа:
- При одномоментном лечении после удаления опухоли, в конце операции осуществляют наложение анастомоза — восстановления непрерывности кишечника. Это можно сделать при соблюдении трех условий: соединяемые участки хорошо кровоснабжаются, в месте их соединения нет избыточного натяжения, и риск инфекционных осложнений минимален. Во всех остальных случаях проводятся двухэтапные операции с наложением колостомы.
- Двухэтапные операции. На первом этапе производят резекцию кишки с удалением аденокарциномы и накладывают колостому — отверстие на передней брюшной стенке, через которое будут выводиться каловые массы. Далее проводят необходимое лечение (химиотерапия) и после восстановления, при отсутствии рецидива, можно восстановить целостность кишки.
Одновременно с удалением опухоли сигмовидной кишки проводится и иссечение регионарных лимфатических узлов. Их отправляют на гистологическое исследование и при обнаружении метастазов корректируют схему лечения, добавляя в нее химиопрепараты. Кроме того, лимфодиссекция позволит предотвратить лимфогенное метастазирование аденокарциномы.
Если рак распространился на рядом расположенные ткани, производят и их резекцию, расширяя объем операции. Удаление метастазов внутренних органов производят во время отдельной операции.
Химиотерапия
Химиотерапия является дополнительным методом лечения аденокарциномы сигмовидной кишки. Ее целью является предотвращение рецидива и замедление прогрессирования патологии. Лечение может назначаться на дооперационном и в послеоперационном периоде:
- Дооперационная или неоадъювантная химиотерапия проводится для того, чтобы уменьшить размеры опухоли, сократить объемы операции и провести ее наименее травматичным методом.
- Послеоперационная или адъювантная химиотерапия назначается после операции. Ее целью является предотвращение рецидива и уничтожение возможных микрометастазов.
Как самостоятельный метод лечения, химиотерапия применяется на 4 стадии рака сигмовидной кишки в рамках паллиативной терапии. Она помогает облегчить состояние пациента и улучшить качество его жизни.
Помимо химиотерапии, используется таргетная терапия и иммунотерапия. Их воздействие более прицельно, по сравнению с цитостатиками. Лечение назначается только после проведения молекулярно-генетических тестов, которые подтвердят чувствительность опухоли к данному воздействию.
Рецидив
После проведения хирургической операции, все равно сохраняется вероятность того, что имеются скопления злокачественных клеток, которые успели рассеяться по всему организму. На момент проведения операции они могут иметь микроскопические размеры, что делает невозможным их обнаружение. Через какое-то время они начинают расти, давая рецидив или отдаленные метастазы. Очень важно вовремя обнаруживать возврат болезни, поскольку при своевременно оказанной помощи, пациент имеет более высокие шансы на успешное лечение.
В большинстве случаев они проявляют себя в первые два года после окончания лечения, поэтому на этот период за пациентом устанавливается динамическое наблюдение. После пятилетнего рубежа вероятность возврата болезни сильно снижается.
Восстановление после лечения
Восстановление после операции на кишечнике предполагает комплексный подход, включающий следующие аспекты:
- Обезболивание. Чаще всего с этой целью назначаются медикаментозные препараты, но может приниматься и регионарная анестезия (спинальная, эпидуральная и др).
- Уход за послеоперационным швом — в первое время перевязки будет делать медперсонал, а затем пациент. Важно следить чтобы в рана не кровоточила и не опухала.
- Диета. В первое время после операции категорически запрещается есть и пить, затем еду и питье вводят маленькими порциями до 6-8 раз в сутки. При этом необходимо соблюдать жесткую диету. Подробнее об этом вам расскажут в клинике.
- Лечебная физкультура. Для того чтобы восстановление прошло быстрее, важно соблюдать хотя бы минимальную физическую активность. Даже если пациенту предписан постельный режим, ему покажут несколько упражнений, которые следует неукоснительно выполнять. Комплекс упражнений обязательно будет включать дыхательную гимнастику, она позволит тонизировать организм и предотвратить развитие послеоперационной пневмонии.
Иногда операции при аденокарциноме сигмовидной кишки носят калечащий характер, поскольку требуется наложение колостомы. Это тяжело воспринимается пациентами. Некоторым из них может понадобиться консультация психолога. Однако стоит помнить, что современные методы ухода позволяют добиться хорошего качества жизни, без существенных ограничений. Обучение по уходу за колостомой проводится на базе клиники, в которой делается операция.
Прогноз и профилактика злокачественных опухолей сигмовидной кишки
Прогноз при аденокарциноме зависит от стадии заболевания. Пятилетняя выживаемость при начальных этапах (1-2 стадия) стремиться достигает 90%, на 3 стадии — около 70%, и на 4 — 11-14%.
Следует отметить, что рак сигмовидной кишки можно предотвратить. Для этого необходимо придерживаться принципов рационального питания (достаточное количество пищевых волокон, витаминов, отказ от переедания) и своевременно удалять кишечные полипы. С этой целью рекомендуется раз в десятилетие проходить тотальную колоноскопию пациентам из группы риска.
анализ исходов по данным регистра трех исследований III фазы
Введение:
Несмотря на наличие нескольких гистологических подтипов колоректального рака, влияние этого фактора на скорость прогрессии заболевания и эффективность терапии остается неопределенным.
Цели:
Цель исследования — оценка влияния определенного гистологического подтипа колоректального рака (муцинозной опухоли и низкодифференцированной аденокарциномы) на прогноз с использованием метода псевдорандомизации данных, полученных в ходе многоцентровых исследований III фазы.
Дизайн:
Анализ проводился на основе базы данных трех проспективных многоцентровых клинических исследований III фазы (the Japanese Foundation for Multidisciplinary Treatment of Cancer 7, 15, and 33). В них оценивались исходы хирургического вмешательства с или без адъювантной химиотерапии при резектабельном раке толстой кишки.
Методы:
Для более точного анализа использовался метод псевдорандомизации с применением логистической регрессии. Оценивалась послеоперационная выживаемость, частота рецидивов и чувствительность к химиотерапии.
Результаты:
Из 5489 пациентов у 136 (2,5%) и 155 (2,8%) по результатам патоморфолического исследования была диагностирована низкодифференцированная аденокарцинома или муцинозный рак толстой кишки соответственно. Выявление низкодифференцированной аденокарциномы было связано с более неблагоприятным прогнозом, чем в других группах (ОР, 1,69, 95% ДИ 1,00-2,87, p = 0,051), особенно в подгруппе пациентов, у которых проводилась адъювантная химиотерапия (ОР 2,16). Несмотря на то, что муцинозные опухоли имели промежуточное влияние на исходы у пациентов с I-III стадиями (ОР, 1,33, 95% ДИ, 0,90-1,96), выявлено, что они являются независимым прогностическим фактором у пациентов со II стадией, что связано с более высокой частотой местных рецидивов.
Ограничения:
Химиотерапевтические схемы лечения не соответствовали современным представлениям.
Выводы:
Низкодифффренцированная аденокарцинома и муцинозный рак толстой кишки имеют различную клиническую картину. Пациенты с муцинозными опухолями требуют особого внимания, даже при II стадии, из-за высокого риска развития локального рецидива.
Japanese Foundation for Multidisciplinary Treatment of Cancer. Clinical Signatures of Mucinous and Poorly Differentiated Subtypes of Colorectal Adenocarcinomas by a Propensity Score Analysis of an Independent Patient Database from Three Phase III Trials
Kanda M, Oba K, Aoyama T, Kashiwabara K, Mayanagi S, Maeda H, Honda M, Hamada C, Sadahiro S, Sakamoto J, Saji S, Yoshikawa T;
Инвазивная аденокарцинома толстой кишки
Когда была сделана биопсия толстой кишки, взятые образцы были изучены под микроскопом специализированным врачом с многолетней подготовкой под названием патолог . Патологоанатом отправляет вашему врачу отчет с диагнозом для каждого взятого образца. Этот отчет помогает управлять вашим лечением. Следующие вопросы и ответы призваны помочь вам понять медицинский язык, используемый в отчете о патологии, который вы получили для биопсии.Они не охватывают всю информацию, содержащуюся в отчете о патологии, которая может возникнуть в результате удаления (резекции) части вашей толстой кишки для лечения рака толстой кишки.
Что, если в моем отчете упоминается слепая кишка, восходящая ободочная кишка, поперечная ободочная кишка, нисходящая ободочная кишка, сигмовидная или прямая кишка?
Это все части толстой кишки. Слепая кишка — это начало толстой кишки, где тонкая кишка переходит в толстую. Восходящая ободочная кишка, поперечная ободочная кишка, нисходящая ободочная кишка и сигмовидная кишка являются другими частями толстой кишки после слепой кишки.Ободочная кишка заканчивается прямой кишкой, где отходы хранятся до тех пор, пока не выйдут через задний проход.
Что такое аденокарцинома толстой (или прямой) кишки?
Аденокарцинома — это тип рака, который начинается в клетках, которые образуют железы, вырабатывающие слизь, смазывающую внутреннюю часть толстой и прямой кишки. Это наиболее распространенный вид рака прямой и толстой кишки.
Что означают слова «инвазивный» или «проникающий»?
Поскольку рак толстой кишки растет и распространяется за пределы внутренней оболочки толстой кишки (слизистой оболочки), он называется инвазивным (или инфильтрирующим ) аденокарциномой .Инвазивные виды рака называются истинными раками, потому что они могут распространяться на другие части тела.
Означает ли это, что опухоль проникла глубоко и имеет плохой прогноз?
Не всегда. Все это означает, что это настоящий рак. Биопсия — это всего лишь небольшая часть опухоли, взятая изнутри толстой кишки, поэтому она не всегда может показать, насколько глубоко опухоль проникла в стенку толстой кишки. Чтобы узнать, насколько далеко зашло раковое заболевание, патолог должен удалить всю опухоль (удаленную во время операции).
Что означает дифференциация?
Дифференциация — это степень рака, которая основана на том, насколько ненормально клетки выглядят под микроскопом. Рак более высокой степени или плохо дифференцированный, как правило, быстрее растет и распространяется. Рак толстой кишки обычно делится на 3 степени:
.- Хорошо дифференцированный (низкосортный)
- Умеренно дифференцированный (средний балл)
- Слабо дифференцированный (высокий)
Иногда, правда, просто делят на 2 класса: хорошо-умеренно дифференцированный (низкий) и слабо дифференцированный (высокий).
Какое значение имеет степень рака толстой кишки?
Уровень— это один из многих факторов, используемых для прогнозирования вероятности роста и распространения рака. Плохо дифференцированный (высокодифференцированный) рак толстой кишки имеет тенденцию расти и распространяться быстрее, чем хорошо и умеренно дифференцированный рак толстой кишки. Однако другие факторы также важны для определения прогноза (перспективы) человека, например, насколько далеко распространился рак (что не может быть определено на биопсии).
Что означает сосудистая, лимфатическая или лимфоваскулярная (ангиолимфатическая) инвазия?
Эти термины означают, что рак присутствует в кровеносных сосудах и / или лимфатических сосудах толстой кишки, поэтому существует повышенная вероятность распространения рака за пределы толстой кишки.Однако это не означает, что ваш рак распространился или неизлечим. Наличие этого типа инвазии может быть фактором, определяющим, какие виды лечения рекомендуются после удаления рака.
Что такое полип?
Полип — это выступ (разрастание) ткани внутренней оболочки толстой кишки в просвет (полый центр) толстой кишки. Под микроскопом разные типы полипов выглядят по-разному. Полипы — это доброкачественные (незлокачественные) новообразования, но рак может начаться в некоторых типах полипов.
Что это значит, если помимо рака в моем отчете говорится, что существуют и другие полипы, такие как аденоматозные полипы (аденомы) или гиперпластические полипы?
Полипы толстой кишки — обычное явление. Гиперпластические полипы обычно доброкачественные (не рак и не предраковые заболевания) и не вызывают беспокойства. Но разные типы аденоматозных полипов (аденомы) необходимо удалять. Тем не менее, если полипы присутствуют в дополнение к раку в другом месте толстой кишки, они обычно не влияют на лечение или последующее наблюдение за раком.
Что означает упоминание муцина или коллоида в моем отчете?
Муцин вырабатывается толстой кишкой для смазывания толстой кишки. Рак толстой кишки, который продуцирует большое количество муцина, обозначается как муцинозный или коллоидные аденокарциномы . Обычно, когда он присутствует на биопсии, он не влияет на лечение.
Что означает, если в моем отчете о биопсии упоминаются специальные тесты, такие как микросателлитная нестабильность (MSI) и MSh3, MSH6, MLh2 и PMS2?
При некоторых формах рака толстой кишки специальные лабораторные тесты могут выявить аномалию, называемую микросателлитной нестабильностью или MSI в раковых клетках.Нестабильность микросателлитов связана с дефектами (мутациями) нескольких генов mismatch repair (MMR), включая MSh3 , MSH6 , MLh2 и PMS2 . Унаследованные дефекты этих генов могут привести к заболеванию, называемому синдромом Линча или наследственным неполипозным раком толстой кишки (HNPCC) .
Если будет обнаружено, что у вашего рака есть MSI или дефект в гене MMR, ваш врач может порекомендовать генетическое консультирование и тестирование вашей крови, чтобы определить, есть ли у вас синдром Линча.Наряду с высоким риском рака толстой кишки люди с синдромом Линча имеют повышенный риск некоторых других видов рака. Другие члены семьи, унаследовавшие ту же мутацию гена, также подвержены повышенному риску развития этих видов рака.
Результаты тестаMSI также могут повлиять на лечение рака толстой кишки. Например, на ранних стадиях рака с низким уровнем MSI (или без MSI) может потребоваться более агрессивное лечение, чем на другие ранние стадии рака.
Что означает, если в моем отчете о биопсии упоминаются специальные тесты, такие как KRAS, NRAS и BRAF?
Эти тесты ищут изменения в генах KRAS , NRAS и BRAF внутри раковых клеток.Для людей с более запущенным раком толстой кишки эти тесты могут помочь определить, может ли вам помочь лечение определенными типами лекарств (так называемые таргетные препараты или таргетная терапия). Другими словами, они используются, чтобы помочь вашему врачу выбрать лучшее лечение вашего рака. Хотя эти тесты ищут определенные генные мутации, они не связаны с генетическим консультированием или тестированием. Они предоставляют информацию только о самом раке и о том, какое лечение вам может понадобиться.Помните, что не каждому пациенту с раком толстой кишки нужны другие виды лечения, помимо хирургического вмешательства.
Слабо дифференцированная аденокарцинома толстой и прямой кишки: клиническая характеристика
Предпосылки / цели: Цели этого исследования заключались в оценке прогноза и гистопатологических факторов низкодифференцированной колоректальной аденокарциномы, а также клинической значимости предложенных гистопатологических подклассов.
Методология: В этом исследовании приняли участие пятьдесят восемь пациентов с низкодифференцированной аденокарциномой. В соответствии с распространением лимфатических каналов в опухолевой ткани они были классифицированы на лимфангитный тип (опухоль распространяется за пределы внутрислизистого опухолевого пространства через лимфатический канал) и нелимфангитный тип (опухоль распространяется в этом пространстве). Затем они были подразделены на медуллярный, промежуточный и скиррозный типы в зависимости от количества фиброзной стромы.Кроме того, были проведены иммуногистологические исследования экспрессии молекулы межклеточной адгезии (E-кадгерина).
Полученные результаты: В 33 случаях (57%) присутствовал лимфангитный тип и в 25 случаях — нелимфангитный тип (43%). При лимфангиитическом типе 5 случаев относились к медуллярному типу (15%), 17 случаев — к промежуточному типу (52%) и 11 случаев — к скиррозному типу (33%), включая 2 случая карциномы с перстневым кольцом.Среди нелимфангитных типов доминировал костномозговой тип (20 случаев, 80%), в то время как промежуточный тип и скиррозный тип составляли 3 случая (12%) и 2 случая (8%) соответственно. Показатели выживаемости были рассчитаны для обоих типов, и была обнаружена большая разница в показателях 5-летней выживаемости; 0% для лимфангитного типа и 72% для нелимфангитного типа (p <0,05). Не было обнаружено корреляции между экспрессией кадгерина и подклассом.
Выводы: В заключение следует отметить, что обширная инфильтрация опухоли и рост лимфатических сосудов, по-видимому, являются важным прогностическим фактором для низкодифференцированной аденокарциномы по сравнению с типами метастазов.
Колоректальная карцинома: патологические аспекты
J Gastrointest Oncol. 2012 сен; 3 (3): 153–173.
Кафедра патологии и лабораторной медицины Медицинской школы Дэвида Геффена Калифорнийского университета, Лос-Анджелес, Калифорния, США
Автор, ответственный за переписку.* Равные взносы
Соответствует: Hanlin L. Wang, MD, PhD. Кафедра патологии и лабораторной медицины, Калифорнийский университет в Лос-Анджелесе.10833 Le Conte Avenue, Лос-Анджелес, Калифорния, США. Тел .: (310) 206-1763; Факс: (310) 267-2058. Электронная почта: ude.alcu.tendem@gnawnilnah.
Поступило 6 апреля 2012 г .; Принято 23 апреля 2012 г.
Copyright 2012 Pioneer Bioscience Publishing Company. Все права защищены.Эта статья цитировалась в других статьях в PMC.Abstract
Колоректальная карцинома является одним из наиболее распространенных видов рака и одной из основных причин смерти от рака в Соединенных Штатах. Патологическое исследование образцов биопсии, полипэктомии и резекции имеет решающее значение для надлежащего ведения пациента, оценки прогноза и семейного консультирования.Молекулярное тестирование играет все более важную роль в эпоху персонализированной медицины. В этой обзорной статье основное внимание уделяется гистопатологии и молекулярной патологии колоректальной карциномы и ее предшественников, с акцентом на их клиническую значимость.
Ключевые слова: Колоректальная карцинома, патология, аденома, молекулярная, MSI, KRAS, BRAF
Введение
Колоректальная карцинома является третьим по распространенности раком в США после рака простаты и легких / бронхов у мужчин и после рака груди. и рак легких / бронхов у женщин.Это также третья по значимости причина смерти от рака в Соединенных Штатах после рака легких / бронхов и простаты у мужчин и после рака легких / бронхов и груди у женщин (1). В 2011 году в Соединенных Штатах было диагностировано 141 210 новых случаев колоректальной карциномы, из которых, по оценкам, умерло 49 380 человек, что составляет примерно 9% всех вновь диагностированных раковых заболеваний и всех смертей, связанных с раком (за исключением базальноклеточного и плоскоклеточного рака кожи).
С быстрым терапевтическим прогрессом в эпоху персонализированной медицины роль патологов в ведении пациентов с колоректальной карциномой значительно расширилась от традиционных морфологов до клинических консультантов для гастроэнтерологов, колоректальных хирургов, онкологов и медицинских генетиков.Помимо точного гистопатологического диагноза, патологоанатомы несут ответственность за точную оценку стадии патологии, анализ границ хирургического вмешательства, поиск прогностических параметров, которые не включены в стадию, таких как лимфоваскулярная и периневральная инвазия, и оценка терапевтического эффекта у пациентов, получавших неоадъявантную терапию. . Патологи также играют центральную роль в анализе гистологических характеристик опухолей, которые указывают на микросателлитную нестабильность (MSI), выборе соответствующих срезов тканей для тестирования MSI и анализа мутаций для KRAS и BRAF, а также интерпретации результатов этих важных терапевтических и прогностических тестов ( 2).
Эта обзорная статья посвящена гистолопатологии колоректальной карциномы и ее предшественников. Обсуждаются последние достижения в области молекулярной патологии и молекулярных тестов. Подчеркивается их клиническая значимость.
Гистопатологическая диагностика колоректальной карциномы
Более 90% колоректальных карцином представляют собой аденокарциномы, происходящие из эпителиальных клеток слизистой оболочки толстой кишки (3). Другие редкие типы колоректальной карциномы включают нейроэндокринную, плоскоклеточную, аденосквамозную, веретено-клеточную и недифференцированные карциномы.Обычная аденокарцинома характеризуется железистым образованием, которое является основой гистологической классификации опухоли. При хорошо дифференцированной аденокарциноме> 95% опухоли формирует железы. Умеренно дифференцированная аденокарцинома показывает образование желез на 50-95%. Плохо дифференцированная аденокарцинома в основном солидная, с образованием желез <50%. На практике большинство колоректальных аденокарцином (~ 70%) диагностируются как умеренно дифференцированные (). На долю хорошо и плохо дифференцированных карцином приходится 10% и 20% соответственно.
Пример умеренно дифференцированной аденокарциномы, демонстрирующей сложные железистые структуры в десмопластической строме (исходное увеличение × 200)
Очевидно, что определение степени опухоли является субъективным упражнением. Многие исследования продемонстрировали, что двухуровневая система оценки, которая сочетает в себе хорошо и умеренно дифференцированную до низкой степени (образование железы 50%) и определяет низкую степень дифференциации как высокую степень (образование железы <50%), снижает вариативность между наблюдателями и улучшает прогностическую значимость ( 4,5).Хотя это противоречиво, степень опухоли обычно рассматривается как независимая от стадии прогностическая переменная, а гистология высокой степени или плохо дифференцированная гистология связана с плохой выживаемостью пациента (6-8). Однако следует подчеркнуть, что гистологическая классификация должна применяться только к обычной аденокарциноме. Некоторые из гистологических вариантов, которые будут обсуждены позже, могут иметь морфологию высокой степени злокачественности, но вести себя как опухоли низкой степени злокачественности из-за своего статуса MSI.
Подавляющее большинство колоректальных карцином первоначально диагностируется с помощью эндоскопической биопсии или полипэктомии.Ключевым аспектом микроскопического исследования является поиск доказательств инвазии. Однако это может быть сложно, если биопсия поверхностная или плохо ориентирована. Если можно идентифицировать мышечную слизистую оболочку, важно определить, не нарушена ли она опухолевыми клетками. Инвазивная карцинома обычно проникает через мышечную слизистую оболочку в подслизистую основу и иногда наблюдается в непосредственной близости от подслизистых кровеносных сосудов. Другой важной особенностью инвазии является наличие десмоплазии или десмопластической реакции (), типа фиброзной пролиферации вокруг опухолевых клеток, вторичной по отношению к инвазивному росту опухоли.Инвазивная колоректальная карцинома также часто показывает характерные некротические образования в просвете железы, так называемый «грязный некроз» (). Эта уникальная функция может быть весьма полезной при обнаружении первичного колоректального рака при обнаружении метастазов неизвестного происхождения.
Десмопластическая реакция, характеризующаяся пролиферацией веретенов, окружающих аденокарциноматозную железу (исходное увеличение × 400)
Некротический мусор («грязный некроз») в просвете аденокарциноматозных желез (исходное увеличение × 400)
Следует отметить, что когда поставлен диагноз инвазивная карцинома, это означает, что карцинома, по крайней мере, проникла в подслизистую оболочку толстой кишки.Это отличается от концепции инвазии в другие части желудочно-кишечного тракта (пищевод, желудок и тонкий кишечник), где наличие инвазии слизистой оболочки является достаточным для диагностики инвазивной карциномы (pT1). В толстой кишке для диагностики опухоли pT1 требуется подслизистая инвазия. По причинам, которые не совсем ясны, но обычно предполагают, что они связаны с относительной недостаточностью лимфатических сосудов, инвазия, ограниченная собственной пластинкой оболочки и мышечной оболочкой, не имеет риска узловых или отдаленных метастазов.Таким образом, внутрислизистая карцинома предпочтительно называется дисплазией высокой степени (обсуждается позже) патологами, чтобы избежать ненужного хирургического вмешательства. В Руководстве по стадированию рака Американского объединенного комитета по раку (AJCC) (9) инвазия слизистой оболочки классифицируется как карцинома in situ (Tis). Тем не менее, термин «внутрислизистый рак» все еще может использоваться некоторыми патологами. Независимо от того, какой термин используется патологами, выявление дисплазии высокой степени или внутрислизистой карциномы в образце биопсии или полипэктомии не должно влиять на принятие решения по ведению пациента.Решение о проведении хирургической резекции должно в конечном итоге определяться общим видом поражения, результатами эндоскопического УЗИ и возможностью эндоскопической резекции.
Гистологические варианты
В классификации Всемирной организации здравоохранения (ВОЗ) перечислен ряд гистологических вариантов колоректальной карциномы, таких как муцинозный, перстневидный, медуллярный, микропапиллярный, зубчатый, ребристый комедонный тип, аденосквамозный, веретено-клеточный и др. и недифференцированный. Здесь обсуждаются только первые 3 варианта.
Муцинозная аденокарцинома
Этот особый тип колоректальной карциномы определяется тем, что> 50% объема опухоли состоит из внеклеточного муцина (3). Опухоли со значительным муцинозным компонентом (> 10%), но <50% обычно называют аденокарциномой с муцинозными признаками или муцинозной дифференцировкой. Муцинозная аденокарцинома обычно показывает большие железистые структуры с пулами внеклеточного муцина (). Можно увидеть переменное количество индивидуальных опухолевых клеток, включая клетки перстня.Прогноз муцинозной аденокарциномы по сравнению с обычной аденокарциномой был неоднозначным в различных исследованиях (10,11). Многие муцинозные аденокарциномы возникают у пациентов с наследственным неполипозным колоректальным раком (HNPCC или синдром Линча) и, таким образом, представляют собой опухоли высокого уровня MSI (MSI-H) (12). Ожидается, что эти опухоли будут вести себя низкоуровневым образом. Напротив, ожидается, что муцинозные аденокарциномы, которые являются микросателлитно-стабильными (MSS), будут вести себя более агрессивно, особенно при обнаружении на поздней стадии.
Муцинозная аденокарцинома с обильным внеклеточным муцином (исходное увеличение × 200)
Аденокарцинома с перстневым кольцом
В отличие от желудочной аденокарциномы с перстневым кольцом в толстой кишке встречается редко, составляя <1% всех колоректальных карцином. Подобно муцинозной карциноме, карцинома с перстневым кольцом определяется наличием> 50% опухолевых клеток, демонстрирующих особенности клеток с перстневым кольцом, характеризующиеся выраженной внутрицитоплазматической муциновой вакуолью, которая выталкивает ядро к периферии ().Клетки с печатным кольцом могут демонстрировать инфильтративный характер роста или присутствовать в пулах внеклеточного муцина. По определению, карцинома из перстневых клеток плохо дифференцирована (высокая степень) и имеет худший исход, чем обычная аденокарцинома (11,13,14). Однако некоторые карциномы из перстневых клеток могут быть опухолями MSI-H и, таким образом, биологически вести себя как опухоли низкой степени злокачественности (3).
Карцинома из перстневых клеток (исходное увеличение × 400)
Медуллярная карцинома
Медуллярная карцинома встречается крайне редко, составляя примерно 5-8 случаев на каждые 10000 диагностированных колоректальных раковых заболеваний, при средней ежегодной заболеваемости 3.47 (± 0,75) на 10 млн населения (15). Эта опухоль характеризуется слоями эпителиоидных неопластических клеток с крупными везикулярными ядрами, выступающими ядрышками и обильной цитоплазмой. Как правило, на образцах после резекции он имеет расширяющуюся границу () и обычно ассоциируется с выраженными лимфоцитами, инфильтрирующими опухоль (). Медуллярная карцинома — это особый гистологический подтип, который тесно связан с MSI-H (16,17). Прогноз обычно благоприятный, несмотря на его плохо дифференцированную или недифференцированную гистологию.
Медуллярная карцинома с раздвигающейся границей на краю опухоли (исходное увеличение × 40)
Медуллярная карцинома с плохо дифференцированной гистологией и инфильтрирующими опухоль лимфоцитами (исходное увеличение × 400)
Иммуногистохимический фенотип
Наиболее широко используемый иммуногистохимический маркер колоректальная аденокарцинома — это цитокератин (CK) 20, CK7 и CDX2. Наиболее распространенным иммунофенотипом колоректальной аденокарциномы является положительный для CK20 и отрицательный для CK7, что является относительно специфическим паттерном окрашивания для колоректального происхождения (18).Однако до 20% опухолей могут демонстрировать CK7-положительный / CK20-отрицательный или CK7-отрицательный / CK20-отрицательный паттерн окрашивания. Было высказано предположение, что снижение или отсутствие экспрессии CK20 при колоректальной карциноме связано с MSI-H (19). CDX2 является маркером кишечной дифференцировки и является положительным в> 90% колоректальных аденокарцином (20,21). Однако CDX2 может быть положительным при любой карциноме, которая проявляет кишечную дифференцировку и, следовательно, не является полностью колоректально-специфической. Интересно, что медуллярные карциномы толстой кишки часто бывают CK20-отрицательными и CDX2-отрицательными, что соответствует концепции MSI (16,19).
Патологическая стадия
Стадия опухоли на сегодняшний день является наиболее важным прогностическим предиктором клинического исхода для пациентов с колоректальной карциномой. Гистологическое исследование хирургически резецированных образцов играет незаменимую роль в определении глубины инвазии опухоли (T) и степени метастазов в лимфоузлы (N). Гистологическое определение T1 (опухоль проникает в подслизистую оболочку), T2 (опухоль проникает в собственную мышечную оболочку) и T3 (опухоль проникает через собственную мышечную мышцу в периколоректальные ткани) обычно не вызывает затруднений при использовании системы стадирования TNM AJCC (9).Однако определение T4a (опухоль проникает на поверхность висцеральной брюшины) и T4b (опухоль непосредственно вторгается или прикрепляется к другим органам или структурам) иногда может быть проблематичным. Во-первых, вовлечение серозной поверхности (висцеральной брюшины) можно не заметить, если образец не взят для гистологического исследования. Во-вторых, серозную поверхность можно спутать с периферическим (радиальным) или брыжеечным краем, который представляет собой неперитонеализированную поверхность, созданную хирургическим путем путем тупого или острого рассечения.Опухоль Т3 может поражать радиальный край, а опухоль Т4 может иметь отрицательный радиальный край. В-третьих, перфорацию, вызванную хирургическим вмешательством в месте опухоли, можно спутать с истинной перфорацией опухоли, что требует уточнения от хирургов. В-четвертых, прилипание других органов или структур к месту опухоли не обязательно соответствует критериям T4b. Гистологически место прикрепления может показывать только воспалительные изменения, образование абсцесса и / или фиброз, но без прямого вовлечения опухоли. Наконец, существует некоторая путаница в определении вовлечения висцеральной брюшины.Ясно, что интерпретация T4a может быть однозначной, если: (I) опухолевые клетки присутствуют на серозной поверхности с воспалительной реакцией, мезотелиальной гиперплазией и / или эрозией; или (II) свободные опухолевые клетки видны на серозной поверхности с лежащей под ними язвой висцеральной брюшины. Однако идентификация опухолевых клеток близко к серозной поверхности, но не на ней, будет рассматриваться некоторыми исследователями как T4a, если есть связанные мезотелиальные воспалительные и / или гиперпластические реакции (22).По-видимому, применение этого третьего критерия подвержено субъективным суждениям и не воспроизводится. Отмечается, что в обновленных протоколах рака и контрольных списках Колледжа американских патологов (CAP) только первые два критерия указаны как диагностические признаки T4a, а третий критерий удален (23).
Опухолевые клетки, расположенные близко к серозной поверхности, но не на ней, с мезотелиальными воспалительными и гиперпластическими реакциями, которые некоторые исследователи могут рассматривать как T4a (исходное увеличение × 40)
Патологи обязаны извлечь столько лимфатических узлов, сколько возможно из хирургических образцов.Подавляющее большинство патологов следуют рекомендациям минимум 12 узлов (24). Дополнительные усилия будут предприняты, если будет извлечено <12 узлов, хотя это увеличит время обработки отчетов о патологии. Дополнительные усилия могут включать повторный ручной поиск, отправку большего количества разделов, использование методов очистки от жира (25,26) или инъекцию метиленового синего ex vivo (27,28). Применение методов очистки от жира имеет несколько потенциальных недостатков, таких как дальнейшая задержка регистрации отчетов о патологии, стоимость, токсичность и утилизация очищающих растворов, а также неизвестное влияние на иммуногистохимию.В результате удаление жира не стало стандартной практикой в лабораториях патологии. Инъекции метиленового синего - относительно новый метод лечения колоректального рака. В этой области было опубликовано всего несколько публикаций, в основном от одной и той же исследовательской группы (27,28). Его клиническое применение требует дальнейшего изучения.
Следует понимать, что общее количество извлеченных узлов не только зависит от диссектора, но также зависит от ряда переменных образца и пациента. Исследования показали положительную корреляцию с длиной образца, шириной периколоректального жира, женским полом и размером опухоли; и отрицательная корреляция с возрастом пациента и ректосигмоидным расположением опухолей (29,30).Неудивительно, что можно ожидать менее 12 узлов, если пациенты получали предоперационную неоадъювантную терапию (31,32). Рекомендуется, чтобы патологоанатомы задокументировали степень усердия своих усилий по поиску лимфатических узлов в образце в отчетах о патологии, если извлечено <12 узлов.
Одним из интересных вопросов при определении стадии узлов является интерпретация дискретных отложений опухоли в периколоректальном жире от основной опухоли, но без идентифицируемой остаточной ткани лимфатических узлов.В AJCC Cancer Staging Manual 5 th edition узел опухоли> 3 мм считался положительным узлом, тогда как узел ≤3 мм классифицировался в категорию прерывистого распространения (T3). В издании 6 th опухолевые отложения считались положительными узлами, если они были круглыми и имели гладкий контур независимо от размера, но классифицировались по категории Т, а также как венозная инвазия, если они имели неправильную форму. В текущем издании (7 th edition) признается тот факт, что отложения опухоли могут представлять собой прерывистое расширение, венозную инвазию с внесосудистым распространением или действительно полностью замененные лимфатические узлы.Учитывая их связь со снижением безрецидивной и общей выживаемости (33,34), эти опухолевые отложения теперь считаются узловыми метастазами, независимо от размера или контура, и обозначаются N1c при отсутствии метастазов в регионарные лимфатические узлы, чтобы способствовать дополнительному послеоперационному лечению. Однако, если также идентифицирован один положительный лимфатический узел, стадия N будет изменена с N1c на N1a. Наличие прерывистых опухолевых отложений не изменяет стадию Т в выпуске 7 th (9).
Прогностическое значение изолированных опухолевых клеток (ITC), определяемых как отдельные опухолевые клетки или небольшие кластеры опухолевых клеток размером ≤0,2 мм, обнаруженных либо с помощью иммуногистохимического окрашивания, либо стандартного окрашивания гематоксилином и эозином в регионарных лимфатических узлах, в настоящее время остается неясным. В отсутствие явных метастазов в лимфоузлы ITC классифицируются как N0, но аннотируются как N0 (i +), где «i» означает «изолированные опухолевые клетки». С другой стороны, микрометастаз (> 0,2 мм, но ≤2,0 мм) обозначается как N1 (микр.).Следует указать количество лимфатических узлов, вовлеченных в ITC или микрометастазирование (9,23).
Отчет о патологии
Большинство патологов используют стандартизированный синоптический отчет о колоректальной карциноме в соответствии с контрольным списком, рекомендованным CAP (23). Подробности, которые должны быть включены в отчет, включают тип образца, локализацию опухоли, размер опухоли, макроскопическую перфорацию опухоли, гистологический тип, гистологический класс, микроскопическое распространение опухоли, границы (проксимальные, дистальные и радиальные), эффект лечения (для опухолей, леченных неоадъювантом. терапия), лимфоваскулярная инвазия, периневральная инвазия, отложения опухоли (прерывистое экстрамуральное распространение), стадия TNM (включая общее количество исследованных лимфатических узлов и общее количество вовлеченных узлов).Некоторые отчеты о патологии могут также включать передний край опухоли (инфильтративный или расширяющийся), наличие или отсутствие зачатка опухоли и оценку гистологических характеристик, которые указывают на MSI, таких как инфильтрирующие опухоль лимфоциты, перитуморальный Крон-подобный лимфоидный ответ и процентное соотношение муцинозного компонента.
Обработка образцов и отбор образцов
В лабораториях патологии образцы после хирургической резекции обрабатываются систематическим образом, чтобы обеспечить полноту и точность отчета о патологии.Перед вскрытием наружную поверхность образца исследуют на предмет возможного серозного поражения, поражения радиального края, перфорации опухоли и удаленных опухолевых имплантатов. При резекции прямой кишки проверяется целостность мезоректума. После того, как образец ориентирован и образец измерен, радиальный край вокруг опухоли окрашивается. Затем образец вскрывают, обычно вдоль антимезентериальной границы, чтобы не прорезать опухоль. Регистрируются расположение и размер опухоли, а также ее расстояние от ближайшего края.Небольшие части свежей опухоли и неопухолевых тканей могут быть закуплены для банка тканей, но это не должно ставить под угрозу количество опухоли для диагностики.
Вскрытый и очищенный образец прикрепляют булавками к восковой доске и погружают в достаточный объем формалина для фиксации на ночь. Затем опухоль разрезается с интервалом 3-4 мм для оценки глубины инвазии. Остальная часть образца также исследуется на предмет дополнительных повреждений. Соответствующие срезы опухоли (обычно 5 срезов в зависимости от размера опухоли) должны быть отправлены на микроскопическое исследование, чтобы включить область наиболее глубокой инвазии и максимизировать вероятность обнаружения лимфоваскулярной и периневральной инвазии.Включение опухоли и прилегающей не пораженной толстой кишки в одни и те же секции желательно, потому что всегда есть вероятность того, что случай может быть использован для исследования в будущем. Дополнительные срезы должны включать проксимальный и дистальный края, радиальный край (если он не включен в срезы опухоли), любые дополнительные полипы или поражения, а также произвольно не пораженный толстый кишечник.
После взятия указанных выше срезов брыжеечный жир или периколоректальные мягкие ткани удаляются и исследуются на лимфатические узлы.Все явно отрицательные лимфатические узлы полностью подвергаются микроскопическому исследованию. Макро-положительные лимфатические узлы могут быть представлены частично или полностью в зависимости от их размера.
Образец для полипэктомии имеет чернила на прижатом основании, но ножка может втягиваться, и поэтому ее трудно идентифицировать. Образец делится пополам или серийно, в зависимости от его размера, и представляется полностью. Сечение должно следовать в вертикальной плоскости ножки, чтобы максимизировать гистологическую оценку края полипэктомии и вовлечения подслизистого слоя.Однако, если образец получен несколькими частями, оценка запаса может стать невозможной.
Предшествующие поражения
Хорошо известно, что подавляющее большинство колоректальных аденокарцином возникает из предшественников поражений, таких как аденомы и дисплазия. Резидуальная аденома — частая находка при колоректальных аденокарциномах. Эндоскопическая полипэктомия снижает частоту возникновения колоректального рака у пролеченных пациентов и предотвращает смерть от колоректального рака (35,36). Здесь обсуждаются некоторые из распространенных предшественников поражений.
Аденомы
По крайней мере, половина взрослых в западных странах будет иметь аденоматозный полип в течение жизни, и одна десятая этих поражений будет прогрессировать до аденокарциномы (37). Риск увеличивается после 50 лет. Эндоскопически аденомы могут быть на ножке или сидячими. По определению, аденомы — это клональные поражения, которые демонстрируют, по крайней мере, дисплазию низкой степени, характеризующуюся увеличенными, гиперхроматическими и удлиненными (пенцилловидными) ядрами, расположенными в стратифицированной конфигурации вдоль базальной мембраны.Аденоматозные клетки могут демонстрировать истощение муцина и повышенную апоптотическую активность. Интересно, что аденоматозные полипы, по-видимому, развиваются по механизму «сверху вниз» (38). Таким образом, небольшие поражения часто имеют только аденоматозный эпителий в их поверхностных частях.
Обычные аденомы делятся на тубулярные, трубчато-ворсинчатые и ворсинчатые в зависимости от их архитектурных особенностей (). Тубулярные аденомы состоят из простых криптоподобных диспластических желез и содержат менее 25% ворсинчатого компонента.Ворсинчатые аденомы на> 75% состоят из ворсинчатого компонента, напоминающего пальцеобразные выступы. Тубуловиллярные аденомы представляют собой промежуточные поражения с 25-75% ворсинчатого компонента. Аденомы большого размера (> 1 см) или преимущественно ворсинчатые, или содержащие дисплазию высокой степени (обсуждается ниже), считаются «продвинутыми аденомами» (39), которые требуют более агрессивного эндоскопического наблюдения.
Примеры трубчатой аденомы (A. исходное увеличение × 200) и трубчатой аденомы (B. исходное увеличение × 100)
Зубчатые полипы
Зубчатые полипы — это общий термин для любых полипов с зубчатыми (пилообразными или звездчатыми) архитектура эпителиального компартмента.Это гетерогенная группа поражений, в которую в основном входят гиперпластический полип, зубчатая аденома / полип на сидячей кости и традиционная зубчатая аденома (40).
Гиперпластические полипы (ГП) являются наиболее частыми зубчатыми поражениями, которые чаще встречаются в дистальном отделе толстой кишки и обычно имеют небольшой размер (<5 мм). Только редкие HP> 1 см. Эндоскопически трудно отличить HP от аденомы (41). Гистологически ГП характеризуются простой трубчатой архитектурой с удлиненными и прямыми криптами и люминальной зубчатостью, которая более выражена в верхних частях крипт с появлением поверхностного созревания ().Зона пролиферации ограничена базальной частью крипт, которая остается узкой и не зазубренной (42). HPs можно далее разделить на микровезикулярные, бокаловидные клетки и подтипы с низким содержанием муцина (43), но эта гистологическая подклассификация, по-видимому, не имеет никакого клинического значения.
Гиперпластический полип (исходное увеличение × 100)
Сессильная зубчатая аденома (SSA) и зубчатый полип сидячей кости (SSP) относятся к одному и тому же зубчатому поражению и в настоящее время используются взаимозаменяемо.SSA / P чаще встречаются в проксимальном отделе толстой кишки и обычно больше, чем HP (44). Гистологическая диагностика SSA / Ps полностью основана на архитектурных особенностях, характеризующихся чрезмерной зазубринами крипт, зазубринами по всей длине крипты, гипермуцинозным эпителием, дилатацией крипт, ветвлением крипт, горизонтальными расширениями крипт в основании крипт и аберрантной пролиферацией (45). Несмотря на название, SSA / Ps не имеют диспластических ядерных изменений, которые характерны для обычных аденом. Следует помнить, что SSA / P — относительно новая организация, которая раньше классифицировалась как HP.Таким образом, патологи могут столкнуться с трудностями при различении SSA / P и HP на гистологическом основании (46–48). В случаях, когда разделение непросто, может быть поставлен описательный диагноз «зубчатый полип» с комментарием.
Тем не менее, отделение SSA / P от HP представляется важным, потому что SSA / P теперь считается предшественником поражения колоректальной карциномы с MSI и, вероятно, также для метилированных CpG-островков карцином MSS (40), тогда как HP обычно считается поражением. быть безобидным.Наиболее надежные признаки, позволяющие отличить SSA / P от HP, — это расширение крипт в основании, часто предполагающее L, перевернутую букву T или конфигурацию в форме якоря (). Эти необычные формы («архитектурная дисплазия») часто наблюдаются в двух или более смежных криптах и, как полагают, являются результатом аномальной пролиферации и / или снижения апоптоза (42–44). Учитывая предполагаемый предраковый потенциал, для пациентов с SSA / Ps, вероятно, оправдано эндоскопическое наблюдение, аналогичное таковым с обычными аденомами.Кроме того, часть этих поражений потенциально может прогрессировать до карциномы быстрее, чем обычные аденомы. Таким образом, пациентам с этими поражениями может потребоваться еще более агрессивное эндоскопическое наблюдение (49,50).
Вид с малым увеличением (A. исходное увеличение × 40) и большим увеличением (B. исходное увеличение × 200) зубчатого полипа на сидячем месте. Обратите внимание на наличие базальной зубчатости
Традиционная зубчатая аденома (TSA) — это уникальный и необычный тип истинной аденомы, которая демонстрирует ядерную дисплазию низкой степени, аналогичную той, которая наблюдается при обычной аденоме, а также имеет зубчатую архитектуру, аналогичную той, которая наблюдается для HP и SSA / P.Характерны выраженная цитоплазматическая эозинофилия и характер роста ворсинок ().
Пример традиционной зубчатой аденомы (исходное увеличение × 400). Обратите внимание на наличие люминальной зазубрины, цитологической дисплазии низкой степени и цитологической эозинофилии
Дисплазия при воспалительном заболевании кишечника
Воспалительное заболевание кишечника (ВЗК) является хорошо известным фактором риска развития дисплазии и карциномы. Диспластические поражения на фоне ВЗК могут быть плоскими (эндоскопически невидимыми) или выпуклыми (51,52), которые классифицируются как неопределенные для дисплазии, дисплазии низкой степени или дисплазии высокой степени.Возвышенные поражения обычно называют поражениями или массами, связанными с дисплазией (DALM), и их трудно или невозможно отличить от спорадических аденом. Однако несколько исследований показали, что аденомоподобные поражения у пациентов с ВЗК, независимо от того, представляют ли они поражение DALM, связанное с ВЗК, или спорадическую аденому, можно адекватно лечить с помощью полипэктомии и постоянного эндоскопического наблюдения, если нет сопутствующей плоской дисплазии (53 -55).
Учитывая значение лечения, рекомендуется, чтобы диагноз дисплазии на фоне ВЗК был подтвержден опытным патологом (56).Неопределенный диагноз дисплазии не должен превращаться в мусорную корзину, и его следует использовать только для случаев, демонстрирующих тревожные цитологические и архитектурные изменения, но также демонстрирующих поверхностное созревание или обильное воспаление. Диагноз также подходит, если поверхность слизистой оболочки не может быть оценена из-за тангенциального разреза ткани, наличия заметного эффекта прижигания или наличия других артефактов обработки.
Синдром Линча
Синдром Линча является наиболее частым наследственным синдромом колоректального рака (57).Он характеризуется повышенным риском рака в течение жизни, в первую очередь желудочно-кишечного и гинекологического трактов, причем наиболее распространены колоректальные и эндометриальные карциномы. Совокупный риск развития колоректального рака в течение жизни оценивается в 66% для мужчин и 43% для женщин (58). У пациентов с синдромом Линча в относительно молодом возрасте развиваются муцинозные, малодифференцированные, недифференцированные или медуллярные карциномы в правой ободочной кишке. Могут быть заметны инфильтрирующие опухоль лимфоциты и перитуморальная лимфоидная реакция типа Крона.
Синдром Линча возникает в результате мутации зародышевой линии в одном из четырех генов восстановления несоответствия ДНК (MMR) ( MLh2, MSh3, MSH6, PMS2 ) и передается по аутосомно-доминантному типу. Почти 90% пациентов имеют мутации в гене MLh2 или MSh3 (57,59). Мутации в генах MSH6 и PMS2 встречаются гораздо реже. Диагноз устанавливается в соответствии с Амстердамскими критериями II () (60) и тестированием MSI в соответствии с пересмотренными рекомендациями Bethesda () (61).Пациенты с опухолью MSI, но без идентифицируемого дефекта зародышевой линии в гене MMR, могут по-прежнему иметь синдром Линча, если исключены другие причины MSI, такие как метилирование промотора MLh2 .
Таблица 1
Амстердамские критерии II для синдрома Линча (60)| Должно быть не менее трех родственников с раком, связанным с синдромом Линча (колоректальный рак, рак эндометрия, тонкой кишки, мочеточника или почечной лоханки. ) |
| Должны быть соблюдены все следующие критерии |
| 1.Один должен быть родственником первой степени родства двух других |
| 2. По крайней мере, два следующих друг за другом поколения должны быть затронуты |
| 3. По крайней мере одно должно быть диагностировано до достижения возраста 50 лет |
| 4. Семейный аденоматозный полипоз должен быть исключен в случае (ах) колоректального рака, если таковой имеется |
| 5. Опухоли должны быть проверены патологическим исследованием |
Таблица 2
Пересмотренное руководство Bethesda по тестированию MSI (61 )| 1.Колоректальный рак диагностирован у пациента младше 50 лет |
| 2. Наличие синхронных, метахронных колоректальных или других опухолей, связанных с синдромом Линча, * независимо от возраста |
| 3. Колоректальный рак с гистология MSI-H **, диагностированная у пациента младше 60 лет |
| 4. Колоректальный рак диагностирован у одного или нескольких родственников первой степени родства с опухолью, связанной с синдромом Линча, с одной из рак, диагностированный в возрасте до 50 лет |
| 5.Колоректальный рак диагностирован у двух или более родственников первой или второй степени родства с опухолями, связанными с синдромом Линча, независимо от возраста |
Семейный аденоматозный полипоз
Семейный аденоматозный полипоз (FAP) является редким аутосомно-доминантным наследственным колоректальным синдромом ( 62,63), характеризующиеся ранним развитием сотен и тысяч аденоматозных полипов в толстой кишке (). Если не лечить, прогрессирование колоректального рака практически неизбежно в среднем в возрасте 35-40 лет (63,64).Эти пациенты также подвержены риску развития аденоматозных полипов в тонкой кишке (65) и полипов фундальных желез в желудке (66). Хотя синдромальные полипы фундальных желез чаще демонстрируют дисплазию низкой степени, чем спорадические аналоги (67–69), вероятность прогрессирования до дисплазии высокой степени или инвазивной карциномы чрезвычайно низка.
Случай семейного аденоматозного полипоза. Обратите внимание на наличие бесчисленных полипов в толстой кишке
Диагностические критерии FAP включают: (I) 100 колоректальных аденоматозных полипов; (II) мутация зародышевой линии гена аденоматозного полипоза coli ( APC ); или (III) семейный анамнез ФАП и любого количества аденом в молодом возрасте (70).Пациенты с ослабленным FAP имеют <100 колоректальных аденоматозных полипов, обычно в среднем около 30. Их пожизненный риск развития колоректального рака снижается примерно до 70%, и у большинства пациентов онкологические заболевания развиваются позже (63,71). Синдром Гарднера - вариант ФАП. У пациентов с этим синдромом также есть эпидермоидные кисты, остеомы, аномалии зубов и десмоидные опухоли. Синдром Тюрко - еще один вариант, который включает опухоли головного мозга, как правило, медуллобластому (70).
Ген-супрессор опухоли APC представляет собой большой ген, который содержит 21 экзон, охватывающий область размером 120 т.п.н. и кодирующий белок из 2843 аминокислот.Большинство мутаций зародышевой линии представляют собой бессмысленные мутации и мутации сдвига рамки считывания и группируются в «горячей точке» в самом большом экзоне 15 (72,73), что приводит к синтезу усеченного белка, что, в свою очередь, приводит к аберрантному накоплению β -катенин и последующая активация комплекса факторов транскрипции β-катенин / Tcf, чтобы способствовать неконтролируемой активации сигнального пути Wnt онкогенеза (74).
Синдром Пейтца-Егерса
Это аутосомно-доминантный наследственный онкологический синдром, характеризующийся гамартоматозными полипами в желудочно-кишечном тракте, пигментными кожно-слизистыми поражениями и повышенным риском желудочно-кишечных и экстрагастроинтестинальных злокачественных новообразований (75).Кумулятивный риск развития колоректального рака в течение жизни приближается к 40% (76). Однако остается под вопросом, являются ли злокачественные новообразования кишечника результатом прямой трансформации гамартоматозных полипов, поскольку дисплазия этих полипов чрезвычайно редка. Пациенты с синдромом Пейтца-Егерса имеют мутации зародышевой линии в гене LKB1 / STK11 (77-79). Гамартоматозные полипы при синдроме Пейтца-Егерса чаще всего встречаются в тонком кишечнике, но также могут возникать в толстой кишке.Они состоят из пролиферативного эпителия, стромы и гладких мышц, расположенных ветвистым узором ().
Полип Пейтца-Йегерса в толстой кишке. Обратите внимание на дольчатый рисунок крипт толстой кишки, разделенных пучками гладких мышц (исходное увеличение × 100)
Синдром ювенильного полипоза
Это также аутосомно-доминантный наследственный онкологический синдром, диагностированный, если: (I) 5 ювенильных полипов в толстой кишке; (II) ювенильные полипы желудочно-кишечного тракта; или (III) любое количество ювенильных полипов и семейный анамнез ювенильного полипоза (80).Подобно синдрому Пейтца-Егерса, совокупный риск развития колоректального рака в течение жизни у пациентов с синдромом ювенильного полипоза также приближается к 40% (80,81). Однако, в отличие от синдрома Пейтца-Егерса, считается, что колоректальный рак у пациентов с синдромом ювенильного полипоза развивается непосредственно в результате неопластической трансформации в ювенильном полипе, поскольку дисплазия является частой находкой в этих полипах. Примерно 50-60% пациентов имеют мутации зародышевой линии в генах SMAD4 или BMPR1A (82).Гистологически ювенильные полипы характеризуются кистозно расширенными криптами с отечной и воспаленной стромой (). Поверхность полипа может быть эродированной, с грануляционной тканью и регенеративными изменениями эпителия.
Ювенильный полип с расширенными криптами и воспаленной стромой (исходное увеличение × 40)
Следует отметить, что синдромальные ювенильные полипы нельзя отличить от спорадических аналогов, и их можно спутать с воспалительными полипами на гистологическом основании. Несмотря на название, ювенильные полипы могут встречаться у взрослых и даже пожилых людей.Пациенты со спорадическими ювенильными полипами не имеют повышенного риска злокачественных новообразований (83).
MUTYH- ассоциированный полипозMUTYH -ассоциированный полипоз (MAP) — это синдром аутосомно-рецессивного полипоза, который несет повышенный риск развития колоректального рака (84,85). Это вызвано двуаллельными мутациями зародышевой линии в гене MUTYH (также известном как ген MYH ), который кодирует фермент эксцизионной репарации оснований (BER), ответственный за предотвращение мутаций после окислительного повреждения ДНК.Наиболее частыми мутациями являются миссенс-варианты Y165C и G382D, на которые приходится> 70% всех мутантных аллелей (86,87). Пациенты с MAP обычно имеют> 10 синхронных колоректальных аденом и могут иметь несколько сотен или даже до 1000 полипов. Однако у большинства пациентов на момент постановки диагноза имеется <100 полипов (88). Следовательно, MAP часто фенотипически неотличим от ослабленного FAP. Однако, в отличие от FAP, мутации гена APC у пациентов с MAP отсутствуют. Кроме того, зазубренные полипы (гиперпластические и зазубренные полипы на животе) часто встречаются у пациентов с MAP (89), что можно спутать с зазубренным полипозом (описанным ниже).Кроме того, из-за своего рецессивного типа наследования, MAP имеет тенденцию пропускать поколения, что затрудняет идентификацию пациентов с MAP, поскольку многие пациенты, по-видимому, представляют собой спорадические случаи.
Зубчатый полипоз
Зубчатый полипоз — это новый термин, используемый ВОЗ, который исторически назывался гиперпластическим полипозом (40). Он определяется: (I) как минимум 5 зубчатыми полипами проксимальнее сигмовидной кишки с 2 или более полипами> 1 см; (II) любое количество зубчатых полипов проксимальнее сигмовидной кишки у человека, у которого есть родственник первой степени родства с зубчатым полипозом; или (III)> 20 зубчатых полипов любого размера по всей толстой кишке.Полипы могут быть как SSA / Ps, так и HP.
Дисплазия высокой степени
Патологическая оценка аденоматозного полипа и дисплазии включает определение наличия или отсутствия дисплазии высокой степени, которая является непосредственным предшественником инвазивной колоректальной аденокарциномы. Дисплазия высокой степени проявляется как сочетание архитектурной сложности и цитологической атипии, которые имеют более злокачественный вид, чем те, которые наблюдаются при обычной аденоме (). С архитектурной точки зрения, области с высоким содержанием обычно демонстрируют повышенную железистую плотность с переполненными железами, имеющими решетчатую структуру или структуру роста спина к спине.Цитологически клетки с дисплазией высокой степени проявляют округлые ядра, грубый хроматин, заметные ядрышки и потерю ядерной полярности, при этом ядра больше не ориентированы перпендикулярно базальной мембране. В просвете диспластических желез можно увидеть некротический мусор.
Дисплазия высокой степени со сложной архитектурой и выраженной ядерной атипией (исходное увеличение × 400)
Дисплазия высокой степени обычно является очаговой и располагается на поверхностной части полипа и, следовательно, не требует дополнительного лечения, кроме полипэктомии, если полип полностью удален эндоскопически.Как обсуждалось ранее, дисплазия толстой кишки высокой степени является синонимом карциномы in situ или интраэпителиальной карциномы. Внутримукозная аденокарцинома, определяемая инвазией собственной пластинки, включая инвазию в (но не через) слизистую оболочку мышечной ткани, по-прежнему относится к категории дисплазии высокой степени из-за ее незначительного потенциала метастазирования и может успешно лечиться только полипэктомией (90).
Злокачественный полип
Термин злокачественный полип используется для описания полипа, который содержит инвазивную аденокарциному в подслизистой оболочке.Предыдущие исследования показали распространенность 2-5% аденом, удаленных эндоскопически (91). При обнаружении злокачественного полипа необходимо оценить несколько критических гистологических характеристик, которые включают состояние края резекции, гистологический класс и наличие или отсутствие лимфоваскулярной инвазии. Эти факторы связаны с риском неблагоприятных исходов, таких как метастазирование в лимфоузлы и / или местный рецидив после полипэктомии. Полипы с отрицательным краем полипэктомии, низкой степенью гистологии и отсутствием лимфоваскулярной инвазии можно безопасно лечить с помощью эндоскопической полипэктомии.Было показано, что повышенный риск неблагоприятных исходов связан с положительной границей (определяемой как <2 мм от глубокого прижженного края) (), гистологией высокой степени (плохо дифференцированной) и лимфоваскулярной инвазией. Если присутствует какая-либо из этих особенностей, показана хирургическая резекция (91-93). Поэтому важно, чтобы образцы для полипэктомии были получены одним целым, чтобы патологоанатомы могли точно оценить края. Невозможность оценить краевой статус из-за частичной резекции также следует рассматривать как фактор риска (91,93), и хирургическая резекция может быть рекомендована клинически здоровым пациентам.
Злокачественный полип, показывающий аденокарциноматозные железы, присутствующие в пределах 1 мм от края полипэктомии (исходное увеличение × 100)
Ловушка при оценке аденоматозного полипа — это псевдоинвазия, при которой аденоматозные элементы смещены или грыжа в такой подслизистой основе, обычно вторично по отношению к такой травматизации как скручивание, так и перекручивание стебля (). Гистологические признаки, которые помогают отличить от истинной инвазии, включают лобулярную конфигурацию грыжевых элементов, отсутствие явной архитектурной и цитологической атипии высокой степени, наличие края воспалительных клеток собственной пластинки вокруг захваченных элементов, отсутствие десмопластической реакции, отсутствие прямого контакта с подслизистой оболочкой. мышечные сосуды и наличие гемосидерина или кровоизлияния.Иногда грыжи аденоматозных желез имеют высокую гистологию, которую еще труднее отличить от инвазивной аденокарциномы. Однако другие гистологические признаки, способствующие псевдоинвазии, могут все еще присутствовать. В редких случаях, когда невозможно провести однозначное различие, может быть рассмотрена полная полипэктомия или хирургическая резекция в зависимости от клинических и эндоскопических условий пациента.
Низкое увеличение (A. исходное увеличение × 40) и высокое увеличение (B.исходное увеличение × 200) виды псевдоинвазии в трубчатую аденому. Обратите внимание на наличие кровоизлияния и гемосидерина.
Патогенез и молекулярная классификация
Колоректальный рак представляет собой гетерогенную группу заболеваний с характерным генетическим и эпигенетическим фоном (94). Чтобы улучшить клиническое ведение и лучше предсказать исход болезни, были предприняты попытки классифицировать колоректальный рак на основе локализации, гистологии, этиологических факторов и молекулярных механизмов онкогенеза.Еще в 1980-х годах было признано, что рак, возникающий в проксимальных и дистальных отделах толстой кишки, связан с различными генетическими механизмами (95,96). Например, синдром Линча преимущественно поражает проксимальный отдел ободочной кишки, тогда как при FAP больше полипов наблюдается в левой ободочной кишке. Эти семейные формы колоректального рака послужили прототипами для понимания различных молекулярных механизмов онкогенеза. Как обсуждалось ранее, синдром Линча возникает в результате потери функции одного из генов MMR и следует пути MSI («мутаторный» путь).Напротив, FAP возникает у пациентов с наследственными мутациями в гене APC , который был центром исходной модели Fearon-Vogelstein колоректального туморогенеза (97), которая составляет основу пути хромосомной нестабильности (CIN) («супрессор»). путь).
Пути MSI и CIN описывают патогенез колоректального рака, основанный на генетических аномалиях, которые приводят к потере функции генов-супрессоров опухоли и / или усилению функции онкогенов. В последнее десятилетие эпигенетическая нестабильность привлекла значительное внимание и теперь считается, что она участвует в патогенезе почти одной трети случаев колоректального рака (49).Помимо последовательности и структуры ДНК, экспрессия генов контролируется рядом эпигенетических модификаций, которые включают метилирование ДНК, изменения гистонов и ремоделирование хроматина (98). Одной из наиболее охарактеризованных эпигенетических модификаций, связанных с колоректальным онкогенезом, является подавление генов (генов супрессоров опухолей и / или генов MMR) посредством гиперметилирования их промоторных областей. Хотя обсуждался вопрос о том, представляет ли феномен эпигенетической нестабильности адаптивный клеточный механизм во время канцерогенеза, направленный на прекращение клеточной пролиферации, вторичное изменение еще не идентифицированных генетических мутаций, явление, которое, как ожидается, произойдет во время старения опухолевых клеток, или просто артефакт (99-104 ), подавление транскрипции определенных генов за счет гиперметилирования, несомненно, приводит к развитию опухоли (105-110).В частности, гиперметилирование промотора MLh2 , одного из генов MMR, продемонстрировано в большинстве спорадических колоректальных опухолей с фенотипом MSI (108,111,112). Поскольку многие гены богаты цитозиновыми и гуаниновыми динуклеотидами (CpG-островки) в своих промоторах, метилирование остатков цитозина в CpG-островках является обычным явлением, которое приводит к изменениям хромосомной структуры и подавлению экспрессии генов. Колоректальный рак с фенотипом метилирования островков CpG (CIMP) характеризуется эпигенетической потерей функции генов-супрессоров опухолей без мутаций (49,113).
обобщает текущее понимание молекулярных путей, участвующих в колоректальном онкогенезе. Путь CIN участвует как в спорадическом, так и в синдромальном колоректальном раке. Опухоли CIN характеризуются кариотипическими аномалиями и хромосомными прибавками и потерями, которые можно оценить с помощью анализа плоидности ДНК или потери гетерозиготности (LOH). Эти опухоли почти всегда содержат мутации APC , часто обнаруживают мутации KRAS и p53 и часто имеют аллельную потерю 18q (3,94).Путь MSI также вовлечен как в спорадический, так и в синдромный колоректальный рак и имеет тенденцию быть взаимоисключающим с CIN. Как обсуждалось ранее, опухоли MSI характеризуются потерей функции восстановления несоответствия ДНК. При спорадическом колоректальном раке потеря функции в первую очередь связана с метилированием промотора гена MLh2 , что приводит к эпигенетическому ингибированию экспрессии белка MLh2 и его партнера по связыванию PMS2. Эти опухоли часто обнаруживают мутацию BRAF , но лишь в редких случаях мутации KRAS .При синдроме Линча потеря функции обычно является результатом мутаций зародышевой линии в одном из генов MMR. Эти опухоли никогда не содержат мутаций BRAF . Наконец, путь CIMP представляет собой уникальный молекулярный механизм в колоректальном онкогенезе, который может возникать как в опухолях MSI-H, так и в опухолях MSS.
Молекулярные пути в колоректальном онкогенезе. CRC, колоректальный рак; MSS, микроспутник стабильный; MSI-H, микроспутниковая нестабильность высокого уровня; FAP, семейный аденоматозный полипоз; AFAP, ослабленный FAP; PJS, синдром Пейтца-Егерса; JPS, синдром ювенильного полипоза; MAP, MUTYH-ассоциированный полипоз; CIN, путь хромосомной нестабильности; MSI, микроспутниковая нестабильность; CIMP, фенотип метилатора CpG-островков; ?, пути пока не определены
Молекулярно-генетическое тестирование
С быстрым прогрессом в понимании колоректального туморогенеза и фармакогенетики, требуется все больше и больше молекулярных и генетических тестов, чтобы оптимально разработать индивидуальную терапию для отдельных пациентов, чтобы лучше предсказать прогноз пациента, и более точно определить необходимость семейного консультирования.В настоящее время MSI, KRAS и BRAF являются наиболее часто используемыми тестами в лабораториях патологии.
MSI testing
Как обсуждалось ранее, опухоли MSI составляют ~ 15% колоректальных аденокарцином. Эти опухоли, как правило, демонстрируют уникальные клинико-патологические особенности, имеют тенденцию иметь лучший прогноз со скорректированной стадией по сравнению с опухолями MSS и, по-видимому, устойчивы к лечению 5-фторурацилом (114).
Микросателлиты — это повторяющиеся последовательности ДНК, которые подвержены ошибкам во время репликации ДНК, если система MMR неисправна.MSI определяется как изменение длины микросателлитных последовательностей. Его обычно оценивают путем анализа двух мононуклеотидных повторов (BAT-25 и BAT-26) и трех динуклеотидных повторов (D2S123, D5S346 и D17S250), известных как панель Bethesda (61, 115), путем сравнения образцов ДНК, извлеченных из нормальных и опухолевых клеток. ткани того же пациента. Тест основан на полимеразной цепной реакции (ПЦР) и может проводиться на фиксированных формалином тканях, залитых парафином. Опухоль обозначается как MSI-H, если два или более (> 40%) из пяти микросателлитных маркеров показывают нестабильность, MSI-L (низкий уровень), если только один маркер показывает нестабильность, или MSS, если ни один из маркеров не показывает нестабильность.Клиническое значение MSI-L остается неясным и противоречивым (116), и может быть полезно, если будут протестированы дополнительные микросателлитные маркеры, чтобы повысить точность классификации MSI.
Непрямой анализ статуса MSI может быть выполнен с помощью иммуногистохимического окрашивания белков MMR. Эти белки повсеместно присутствуют в нормальных клетках, но обнаруживают потерю экспрессии в опухолевых клетках MSI. Можно наблюдать несколько паттернов окрашивания на основе лежащих в основе генетических или эпигенетических аномалий ().Интересно отметить, что потеря экспрессии белка MLh2 всегда сопровождается потерей его партнера по связыванию PMS2 (), но потеря экспрессии PMS2 может происходить сама по себе. То же самое верно для MSh3 и его партнера по связыванию MSH6.
Таблица 3
Иммуногистохимические образцы окрашивания и интерпретация для белков MMR
| MLh2 | MSh3 | MSH6 | PMS2 | Интерпретация + | + | Неповрежденный MMR * | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| — | + | + | — | MLh2 зародышевые мутации или гиперметилирование | + | Мутация зародышевой линии MSH3 | |||||||||
| + | + | — | + | MSH6 мутация зародышевой линии | Мутация зародышевой линии PMS2 |
A MSI tumo r показывает потерю экспрессии белков MLh2 (A) и PMS2 (D) и нормальную экспрессию MSh3 (B) и MSH6 (C).Обратите внимание на наличие положительного окрашивания в доброкачественных криптах толстой кишки и воспалительных клетках, которые служат хорошим внутренним контролем для окрашивания (исходное увеличение × 200)
Чувствительность теста MSI на основе ПЦР с использованием панели Bethesda колеблется от 55% до 84%. для обнаружения мутаций в разных генах MMR. Чувствительность повышается, если используются три или более маркера мононуклеотидных повторов. Специфичность теста MSI составляет 90%. Иммуногистохимия была признана надежной заменой MSI с уровнем соответствия> 90%.Он также предоставляет дополнительную информацию о тесте MSI на основе ПЦР, поскольку позволяет анализировать ген-специфическую последовательность ДНК на основе образца окрашивания. Однако иммуногистохимия может пропустить редкие случаи MSI, вызванные мутациями зародышевой линии другими генами, и не отличить мутацию зародышевой линии от эпигенетических изменений при обнаружении потери экспрессии белка MLh2. Таким образом, самой последней рекомендацией является выполнение как теста MSI на основе ПЦР, так и иммуногистохимии, чтобы свести к минимуму вероятность пропуска диагноза синдрома Линча (117).Также в последнее время рекомендуется тестировать все впервые диагностированные колоректальные опухоли независимо от возраста пациента и семейного анамнеза, поскольку около 25% пациентов с синдромом Линча не соответствуют критериям Амстердама II или рекомендациям Bethesda (117). В этих условиях можно выполнить только один тест, иммуногистохимический или MSI-анализ, поскольку стоимость тестов станет проблемой.
Тестирование KRAS
Мутации в гене KRAS (гомолог вирусного онкогена саркомы крысы Кирстен) приводят к экспрессии конститутивно активированного белка KRAS, который обнаруживается примерно в 40% случаев колоректального рака (2118).Мутант KRAS , являющийся критически важной молекулой в сигнальном пути рецептора эпидермального фактора роста (EGFR), делает опухоли устойчивыми к терапии, направленной на EGFR (2,119-121). В результате Американское общество клинической онкологии (ASCO) и Национальная комплексная сеть рака (NCCN) рекомендовали анализ мутаций гена KRAS пациентам-кандидатам, которые будут получать терапию против EGFR (122, 123).
Более 95% мутаций KRAS встречаются в кодонах 12 и 13 экзона 2 (118,124,125), и, таким образом, основанные на ПЦР методологии, разработанные для обнаружения мутаций KRAS , предназначены в первую очередь для этих мутаций.Мутации также могут происходить в других локусах, таких как кодоны 61 и 146 (126), но они, как правило, не подвергаются скринингу из-за редкости. Клинически доступные методы ПЦР в реальном времени включают анализ аллель-специфической амплификации и анализ кривой плавления после ПЦР. Метод аллель-специфической ПЦР в реальном времени обнаруживает семь наиболее распространенных мутаций в кодонах 12 и 13 (127), тогда как анализ кривой плавления обнаруживает все возможные мутации в этих двух кодонах (128,129).
Другой метод обнаружения — это секвенирование ДНК, которое может обнаруживать все возможные мутации в гене KRAS , не ограничиваясь только кодонами 12 и 13.По сравнению с традиционным методом секвенирования по Сэнгеру технология пиросеквенирования предлагает более высокую аналитическую чувствительность и более выгодна для анализа образцов ДНК, выделенных из блоков ткани, залитых парафином (130, 131).
Тестирование BRAF
Помимо KRAS , мутации в других членах сигнального пути EGFR также могут вызывать устойчивость к терапии против EGFR. Хорошим примером является мутация гена BRAF (гомолог B1 вирусного онкогена мышиной саркомы v-raf), о которой сообщалось примерно в 10% случаев колоректального рака (132–134).Есть несколько интересных фактов о мутации BRAF при колоректальном раке. Во-первых, активирующие мутации BRAF и KRAS почти всегда являются взаимоисключающими (135, 136), и, таким образом, тестирование мутации гена BRAF следует рассматривать после отрицательного анализа мутации KRAS . Фактически, многие лаборатории предлагают тест reflex BRAF , если в образце не обнаружена мутация KRAS . Во-вторых, почти все мутации BRAF идентичны точечной мутации V600E (134), которую можно легко обнаружить с помощью ряда коммерчески доступных анализов на основе ПЦР (137).В-третьих, мутация BRAF почти исключительно наблюдается в спорадических опухолях MSI, которые, как предполагается, развиваются по зубчатому канцерогенному пути, но никогда не наблюдались при синдроме Линча (138). Более конкретно, активирующая мутация гена BRAF связана с высоким уровнем глобального метилирования ДНК и эпигенетическим подавлением гена MLh2, обнаруживаемым в 70-90% спорадических колоректальных опухолей с микросателлитным нестабильным фенотипом (136, 139). Следовательно, дальнейшее тестирование мутации BRAF в опухоли MSI поможет прояснить спорадическую или синдромальную природу опухоли (140).В-четвертых, влияние мутации BRAF на прогноз оказывается зависимым от MSI. Как и ожидалось, опухоли BRAF MSI-H дикого типа имеют лучший прогноз, тогда как опухоли MSS с мутацией BRAF связаны с наихудшим исходом. Опухоль BRAF с мутацией MSI-H и опухоль BRAF MSS дикого типа являются промежуточными с точки зрения прогноза (132 133). Таким образом, тестирование на аномалии MMR и мутации BRAF дает дополнительную прогностическую информацию.
Выводы
Колоректальная аденокарцинома — это гетерогенное заболевание, которое включает несколько канцерогенных путей. Патологический анализ предоставляет гистологическую и молекулярную информацию, важную для соответствующего лечения пациента, оценки прогноза и семейного консультирования. Дальнейшее понимание молекулярных механизмов онкогенеза, безусловно, приведет к разработке новых целевых методов лечения и новых молекулярных тестов, которые в конечном итоге принесут пользу пациентам и их семьям.
Благодарности
Раскрытие информации: Авторы заявляют об отсутствии конфликта интересов.
Ссылки
1. Siegel R, Ward E, Brawley O, et al. Статистика рака, 2011 г .: влияние устранения социально-экономических и расовых различий на преждевременную смерть от рака. CA Cancer J Clin 2011; 61: 212-36 [PubMed] [Google Scholar] 2. Ван Х.Л., Лопатеги Дж., Амин М.Б. и др. Тестирование мутации KRAS при раке человека: роль патолога в эпоху персонализированной медицины. Adv Anat Pathol 2010; 17: 23-32 [PubMed] [Google Scholar] 3.Гамильтон С.Р., Босман Ф.Т., Боффетта П. и др. Рак толстой и прямой кишки. В: Классификация опухолей пищеварительной системы ВОЗ. Bosman FT, Carneiro F, Hruban RH, Theise ND, ред. Лион: IARC Press, 2010: 134-46. [Google Scholar] 4. Комптон С.С., Филдинг Л.П., Бургарт Л.Дж. и др. Факторы прогноза при колоректальном раке. Консенсусное заявление Колледжа американских патологов 1999 г. Arch Pathol Lab Med 2000; 124: 979-94 [PubMed] [Google Scholar] 5. Compton CC. Обновленный протокол исследования образцов от пациентов с карциномами толстой и прямой кишки, за исключением карциноидных опухолей, лимфом, сарком и опухолей червеобразного отростка: основа для контрольных списков.Онкологический комитет. Arch Pathol Lab Med 2000; 124: 1016-25 [PubMed] [Google Scholar] 7. Джасс Дж. Р., Аткин В. С., Кузик Дж. И др. Классификация рака прямой кишки: исторические перспективы и многомерный анализ 447 случаев. Гистопатология 1986; 10: 437-59 [PubMed] [Google Scholar] 8. Compton CC. Отчет о патологии при раке толстой кишки: что прогностически важно? Dig Dis 1999; 17: 67-79 [PubMed] [Google Scholar] 9. Эдж С.Б., Берд Д.Р., Комптон С.С. и др. Справочник по стадированию рака AJCC, 7-е издание. Нью-Йорк: Springer, 2010: 173-206.[Google Scholar] 10. Ферхюльст Дж., Фердинанда Л., Деметтер П. и др. Муцинозный подтип как прогностический фактор колоректального рака: систематический обзор и метаанализ. J Clin Pathol 2012; 65: 381-8 [PubMed] [Google Scholar] 11. Канг Х., О’Коннелл Дж. Б., Маггард М.А. и др. 10-летняя оценка результатов муцинозной и перстневидноклеточной карциномы толстой и прямой кишки. Dis Colon Rectum 2005; 48: 1161-8 [PubMed] [Google Scholar] 12. Леопольдо С., Лорена Б., Чинция А. и др. Два подтипа муцинозной аденокарциномы толстой кишки: клинико-патологические и генетические особенности.Энн Сург Онкол 2008; 15: 1429-39 [PubMed] [Google Scholar] 13. Chen JS, Hsieh PS, Chiang JM, et al. Клинические исходы карциномы перстневых клеток и муцинозной аденокарциномы толстой кишки. Chang Gung Med J 2010; 33: 51-7 [PubMed] [Google Scholar] 14. Макино Т., Цудзинака Т., Мисима Х. и др. Первичная клеточная карцинома толстой и прямой кишки: отчет о восьми случаях и обзор 154 случаев в Японии. Гепатогастроэнтерология 2006; 53: 845-9 [PubMed] [Google Scholar] 15. Тирунавукарасу П., Сатаиа М., Сингла С. и др.Медуллярный рак толстой кишки: популяционный анализ. Int J Oncol 2010; 37: 901-7 [Бесплатная статья PMC] [PubMed] [Google Scholar] 16. Хинои Т., Тани М., Лукас П.С. и др. Потеря экспрессии CDX2 и микросателлитная нестабильность являются характерными чертами крупноклеточных минимально дифференцированных карцином толстой кишки. Am J Pathol 2001; 159: 2239-48 [Бесплатная статья PMC] [PubMed] [Google Scholar] 17. Александр Дж., Ватанабе Т., Ву Т.Т. и др. Гистопатологическая идентификация рака толстой кишки с микросателлитной нестабильностью.Am J Pathol 2001; 158: 527-35 [Бесплатная статья PMC] [PubMed] [Google Scholar] 18. Чу П.Г., Вайс Л.М. Экспрессия кератина в тканях и новообразованиях человека. Гистопатология 2002; 40: 403-39 [PubMed] [Google Scholar] 19. МакГрегор Д.К., Ву Т.Т., Рашид А. и др. Снижение экспрессии цитокератина 20 при колоректальных карциномах с высоким уровнем микросателлитной нестабильности. Am J Surg Pathol 2004; 28: 712-8 [PubMed] [Google Scholar] 20. Верлинг Р.В., Язиджи Х., Бакки С.Е. и др. CDX2, высокочувствительный и специфический маркер аденокарцином кишечного происхождения: иммуногистохимическое исследование 476 первичных и метастатических карцином.Am J Surg Pathol 2003; 27: 303-10 [PubMed] [Google Scholar] 21. Каймакчиев В., Терраччиано Л., Торнилло Л. и др. Гомеобоксный фактор кишечной дифференциации CDX2 избирательно экспрессируется в аденокарциномах желудочно-кишечного тракта. Mod Pathol 2004; 17: 1392-9 [PubMed] [Google Scholar] 22. Шеперд Н.А., Бакстер К.Дж., Лав С.Б. Прогностическое значение вовлечения брюшины в рак толстой кишки: проспективная оценка. Гастроэнтерология 1997; 112: 1096-102 [PubMed] [Google Scholar] 24. Нельсон Х., Петрелли Н., Карлин А. и др.Рекомендации 2000 г. по хирургии рака прямой и толстой кишки. J Natl Cancer Inst 2001; 93: 583-96 [PubMed] [Google Scholar] 25. Ван Х., Сафар Б., Векснер С.Д. и др. Клиническое значение удаления жировых лимфатических узлов при инвазивной аденокарциноме прямой кишки после неоадъювантной терапии. Dis Colon Rectum 2009; 52: 1767-73 [PubMed] [Google Scholar] 26. Эрнанц Ф., Гарсия-Сомакаррера Э., Фернандес Ф. Оценка лимфатических узлов, пропущенных в брыжеечной ткани после стандартного вскрытия образцов колоректального рака.Colorectal Dis 2010; 12: e57-e60 [PubMed] [Google Scholar] 27. Märkl B, Kerwel TG, Jähnig HG и др. Диссекция лимфатических узлов с применением метиленового синего в образцах толстой кишки: проспективное рандомизированное исследование. Am J Clin Pathol 2008; 130: 913-9 [PubMed] [Google Scholar] 28. Кервел Т.Г., Спатц Дж., Антхубер М. и др. Введение метиленового синего в нижнюю брыжеечную артерию обеспечивает адекватный забор лимфатических узлов и устраняет патологическую вариабельность узловой стадии рака прямой кишки. Dis Colon Rectum 2009; 52: 935-41 [PubMed] [Google Scholar] 29.Fan L, Levy M, Aguilar CE и др. Извлечение лимфатических узлов из образцов колоректальной резекции аденокарциномы: стоит ли прилагать дополнительные усилия, чтобы найти как минимум 12 узлов? Colorectal Dis 2011; 13: 1377-83 [PubMed] [Google Scholar] 30. Шен С.С., Haupt BX, Ro JY и др. Количество исследованных лимфатических узлов и связанные с ними клинико-патологические факторы колоректальной карциномы. Arch Pathol Lab Med 2009; 133: 781-6 [PubMed] [Google Scholar] 31. Моркос Б., Бейкер Б., Аль Масри М. и др. Выход лимфатических узлов в хирургии рака прямой кишки: эффект предоперационной химиолучевой терапии.Eur J Surg Oncol 2010; 36: 345-9 [PubMed] [Google Scholar] 32. Marks JH, Valsdottir EB, Rather AA и др. После высокодозной химиолучевой терапии рака прямой кишки в хирургическом образце можно ожидать менее 12 лимфатических узлов. Dis Colon Rectum 2010; 53: 1023-9 [PubMed] [Google Scholar] 33. Lo DS, Pollett A, Siu LL, et al. Прогностическое значение узелков брыжеечной опухоли у пациентов с колоректальным раком III стадии. Рак 2008; 112: 50-4 [PubMed] [Google Scholar] 34. Puppa G, Maisonneuve P, Sonzogni A и др.Патологическая оценка периколонических опухолевых отложений при распространенной карциноме толстой кишки: актуальность для прогноза и стадии опухоли. Mod Pathol 2007; 20: 843-55 [PubMed] [Google Scholar] 35. Winawer SJ, Zauber AG, Ho MN, et al. Профилактика колоректального рака с помощью колоноскопической полипэктомии: Национальная рабочая группа по изучению полипов. N Engl J Med 1993; 329: 1977-81 [PubMed] [Google Scholar] 36. Заубер А.Г., Винавер С.Дж., О’Брайен М.Дж. и др. Колоноскопическая полипэктомия и долгосрочное предотвращение смерти от колоректального рака. N Engl J Med 2012; 366: 687-96 [Бесплатная статья PMC] [PubMed] [Google Scholar] 37.Кинзлер К.В., Фогельштейн Б. Уроки наследственного колоректального рака. Cell 1996; 87: 159-70 [PubMed] [Google Scholar] 39. Heitman SJ, Ronksley PE, Hilsden RJ, et al. Распространенность аденом и колоректального рака у лиц среднего риска: систематический обзор и метаанализ. Clin Gastroenterol Hepatol 2009; 7: 1272-8 [PubMed] [Google Scholar] 40. Сновер, округ Колумбия, Анен Д. Д., Берт Р. В. и др. Зубчатые полипы толстой и прямой кишки и зубчатые полипы. В: Классификация опухолей пищеварительной системы ВОЗ.Bosman FT, Carneiro F, Hruban RH, Theise ND, ред. Лион: IARC Press, 2010: 160-5. [Google Scholar] 41. Цай CJ, Лу ДК. Малые колоректальные полипы: гистопатология и клиническое значение. Am J Gastroenterol 1995; 90: 988-94 [PubMed] [Google Scholar] 42. Сновер Д.К., Ясс Дж. Р., Феноглио-Прейзер С. и др. Зазубренные полипы толстой кишки: морфологический и молекулярный обзор развивающейся концепции. Am J Clin Pathol 2005; 124: 380-91 [PubMed] [Google Scholar] 43. Торлакович Э., Сковлунд Э., Сновер Д.К. и др. Морфологическая переоценка зубчатых колоректальных полипов.Am J Surg Pathol 2003; 27: 65-81 [PubMed] [Google Scholar] 44. Гольдштейн Н.С., Бханот П., Одиш Э. и др. Гиперпластические полипы толстой кишки, предшествовавшие микросателлитно-нестабильным аденокарциномам. Am J Clin Pathol 2003; 119: 778-96 [PubMed] [Google Scholar] 45. East JE, Saunders BP, Jass JR. Спорадические и синдромальные гиперпластические полипы и зубчатые аденомы толстой кишки: классификация, молекулярная генетика, естественное течение и клиническое ведение. Gastroenterol Clin North Am 2008; 37: 25-46 [PubMed] [Google Scholar] 46.Глатц К., Притт Б., Глатц Д. и др. Многонациональная интернет-оценка вариабельности наблюдателя при диагностике зубчатых колоректальных полипов. Am J Clin Pathol 2007; 127: 938-45 [PubMed] [Google Scholar] 47. Фаррис А.Б., Мисдраджи Дж., Шривастава А. и др. Сессильная зубчатая аденома: проблема отличия от других зубчатых полипов толстой кишки. Am J Surg Pathol 2008; 32: 30-5 [PubMed] [Google Scholar] 48. Вонг Н.А., Хант Л.П., Novelli MR и др. Согласие наблюдателя в диагностике зубчатых полипов толстой кишки.Гистопатология 2009; 55: 63-6 [PubMed] [Google Scholar] 49. Сновер, округ Колумбия. Обновленная информация о зубчатом пути к колоректальной карциноме. Hum Pathol 2011; 42: 1-10 [PubMed] [Google Scholar] 50. Vu HT, Lopez R, Bennett A, et al. Люди с зубчатыми полипами на сидячем месте проявляют агрессивный колоректальный фенотип. Dis Colon Rectum 2011; 54: 1216-23 [PubMed] [Google Scholar] 51. Blackstone MO, Riddell RH, Rogers BH и др. Поражение или образование, связанное с дисплазией (DALM), обнаруженное с помощью колоноскопии при длительном язвенном колите: показание к колэктомии.Гастроэнтерология 1981; 80: 366-74 [PubMed] [Google Scholar] 52. Батт Дж. Х., Кониси Ф., Морсон BC и др. Макроскопические поражения при дисплазии и карциноме, осложняющие язвенный колит. Dig Dis Sci 1983; 28: 18-26 [PubMed] [Google Scholar] 53. Рубин PH, Фридман С., Харпаз Н. и др. Колоноскопическая полипэктомия при хроническом колите: консервативное лечение после эндоскопической резекции диспластических полипов. Гастроэнтерология 1999; 117: 1295-300 [PubMed] [Google Scholar] 54. Engelsgjerd M, Farraye FA, Odze RD. Полипэктомия может быть адекватным лечением аденомоподобных диспластических поражений при хроническом язвенном колите.Гастроэнтерология 1999; 117: 1288-94 [PubMed] [Google Scholar] 55. Odze RD, Farraye FA, Hecht JL, et al. Долгосрочное наблюдение после лечения полипэктомии по поводу аденомоподобных диспластических поражений при язвенном колите. Clin Gastroenterol Hepatol 2004; 2: 534-41 [PubMed] [Google Scholar] 56. Ицковиц Ш., Присутствует DH. Консенсусная конференция: скрининг колоректального рака и наблюдение за воспалительными заболеваниями кишечника. Воспаление кишечника 2005; 11: 314-21 [PubMed] [Google Scholar] 57. Линч Х.Т., де ла Шапель А. Наследственный колоректальный рак.N Engl J Med 2003; 348: 919-32 [PubMed] [Google Scholar] 58. Стоффель Э., Мукерджи Б., Раймонд В.М. и др. Расчет риска колоректального рака и рака эндометрия у пациентов с синдромом Линча. Гастроэнтерология 2009; 137: 1621-7 [Бесплатная статья PMC] [PubMed] [Google Scholar] 59. Хампель Х., Франкель В.Л., Мартин Э. и др. Скрининг на синдром Линча (наследственный неполипозный колоректальный рак). N Engl J Med 2005; 352: 1851-60 [PubMed] [Google Scholar] 60. Vasen HF, Watson P, Mecklin JP и др. Новые клинические критерии наследственного неполипозного колоректального рака (HNPCC, синдром Линча), предложенные Международной совместной группой по HNPCC.Гастроэнтерология 1999; 116: 1453-6 [PubMed] [Google Scholar] 61. Умар А., Боланд ЧР, Тердиман Дж. П. и др. Пересмотренные рекомендации Bethesda по наследственному неполипозному колоректальному раку (синдром Линча) и микросателлитной нестабильности. J Natl Cancer Inst 2004; 96: 261-8 [Бесплатная статья PMC] [PubMed] [Google Scholar] 62. Бьорк Дж., Акербрант Х., Иселиус Л. и др. Эпидемиология семейного аденоматозного полипоза в Швеции: изменения во времени и различия в фенотипе между мужчинами и женщинами. Сканд Дж. Гастроэнтерол 1999; 34: 1230-5 [PubMed] [Google Scholar] 64.Галиатсатос П., Фоулкс В.Д. Семейный аденоматозный полипоз. Am J Gastroenterol 2006; 101: 385-98 [PubMed] [Google Scholar] 66. Берт RW. Полипы фундальной железы желудка. Гастроэнтерология 2003; 125: 1462-9 [PubMed] [Google Scholar] 67. Bianchi LK, Burke CA, Bennett AE и др. Дисплазия полипа фундальной железы часто встречается при семейном аденоматозном полипозе. Clin Gastroenterol Hepatol 2008; 6: 180-5 [PubMed] [Google Scholar] 68. Ву Т.Т., Корнацкий С., Рашид А. и др. Дисплазия и нарушение регуляции пролиферации фовеолярного и поверхностного эпителия полипов фундальных желез у пациентов с семейным аденоматозным полипозом.Am J Surg Pathol 1998; 22: 293-8 [PubMed] [Google Scholar] 69. Hassan A, Yerian LM, Kuan SF, et al. Иммуногистохимическая оценка экспрессии аденоматозного полипоза кишечной палочки, бета-катенина, c-Myc, циклина D1, p53 и белка ретинобластомы в синдромальных и спорадических полипах фундальной железы. Hum Pathol 2004; 35: 328-34 [PubMed] [Google Scholar] 70. Giardiello FM, Burt RW, Jävinen HJ, et al. Семейный аденоматозный полипоз. В: Классификация опухолей пищеварительной системы ВОЗ. Bosman FT, Carneiro F, Hruban RH, Theise ND, ред.Лион: IARC Press, 2010: 147-51. [Google Scholar] 71. Берт Р.В., Лепперт М.Ф., Слэттери М.Л. и др. Генетическое тестирование и фенотип в большом родстве с ослабленным семейным аденоматозным полипозом. Гастроэнтерология 2004; 127: 444-51 [PubMed] [Google Scholar] 72. Laurent-Puig P, Béroud C, Soussi T.APC gene: база данных зародышевых и соматических мутаций в опухолях и клеточных линиях человека. Nucleic Acids Res 1998; 26: 269-70 [Бесплатная статья PMC] [PubMed] [Google Scholar] 73. Миёси Й., Андо Х., Нагасе Х. и др. Зародышевые мутации гена APC у 53 больных семейным аденоматозным полипозом.Proc Natl Acad Sci USA 1992; 89: 4452-6 [Бесплатная статья PMC] [PubMed] [Google Scholar] 74. Аоки К., Такето ММ. Аденоматозный полипоз кишечной палочки (APC): многофункциональный ген-супрессор опухоли. J Cell Sci 2007; 120: 3327-35 [PubMed] [Google Scholar] 75. Копачова М., Тачечи И., Рейхрт С. и др. Синдром Пейтца-Егерса: диагностический и терапевтический подход. World J Gastroenterol 2009; 15: 5397-408 [Бесплатная статья PMC] [PubMed] [Google Scholar] 76. ван Лиер М.Г., Вагнер А., Матус-Флиген Е.М. и др. Высокий риск рака при синдроме Пейтца-Егерса: систематический обзор и рекомендации по надзору.Am J Gastroenterol 2010; 105: 1258-64 [PubMed] [Google Scholar] 77. Хемминки А., Марки Д., Томлинсон И. и др. Ген серин / треонинкиназы, дефектный при синдроме Пейтца-Егерса. Nature 1998; 391: 184-7 [PubMed] [Google Scholar] 78. Jenne DE, Reimann H, Nezu J и др. Синдром Пейтца-Егерса вызван мутациями в новой сериновой треонинкиназе. Нат Генет 1998; 18: 38-43 [PubMed] [Google Scholar] 79. Каруман П., Гозани О., Одзе Р.Д. и др. Продукт гена Пейтца-Егера LKB1 является медиатором р53-зависимой гибели клеток.Mol Cell 2001; 7: 1307-19 [PubMed] [Google Scholar] 82. ван Хаттем В.А., Бросенс Л.А., де Ленг В.В. и др. Большие геномные делеции SMAD4, BMPR1A и PTEN при ювенильном полипозе. Gut 2008; 57: 623-7 [PubMed] [Google Scholar] 83. Наджент К.П., Талбот И.К., Ходжсон С.В. и др. Одиночные ювенильные полипы: не показатель последующего злокачественного новообразования. Гастроэнтерология 1993; 105: 698-700 [PubMed] [Google Scholar] 84. Аль-Тассан Н., Чмиэль Н.Х., Мейнард Дж. И др. Унаследованные варианты MYH, связанные с соматическими мутациями G : C → T : A в колоректальных опухолях.Нат Генет 2002; 30: 227-32 [PubMed] [Google Scholar] 85. Фаррингтон С.М., Тенеса А., Барнетсон Р. и др. Восприимчивость зародышевой линии к колоректальному раку из-за дефектов гена эксцизионной репарации основания. Am J Hum Genet 2005; 77: 112-9 [Бесплатная статья PMC] [PubMed] [Google Scholar] 86. Липтон Л., Томлинсон И. Фенотип множественной колоректальной аденомы и MYH: основной ген эксцизионной репарации. Clin Gastroenterol Hepatol 2004; 2: 633-8 [PubMed] [Google Scholar] 87. Чидл Дж. П., Сэмпсон-младший. MUTYH-ассоциированный полипоз: от дефекта эксцизионной репарации основания до клинического генетического тестирования.Восстановление ДНК (Amst) 2007; 6: 274-9 [PubMed] [Google Scholar] 88. Сэмпсон-младший, Джонс Н. MUTYH-ассоциированный полипоз. Лучшая практика Res Clin Gastroenterol 2009; 23: 209-18 [PubMed] [Google Scholar] 89. Бопараи К.С., Деккер Э., Ван Иден С. и др. Гиперпластические полипы и зубчатые аденомы сидячей кости как фенотипическое проявление MYH-ассоциированного полипоза. Гастроэнтерология 2008; 135: 2014-8 [PubMed] [Google Scholar] 90. Левин М.Р., Фентон Х., Буркарт А.Л. и др. Плохо дифференцированная колоректальная карцинома с инвазией, ограниченной собственной пластинкой (внутрислизистая карцинома): последующее исследование 15 случаев.Am J Surg Pathol 2007; 31: 1882-6 [PubMed] [Google Scholar] 92. Купер Х.С. Патологические проблемы лечения эндоскопически удаленных злокачественных колоректальных полипов. J Natl Compr Canc Netw 2007; 5: 991-6 [PubMed] [Google Scholar] 93. Батт Дж. М., Тан П., Гонен М. и др. Частота резидуальной болезни после полной эндоскопической резекции злокачественного полипа толстой кишки. Dis Colon Rectum 2012; 55: 122-7 [PubMed] [Google Scholar] 95. Bufill JA. Колоректальный рак: данные о различных генетических категориях, основанных на проксимальном или дистальном расположении опухоли.Энн Интерн Мед 1990; 113: 779-88 [PubMed] [Google Scholar] 96. Беарт Р.У., Мелтон Л.Дж., III, Марута М. и др. Тенденции развития рака правой и левой толстой кишки. Dis Colon Rectum 1983; 26: 393-8 [PubMed] [Google Scholar] 97. Фирон ER, Фогельштейн Б. Генетическая модель колоректального туморогенеза. Cell 1990; 61: 759-67 [PubMed] [Google Scholar] 98. Портела А., Эстеллер М. Эпигенетические модификации и болезни человека. Nat Biotechnol 2010; 28: 1057-68 [PubMed] [Google Scholar] 99. Ямасита К., Дай Т., Дай Й и др. Генетика заменяет эпигенетику фенотипа рака толстой кишки.Cancer Cell 2003; 4: 121-31 [PubMed] [Google Scholar] 100. Байлин С, Бестор ТД. Измененные паттерны метилирования в геномах раковых клеток: причина или следствие? Cancer Cell 2002; 1: 299-305 [PubMed] [Google Scholar] 101. Норри М.В., Хокинс Н.Дж., Тодд А.В. и др. Роль метилирования hMLh2 в развитии синхронных спорадических колоректальных карцином. Dis Colon Rectum 2002; 45: 674-80 [PubMed] [Google Scholar] 103. Ахуджа Н, Исса Дж. П. Старение, метилирование и рак. Histol Histopathol 2000; 15: 835-42 [PubMed] [Google Scholar] 104.Xiong Z, Wu AH, Bender CM и др. Дефицит репарации несоответствия и гиперметилирование CpG-островков при спорадических аденокарциномах толстой кишки. Эпидемиологические биомаркеры рака до 2001 г .; 10: 799-803 [PubMed] [Google Scholar] 105. Chen WY, Zeng X, Carter MG и др. Гетерозиготное нарушение Hic1 предрасполагает мышей к половозависимому спектру злокачественных опухолей. Нат Генет 2003; 33: 197-202 [PubMed] [Google Scholar] 106. Кейн М.Ф., Лода М., Гайда Г.М. и др. Метилирование промотора hMLh2 коррелирует с отсутствием экспрессии hMLh2 в спорадических опухолях толстой кишки и дефектных по восстановлению спаривания линиях опухолевых клеток человека.Cancer Res 1997; 57: 808-11 [PubMed] [Google Scholar] 107. Ма А.Х., Ся Л., Литтман С.Дж. и др. Соматическая мутация hPMS2 как возможная причина спорадического рака толстой кишки человека с микросателлитной нестабильностью. Онкоген 2000; 19: 2249-56 [PubMed] [Google Scholar] 108. Вейгл М.Л., Кастури Л., Олехнович Дж. И др. Двуаллельная инактивация hMLh2 путем подавления эпигенетического гена, нового механизма, вызывающего рак MSI у человека. Proc Natl Acad Sci USA 1998; 95: 8698-702 [Бесплатная статья PMC] [PubMed] [Google Scholar] 109. Шен Л., Кондо Ю., Роснер Г.Л. и др.Метилирование промотора MGMT и дефект поля при спорадическом колоректальном раке. J Natl Cancer Inst 2005; 97: 1330-8 [PubMed] [Google Scholar] 110. Bevilacqua RA, Simpson AJ. Метилирование промотора hMLh2, но отсутствие мутаций hMLh2 в спорадических карциномах желудка с высокой микросателлитной нестабильностью. Int J Cancer 2000; 87: 200-3 [PubMed] [Google Scholar] 111. Герман Дж. Г., Умар А., Поляк К. и др. Частота и функциональные последствия гиперметилирования промотора hMLh2 при колоректальной карциноме. Proc Natl Acad Sci USA 1998; 95: 6870-5 [Бесплатная статья PMC] [PubMed] [Google Scholar] 113.Jass JR. Классификация колоректального рака на основе соотношения клинических, морфологических и молекулярных признаков. Гистопатология 2007; 50: 113-30 [PubMed] [Google Scholar] 114. Sinicrope FA, Sargent DJ. Молекулярные пути: микросателлитная нестабильность при колоректальном раке: прогностические, прогностические и терапевтические последствия. Clin Cancer Res 2012; 18: 1506-12 [Бесплатная статья PMC] [PubMed] [Google Scholar] 115. Боланд CR, Тибодо С.Н., Гамильтон С.Р. и др. Семинар Национального института рака по микросателлитной нестабильности для выявления рака и семейной предрасположенности: разработка международных критериев для определения микросателлитной нестабильности при колоректальном раке.Cancer Res 1998; 58: 5248-57 [PubMed] [Google Scholar] 116. Шнайдер Р., Шнайдер С., Клоор М. и др. Синдром Линча: клинические, патологические и генетические наблюдения. Langenbecks Arch Surg 2012; 397: 513-25 [PubMed] [Google Scholar] 117. Вайсман С.М., Берт Р., Черч Дж. И др. Выявление лиц, подверженных риску синдрома Линча, с использованием целевых оценок и генетического тестирования: Национальное общество консультантов по генетическим вопросам и Совместная группа стран Америки по унаследованному колоректальному раку.Дж. Генет Кунс 2012, 21: 484-93 [PubMed] [Google Scholar] 118. Brink M, de Goeij AF, Weijenberg MP, et al. Мутации онкогена K-ras при спорадическом колоректальном раке в когортном исследовании Нидерландов. Канцерогенез 2003; 24: 703-10 [PubMed] [Google Scholar] 119. Lièvre A, Bachet JB, Le Corre D, et al. Статус мутации KRAS позволяет прогнозировать ответ на терапию цетуксимабом при колоректальном раке. Cancer Res 2006; 66: 3992-5 [PubMed] [Google Scholar] 120. Khambata-Ford S, Garrett CR, Meropol NJ, et al. Экспрессия эпирегулина и амфирегулина, а также статус мутации K-ras позволяют прогнозировать контроль заболевания у пациентов с метастатическим колоректальным раком, получавших цетуксимаб.Дж. Клин Онкол 2007; 25: 3230-7 [PubMed] [Google Scholar] 121. Амадо Р.Г., Вольф М., Петерс М. и др. KRAS дикого типа необходим для эффективности панитумумаба у пациентов с метастатическим колоректальным раком. Дж. Клин Онкол 2008; 26: 1626-34 [PubMed] [Google Scholar] 122. Аллегра CJ, Джессап JM, Somerfield MR, et al. Предварительное клиническое заключение Американского общества клинической онкологии: тестирование мутаций гена KRAS у пациентов с метастатической колоректальной карциномой для прогнозирования ответа на терапию моноклональными антителами к рецептору противоэпидермального фактора роста.Дж. Клин Онкол 2009; 27: 2091-6 [PubMed] [Google Scholar] 123. Национальная всеобъемлющая онкологическая сеть. Руководство NCCN по клинической практике в онкологии: рак толстой кишки v.2.2009. Форт Вашингтон, Пенсильвания: Национальная всеобъемлющая онкологическая сеть. 2009. [Google Scholar] 124. Bos JL. Онкогены Ras при раке человека: обзор. Cancer Res 1989; 49: 4682-9 [PubMed] [Google Scholar] 125. Причард С.С., Акаги Л., Редди П.Л. и др. Анализ кривой плавления с помощью COLD-PCR повышает точность диагностики мутаций KRAS при колоректальной карциноме.BMC Clin Pathol 2010; 10: 6. [Бесплатная статья PMC] [PubMed] [Google Scholar] 126. Лупакис Ф., Руццо А., Кремолини С. и др. Мутации кодона KRAS 61, 146 и BRAF предсказывают устойчивость к цетуксимабу плюс иринотекан в кодоне 12 и 13 KRAS метастатического колоректального рака дикого типа. Br J Cancer 2009; 101: 715-21 [Бесплатная статья PMC] [PubMed] [Google Scholar] 127. Клейтон С.Дж., Скотт Ф.М., Уокер Дж. И др. Обнаружение точечной мутации K-ras при раке легких: сравнение двух подходов к обнаружению соматических мутаций с использованием аллель-специфической амплификации ARMS.Clin Chem 2000; 46: 1929-38 [PubMed] [Google Scholar] 128. Elenitoba-Johnson KS, Bohling SD, Wittwer CT, et al. Мультиплексная ПЦР с помощью многоцветной флуориметрии и флуоресцентного анализа кривой плавления. Nat Med 2001; 7: 249-53 [PubMed] [Google Scholar] 129. Монзон Ф.А., Огино С., Хаммонд М.Э. и др. Роль тестирования мутации KRAS в ведении пациентов с метастатическим колоректальным раком. Arch Pathol Lab Med 2009; 133: 1600-6 [PubMed] [Google Scholar] 130. Огино С., Кавасаки Т., Брахмандам М. и др. Чувствительный метод секвенирования для обнаружения мутации KRAS с помощью пиросеквенирования.J Mol Diagn 2005; 7: 413-21 [Бесплатная статья PMC] [PubMed] [Google Scholar] 131. Дюфорт С., Ричард М.Дж., де Фрайпон Ф. Метод пиросеквенирования для обнаружения мутации KRAS в опухолевых тканях, фиксированных формалином и залитых парафином. Анальная биохимия 2009; 391: 166-8 [PubMed] [Google Scholar] 132. Самовиц В.С., Суини С., Херрик Дж. И др. Низкая выживаемость, связанная с мутацией BRAF V600E, при микросателлитно-стабильном раке толстой кишки. Cancer Res 2005; 65: 6063-9 [PubMed] [Google Scholar] 133. Огино С., Шима К., Мейерхардт Дж. А. и др.Прогностическая и прогностическая роль мутации BRAF при раке толстой кишки III стадии: результаты межгруппового исследования CALGB 89803. Clin Cancer Res 2012; 18: 890-900 [Бесплатная статья PMC] [PubMed] [Google Scholar] 134. Дэвис Х., Бигнелл Г.Р., Кокс С. и др. Мутации гена BRAF при раке человека. Nature 2002; 417: 949-54 [PubMed] [Google Scholar] 135. Раджагопалан Х., Барделли А., Ленгауэр С. и др. Онкогенез: онкогены RAF / RAS и статус несоответствия репарации. Природа 2002; 418: 934. [PubMed] [Google Scholar] 136. Коинума К., Шито К., Миякура Ю. и др.Мутации BRAF связаны с обширным метилированием промотора hMLh2 в спорадических колоректальных карциномах. Int J Cancer 2004; 108: 237-42 [PubMed] [Google Scholar] 137. Lea A, Allingham-Hawkins D, Levine S.BRAF p.Val600Glu (V600E) Тестирование для оценки вариантов лечения метастатического колоректального рака. Версия 2. PLoS Curr 2010; 2: RRN1187. [Бесплатная статья PMC] [PubMed] [Google Scholar] 138. Weisenberger DJ, Siegmund KD, Campan M, et al. Фенотип метилатора CpG-островка лежит в основе спорадической микросателлитной нестабильности и тесно связан с мутацией BRAF при колоректальном раке.Нат Генет 2006; 38: 787-93 [PubMed] [Google Scholar] 139. Каннингем Дж. М., Кристенсен Э. Р., Тестер DJ и др. Гиперметилирование промотора hMLh2 при раке толстой кишки с микросателлитной нестабильностью. Cancer Res 1998; 58: 3455-60 [PubMed] [Google Scholar] 140. Лагерстедт Робинсон К., Лю Т., Вандровцова Дж. И др. Диагностика синдрома Линча (наследственный неполипозный колоректальный рак). J Natl Cancer Inst 2007; 99: 291-9 [PubMed] [Google Scholar]Колоректальная карцинома: патологические аспекты
J Gastrointest Oncol.2012 сен; 3 (3): 153–173.
Кафедра патологии и лабораторной медицины Медицинской школы Дэвида Геффена Калифорнийского университета, Лос-Анджелес, Калифорния, США
Автор, ответственный за переписку.* Равные взносы
Соответствует: Hanlin L. Wang, MD, PhD. Кафедра патологии и лабораторной медицины, Калифорнийский университет в Лос-Анджелесе. 10833 Le Conte Avenue, Лос-Анджелес, Калифорния, США. Тел .: (310) 206-1763; Факс: (310) 267-2058. Электронная почта: ude.alcu.tendem@gnawnilnah.
Поступило 6 апреля 2012 г .; Принято 23 апреля 2012 г.
Copyright 2012 Pioneer Bioscience Publishing Company. Все права защищены.Эта статья цитировалась в других статьях в PMC.Abstract
Колоректальная карцинома является одним из наиболее распространенных видов рака и одной из основных причин смерти от рака в Соединенных Штатах. Патологическое исследование образцов биопсии, полипэктомии и резекции имеет решающее значение для надлежащего ведения пациента, оценки прогноза и семейного консультирования.Молекулярное тестирование играет все более важную роль в эпоху персонализированной медицины. В этой обзорной статье основное внимание уделяется гистопатологии и молекулярной патологии колоректальной карциномы и ее предшественников, с акцентом на их клиническую значимость.
Ключевые слова: Колоректальная карцинома, патология, аденома, молекулярная, MSI, KRAS, BRAF
Введение
Колоректальная карцинома является третьим по распространенности раком в США после рака простаты и легких / бронхов у мужчин и после рака груди. и рак легких / бронхов у женщин.Это также третья по значимости причина смерти от рака в Соединенных Штатах после рака легких / бронхов и простаты у мужчин и после рака легких / бронхов и груди у женщин (1). В 2011 году в Соединенных Штатах было диагностировано 141 210 новых случаев колоректальной карциномы, из которых, по оценкам, умерло 49 380 человек, что составляет примерно 9% всех вновь диагностированных раковых заболеваний и всех смертей, связанных с раком (за исключением базальноклеточного и плоскоклеточного рака кожи).
С быстрым терапевтическим прогрессом в эпоху персонализированной медицины роль патологов в ведении пациентов с колоректальной карциномой значительно расширилась от традиционных морфологов до клинических консультантов для гастроэнтерологов, колоректальных хирургов, онкологов и медицинских генетиков.Помимо точного гистопатологического диагноза, патологоанатомы несут ответственность за точную оценку стадии патологии, анализ границ хирургического вмешательства, поиск прогностических параметров, которые не включены в стадию, таких как лимфоваскулярная и периневральная инвазия, и оценка терапевтического эффекта у пациентов, получавших неоадъявантную терапию. . Патологи также играют центральную роль в анализе гистологических характеристик опухолей, которые указывают на микросателлитную нестабильность (MSI), выборе соответствующих срезов тканей для тестирования MSI и анализа мутаций для KRAS и BRAF, а также интерпретации результатов этих важных терапевтических и прогностических тестов ( 2).
Эта обзорная статья посвящена гистолопатологии колоректальной карциномы и ее предшественников. Обсуждаются последние достижения в области молекулярной патологии и молекулярных тестов. Подчеркивается их клиническая значимость.
Гистопатологическая диагностика колоректальной карциномы
Более 90% колоректальных карцином представляют собой аденокарциномы, происходящие из эпителиальных клеток слизистой оболочки толстой кишки (3). Другие редкие типы колоректальной карциномы включают нейроэндокринную, плоскоклеточную, аденосквамозную, веретено-клеточную и недифференцированные карциномы.Обычная аденокарцинома характеризуется железистым образованием, которое является основой гистологической классификации опухоли. При хорошо дифференцированной аденокарциноме> 95% опухоли формирует железы. Умеренно дифференцированная аденокарцинома показывает образование желез на 50-95%. Плохо дифференцированная аденокарцинома в основном солидная, с образованием желез <50%. На практике большинство колоректальных аденокарцином (~ 70%) диагностируются как умеренно дифференцированные (). На долю хорошо и плохо дифференцированных карцином приходится 10% и 20% соответственно.
Пример умеренно дифференцированной аденокарциномы, демонстрирующей сложные железистые структуры в десмопластической строме (исходное увеличение × 200)
Очевидно, что определение степени опухоли является субъективным упражнением. Многие исследования продемонстрировали, что двухуровневая система оценки, которая сочетает в себе хорошо и умеренно дифференцированную до низкой степени (образование железы 50%) и определяет низкую степень дифференциации как высокую степень (образование железы <50%), снижает вариативность между наблюдателями и улучшает прогностическую значимость ( 4,5).Хотя это противоречиво, степень опухоли обычно рассматривается как независимая от стадии прогностическая переменная, а гистология высокой степени или плохо дифференцированная гистология связана с плохой выживаемостью пациента (6-8). Однако следует подчеркнуть, что гистологическая классификация должна применяться только к обычной аденокарциноме. Некоторые из гистологических вариантов, которые будут обсуждены позже, могут иметь морфологию высокой степени злокачественности, но вести себя как опухоли низкой степени злокачественности из-за своего статуса MSI.
Подавляющее большинство колоректальных карцином первоначально диагностируется с помощью эндоскопической биопсии или полипэктомии.Ключевым аспектом микроскопического исследования является поиск доказательств инвазии. Однако это может быть сложно, если биопсия поверхностная или плохо ориентирована. Если можно идентифицировать мышечную слизистую оболочку, важно определить, не нарушена ли она опухолевыми клетками. Инвазивная карцинома обычно проникает через мышечную слизистую оболочку в подслизистую основу и иногда наблюдается в непосредственной близости от подслизистых кровеносных сосудов. Другой важной особенностью инвазии является наличие десмоплазии или десмопластической реакции (), типа фиброзной пролиферации вокруг опухолевых клеток, вторичной по отношению к инвазивному росту опухоли.Инвазивная колоректальная карцинома также часто показывает характерные некротические образования в просвете железы, так называемый «грязный некроз» (). Эта уникальная функция может быть весьма полезной при обнаружении первичного колоректального рака при обнаружении метастазов неизвестного происхождения.
Десмопластическая реакция, характеризующаяся пролиферацией веретенов, окружающих аденокарциноматозную железу (исходное увеличение × 400)
Некротический мусор («грязный некроз») в просвете аденокарциноматозных желез (исходное увеличение × 400)
Следует отметить, что когда поставлен диагноз инвазивная карцинома, это означает, что карцинома, по крайней мере, проникла в подслизистую оболочку толстой кишки.Это отличается от концепции инвазии в другие части желудочно-кишечного тракта (пищевод, желудок и тонкий кишечник), где наличие инвазии слизистой оболочки является достаточным для диагностики инвазивной карциномы (pT1). В толстой кишке для диагностики опухоли pT1 требуется подслизистая инвазия. По причинам, которые не совсем ясны, но обычно предполагают, что они связаны с относительной недостаточностью лимфатических сосудов, инвазия, ограниченная собственной пластинкой оболочки и мышечной оболочкой, не имеет риска узловых или отдаленных метастазов.Таким образом, внутрислизистая карцинома предпочтительно называется дисплазией высокой степени (обсуждается позже) патологами, чтобы избежать ненужного хирургического вмешательства. В Руководстве по стадированию рака Американского объединенного комитета по раку (AJCC) (9) инвазия слизистой оболочки классифицируется как карцинома in situ (Tis). Тем не менее, термин «внутрислизистый рак» все еще может использоваться некоторыми патологами. Независимо от того, какой термин используется патологами, выявление дисплазии высокой степени или внутрислизистой карциномы в образце биопсии или полипэктомии не должно влиять на принятие решения по ведению пациента.Решение о проведении хирургической резекции должно в конечном итоге определяться общим видом поражения, результатами эндоскопического УЗИ и возможностью эндоскопической резекции.
Гистологические варианты
В классификации Всемирной организации здравоохранения (ВОЗ) перечислен ряд гистологических вариантов колоректальной карциномы, таких как муцинозный, перстневидный, медуллярный, микропапиллярный, зубчатый, ребристый комедонный тип, аденосквамозный, веретено-клеточный и др. и недифференцированный. Здесь обсуждаются только первые 3 варианта.
Муцинозная аденокарцинома
Этот особый тип колоректальной карциномы определяется тем, что> 50% объема опухоли состоит из внеклеточного муцина (3). Опухоли со значительным муцинозным компонентом (> 10%), но <50% обычно называют аденокарциномой с муцинозными признаками или муцинозной дифференцировкой. Муцинозная аденокарцинома обычно показывает большие железистые структуры с пулами внеклеточного муцина (). Можно увидеть переменное количество индивидуальных опухолевых клеток, включая клетки перстня.Прогноз муцинозной аденокарциномы по сравнению с обычной аденокарциномой был неоднозначным в различных исследованиях (10,11). Многие муцинозные аденокарциномы возникают у пациентов с наследственным неполипозным колоректальным раком (HNPCC или синдром Линча) и, таким образом, представляют собой опухоли высокого уровня MSI (MSI-H) (12). Ожидается, что эти опухоли будут вести себя низкоуровневым образом. Напротив, ожидается, что муцинозные аденокарциномы, которые являются микросателлитно-стабильными (MSS), будут вести себя более агрессивно, особенно при обнаружении на поздней стадии.
Муцинозная аденокарцинома с обильным внеклеточным муцином (исходное увеличение × 200)
Аденокарцинома с перстневым кольцом
В отличие от желудочной аденокарциномы с перстневым кольцом в толстой кишке встречается редко, составляя <1% всех колоректальных карцином. Подобно муцинозной карциноме, карцинома с перстневым кольцом определяется наличием> 50% опухолевых клеток, демонстрирующих особенности клеток с перстневым кольцом, характеризующиеся выраженной внутрицитоплазматической муциновой вакуолью, которая выталкивает ядро к периферии ().Клетки с печатным кольцом могут демонстрировать инфильтративный характер роста или присутствовать в пулах внеклеточного муцина. По определению, карцинома из перстневых клеток плохо дифференцирована (высокая степень) и имеет худший исход, чем обычная аденокарцинома (11,13,14). Однако некоторые карциномы из перстневых клеток могут быть опухолями MSI-H и, таким образом, биологически вести себя как опухоли низкой степени злокачественности (3).
Карцинома из перстневых клеток (исходное увеличение × 400)
Медуллярная карцинома
Медуллярная карцинома встречается крайне редко, составляя примерно 5-8 случаев на каждые 10000 диагностированных колоректальных раковых заболеваний, при средней ежегодной заболеваемости 3.47 (± 0,75) на 10 млн населения (15). Эта опухоль характеризуется слоями эпителиоидных неопластических клеток с крупными везикулярными ядрами, выступающими ядрышками и обильной цитоплазмой. Как правило, на образцах после резекции он имеет расширяющуюся границу () и обычно ассоциируется с выраженными лимфоцитами, инфильтрирующими опухоль (). Медуллярная карцинома — это особый гистологический подтип, который тесно связан с MSI-H (16,17). Прогноз обычно благоприятный, несмотря на его плохо дифференцированную или недифференцированную гистологию.
Медуллярная карцинома с раздвигающейся границей на краю опухоли (исходное увеличение × 40)
Медуллярная карцинома с плохо дифференцированной гистологией и инфильтрирующими опухоль лимфоцитами (исходное увеличение × 400)
Иммуногистохимический фенотип
Наиболее широко используемый иммуногистохимический маркер колоректальная аденокарцинома — это цитокератин (CK) 20, CK7 и CDX2. Наиболее распространенным иммунофенотипом колоректальной аденокарциномы является положительный для CK20 и отрицательный для CK7, что является относительно специфическим паттерном окрашивания для колоректального происхождения (18).Однако до 20% опухолей могут демонстрировать CK7-положительный / CK20-отрицательный или CK7-отрицательный / CK20-отрицательный паттерн окрашивания. Было высказано предположение, что снижение или отсутствие экспрессии CK20 при колоректальной карциноме связано с MSI-H (19). CDX2 является маркером кишечной дифференцировки и является положительным в> 90% колоректальных аденокарцином (20,21). Однако CDX2 может быть положительным при любой карциноме, которая проявляет кишечную дифференцировку и, следовательно, не является полностью колоректально-специфической. Интересно, что медуллярные карциномы толстой кишки часто бывают CK20-отрицательными и CDX2-отрицательными, что соответствует концепции MSI (16,19).
Патологическая стадия
Стадия опухоли на сегодняшний день является наиболее важным прогностическим предиктором клинического исхода для пациентов с колоректальной карциномой. Гистологическое исследование хирургически резецированных образцов играет незаменимую роль в определении глубины инвазии опухоли (T) и степени метастазов в лимфоузлы (N). Гистологическое определение T1 (опухоль проникает в подслизистую оболочку), T2 (опухоль проникает в собственную мышечную оболочку) и T3 (опухоль проникает через собственную мышечную мышцу в периколоректальные ткани) обычно не вызывает затруднений при использовании системы стадирования TNM AJCC (9).Однако определение T4a (опухоль проникает на поверхность висцеральной брюшины) и T4b (опухоль непосредственно вторгается или прикрепляется к другим органам или структурам) иногда может быть проблематичным. Во-первых, вовлечение серозной поверхности (висцеральной брюшины) можно не заметить, если образец не взят для гистологического исследования. Во-вторых, серозную поверхность можно спутать с периферическим (радиальным) или брыжеечным краем, который представляет собой неперитонеализированную поверхность, созданную хирургическим путем путем тупого или острого рассечения.Опухоль Т3 может поражать радиальный край, а опухоль Т4 может иметь отрицательный радиальный край. В-третьих, перфорацию, вызванную хирургическим вмешательством в месте опухоли, можно спутать с истинной перфорацией опухоли, что требует уточнения от хирургов. В-четвертых, прилипание других органов или структур к месту опухоли не обязательно соответствует критериям T4b. Гистологически место прикрепления может показывать только воспалительные изменения, образование абсцесса и / или фиброз, но без прямого вовлечения опухоли. Наконец, существует некоторая путаница в определении вовлечения висцеральной брюшины.Ясно, что интерпретация T4a может быть однозначной, если: (I) опухолевые клетки присутствуют на серозной поверхности с воспалительной реакцией, мезотелиальной гиперплазией и / или эрозией; или (II) свободные опухолевые клетки видны на серозной поверхности с лежащей под ними язвой висцеральной брюшины. Однако идентификация опухолевых клеток близко к серозной поверхности, но не на ней, будет рассматриваться некоторыми исследователями как T4a, если есть связанные мезотелиальные воспалительные и / или гиперпластические реакции (22).По-видимому, применение этого третьего критерия подвержено субъективным суждениям и не воспроизводится. Отмечается, что в обновленных протоколах рака и контрольных списках Колледжа американских патологов (CAP) только первые два критерия указаны как диагностические признаки T4a, а третий критерий удален (23).
Опухолевые клетки, расположенные близко к серозной поверхности, но не на ней, с мезотелиальными воспалительными и гиперпластическими реакциями, которые некоторые исследователи могут рассматривать как T4a (исходное увеличение × 40)
Патологи обязаны извлечь столько лимфатических узлов, сколько возможно из хирургических образцов.Подавляющее большинство патологов следуют рекомендациям минимум 12 узлов (24). Дополнительные усилия будут предприняты, если будет извлечено <12 узлов, хотя это увеличит время обработки отчетов о патологии. Дополнительные усилия могут включать повторный ручной поиск, отправку большего количества разделов, использование методов очистки от жира (25,26) или инъекцию метиленового синего ex vivo (27,28). Применение методов очистки от жира имеет несколько потенциальных недостатков, таких как дальнейшая задержка регистрации отчетов о патологии, стоимость, токсичность и утилизация очищающих растворов, а также неизвестное влияние на иммуногистохимию.В результате удаление жира не стало стандартной практикой в лабораториях патологии. Инъекции метиленового синего - относительно новый метод лечения колоректального рака. В этой области было опубликовано всего несколько публикаций, в основном от одной и той же исследовательской группы (27,28). Его клиническое применение требует дальнейшего изучения.
Следует понимать, что общее количество извлеченных узлов не только зависит от диссектора, но также зависит от ряда переменных образца и пациента. Исследования показали положительную корреляцию с длиной образца, шириной периколоректального жира, женским полом и размером опухоли; и отрицательная корреляция с возрастом пациента и ректосигмоидным расположением опухолей (29,30).Неудивительно, что можно ожидать менее 12 узлов, если пациенты получали предоперационную неоадъювантную терапию (31,32). Рекомендуется, чтобы патологоанатомы задокументировали степень усердия своих усилий по поиску лимфатических узлов в образце в отчетах о патологии, если извлечено <12 узлов.
Одним из интересных вопросов при определении стадии узлов является интерпретация дискретных отложений опухоли в периколоректальном жире от основной опухоли, но без идентифицируемой остаточной ткани лимфатических узлов.В AJCC Cancer Staging Manual 5 th edition узел опухоли> 3 мм считался положительным узлом, тогда как узел ≤3 мм классифицировался в категорию прерывистого распространения (T3). В издании 6 th опухолевые отложения считались положительными узлами, если они были круглыми и имели гладкий контур независимо от размера, но классифицировались по категории Т, а также как венозная инвазия, если они имели неправильную форму. В текущем издании (7 th edition) признается тот факт, что отложения опухоли могут представлять собой прерывистое расширение, венозную инвазию с внесосудистым распространением или действительно полностью замененные лимфатические узлы.Учитывая их связь со снижением безрецидивной и общей выживаемости (33,34), эти опухолевые отложения теперь считаются узловыми метастазами, независимо от размера или контура, и обозначаются N1c при отсутствии метастазов в регионарные лимфатические узлы, чтобы способствовать дополнительному послеоперационному лечению. Однако, если также идентифицирован один положительный лимфатический узел, стадия N будет изменена с N1c на N1a. Наличие прерывистых опухолевых отложений не изменяет стадию Т в выпуске 7 th (9).
Прогностическое значение изолированных опухолевых клеток (ITC), определяемых как отдельные опухолевые клетки или небольшие кластеры опухолевых клеток размером ≤0,2 мм, обнаруженных либо с помощью иммуногистохимического окрашивания, либо стандартного окрашивания гематоксилином и эозином в регионарных лимфатических узлах, в настоящее время остается неясным. В отсутствие явных метастазов в лимфоузлы ITC классифицируются как N0, но аннотируются как N0 (i +), где «i» означает «изолированные опухолевые клетки». С другой стороны, микрометастаз (> 0,2 мм, но ≤2,0 мм) обозначается как N1 (микр.).Следует указать количество лимфатических узлов, вовлеченных в ITC или микрометастазирование (9,23).
Отчет о патологии
Большинство патологов используют стандартизированный синоптический отчет о колоректальной карциноме в соответствии с контрольным списком, рекомендованным CAP (23). Подробности, которые должны быть включены в отчет, включают тип образца, локализацию опухоли, размер опухоли, макроскопическую перфорацию опухоли, гистологический тип, гистологический класс, микроскопическое распространение опухоли, границы (проксимальные, дистальные и радиальные), эффект лечения (для опухолей, леченных неоадъювантом. терапия), лимфоваскулярная инвазия, периневральная инвазия, отложения опухоли (прерывистое экстрамуральное распространение), стадия TNM (включая общее количество исследованных лимфатических узлов и общее количество вовлеченных узлов).Некоторые отчеты о патологии могут также включать передний край опухоли (инфильтративный или расширяющийся), наличие или отсутствие зачатка опухоли и оценку гистологических характеристик, которые указывают на MSI, таких как инфильтрирующие опухоль лимфоциты, перитуморальный Крон-подобный лимфоидный ответ и процентное соотношение муцинозного компонента.
Обработка образцов и отбор образцов
В лабораториях патологии образцы после хирургической резекции обрабатываются систематическим образом, чтобы обеспечить полноту и точность отчета о патологии.Перед вскрытием наружную поверхность образца исследуют на предмет возможного серозного поражения, поражения радиального края, перфорации опухоли и удаленных опухолевых имплантатов. При резекции прямой кишки проверяется целостность мезоректума. После того, как образец ориентирован и образец измерен, радиальный край вокруг опухоли окрашивается. Затем образец вскрывают, обычно вдоль антимезентериальной границы, чтобы не прорезать опухоль. Регистрируются расположение и размер опухоли, а также ее расстояние от ближайшего края.Небольшие части свежей опухоли и неопухолевых тканей могут быть закуплены для банка тканей, но это не должно ставить под угрозу количество опухоли для диагностики.
Вскрытый и очищенный образец прикрепляют булавками к восковой доске и погружают в достаточный объем формалина для фиксации на ночь. Затем опухоль разрезается с интервалом 3-4 мм для оценки глубины инвазии. Остальная часть образца также исследуется на предмет дополнительных повреждений. Соответствующие срезы опухоли (обычно 5 срезов в зависимости от размера опухоли) должны быть отправлены на микроскопическое исследование, чтобы включить область наиболее глубокой инвазии и максимизировать вероятность обнаружения лимфоваскулярной и периневральной инвазии.Включение опухоли и прилегающей не пораженной толстой кишки в одни и те же секции желательно, потому что всегда есть вероятность того, что случай может быть использован для исследования в будущем. Дополнительные срезы должны включать проксимальный и дистальный края, радиальный край (если он не включен в срезы опухоли), любые дополнительные полипы или поражения, а также произвольно не пораженный толстый кишечник.
После взятия указанных выше срезов брыжеечный жир или периколоректальные мягкие ткани удаляются и исследуются на лимфатические узлы.Все явно отрицательные лимфатические узлы полностью подвергаются микроскопическому исследованию. Макро-положительные лимфатические узлы могут быть представлены частично или полностью в зависимости от их размера.
Образец для полипэктомии имеет чернила на прижатом основании, но ножка может втягиваться, и поэтому ее трудно идентифицировать. Образец делится пополам или серийно, в зависимости от его размера, и представляется полностью. Сечение должно следовать в вертикальной плоскости ножки, чтобы максимизировать гистологическую оценку края полипэктомии и вовлечения подслизистого слоя.Однако, если образец получен несколькими частями, оценка запаса может стать невозможной.
Предшествующие поражения
Хорошо известно, что подавляющее большинство колоректальных аденокарцином возникает из предшественников поражений, таких как аденомы и дисплазия. Резидуальная аденома — частая находка при колоректальных аденокарциномах. Эндоскопическая полипэктомия снижает частоту возникновения колоректального рака у пролеченных пациентов и предотвращает смерть от колоректального рака (35,36). Здесь обсуждаются некоторые из распространенных предшественников поражений.
Аденомы
По крайней мере, половина взрослых в западных странах будет иметь аденоматозный полип в течение жизни, и одна десятая этих поражений будет прогрессировать до аденокарциномы (37). Риск увеличивается после 50 лет. Эндоскопически аденомы могут быть на ножке или сидячими. По определению, аденомы — это клональные поражения, которые демонстрируют, по крайней мере, дисплазию низкой степени, характеризующуюся увеличенными, гиперхроматическими и удлиненными (пенцилловидными) ядрами, расположенными в стратифицированной конфигурации вдоль базальной мембраны.Аденоматозные клетки могут демонстрировать истощение муцина и повышенную апоптотическую активность. Интересно, что аденоматозные полипы, по-видимому, развиваются по механизму «сверху вниз» (38). Таким образом, небольшие поражения часто имеют только аденоматозный эпителий в их поверхностных частях.
Обычные аденомы делятся на тубулярные, трубчато-ворсинчатые и ворсинчатые в зависимости от их архитектурных особенностей (). Тубулярные аденомы состоят из простых криптоподобных диспластических желез и содержат менее 25% ворсинчатого компонента.Ворсинчатые аденомы на> 75% состоят из ворсинчатого компонента, напоминающего пальцеобразные выступы. Тубуловиллярные аденомы представляют собой промежуточные поражения с 25-75% ворсинчатого компонента. Аденомы большого размера (> 1 см) или преимущественно ворсинчатые, или содержащие дисплазию высокой степени (обсуждается ниже), считаются «продвинутыми аденомами» (39), которые требуют более агрессивного эндоскопического наблюдения.
Примеры трубчатой аденомы (A. исходное увеличение × 200) и трубчатой аденомы (B. исходное увеличение × 100)
Зубчатые полипы
Зубчатые полипы — это общий термин для любых полипов с зубчатыми (пилообразными или звездчатыми) архитектура эпителиального компартмента.Это гетерогенная группа поражений, в которую в основном входят гиперпластический полип, зубчатая аденома / полип на сидячей кости и традиционная зубчатая аденома (40).
Гиперпластические полипы (ГП) являются наиболее частыми зубчатыми поражениями, которые чаще встречаются в дистальном отделе толстой кишки и обычно имеют небольшой размер (<5 мм). Только редкие HP> 1 см. Эндоскопически трудно отличить HP от аденомы (41). Гистологически ГП характеризуются простой трубчатой архитектурой с удлиненными и прямыми криптами и люминальной зубчатостью, которая более выражена в верхних частях крипт с появлением поверхностного созревания ().Зона пролиферации ограничена базальной частью крипт, которая остается узкой и не зазубренной (42). HPs можно далее разделить на микровезикулярные, бокаловидные клетки и подтипы с низким содержанием муцина (43), но эта гистологическая подклассификация, по-видимому, не имеет никакого клинического значения.
Гиперпластический полип (исходное увеличение × 100)
Сессильная зубчатая аденома (SSA) и зубчатый полип сидячей кости (SSP) относятся к одному и тому же зубчатому поражению и в настоящее время используются взаимозаменяемо.SSA / P чаще встречаются в проксимальном отделе толстой кишки и обычно больше, чем HP (44). Гистологическая диагностика SSA / Ps полностью основана на архитектурных особенностях, характеризующихся чрезмерной зазубринами крипт, зазубринами по всей длине крипты, гипермуцинозным эпителием, дилатацией крипт, ветвлением крипт, горизонтальными расширениями крипт в основании крипт и аберрантной пролиферацией (45). Несмотря на название, SSA / Ps не имеют диспластических ядерных изменений, которые характерны для обычных аденом. Следует помнить, что SSA / P — относительно новая организация, которая раньше классифицировалась как HP.Таким образом, патологи могут столкнуться с трудностями при различении SSA / P и HP на гистологическом основании (46–48). В случаях, когда разделение непросто, может быть поставлен описательный диагноз «зубчатый полип» с комментарием.
Тем не менее, отделение SSA / P от HP представляется важным, потому что SSA / P теперь считается предшественником поражения колоректальной карциномы с MSI и, вероятно, также для метилированных CpG-островков карцином MSS (40), тогда как HP обычно считается поражением. быть безобидным.Наиболее надежные признаки, позволяющие отличить SSA / P от HP, — это расширение крипт в основании, часто предполагающее L, перевернутую букву T или конфигурацию в форме якоря (). Эти необычные формы («архитектурная дисплазия») часто наблюдаются в двух или более смежных криптах и, как полагают, являются результатом аномальной пролиферации и / или снижения апоптоза (42–44). Учитывая предполагаемый предраковый потенциал, для пациентов с SSA / Ps, вероятно, оправдано эндоскопическое наблюдение, аналогичное таковым с обычными аденомами.Кроме того, часть этих поражений потенциально может прогрессировать до карциномы быстрее, чем обычные аденомы. Таким образом, пациентам с этими поражениями может потребоваться еще более агрессивное эндоскопическое наблюдение (49,50).
Вид с малым увеличением (A. исходное увеличение × 40) и большим увеличением (B. исходное увеличение × 200) зубчатого полипа на сидячем месте. Обратите внимание на наличие базальной зубчатости
Традиционная зубчатая аденома (TSA) — это уникальный и необычный тип истинной аденомы, которая демонстрирует ядерную дисплазию низкой степени, аналогичную той, которая наблюдается при обычной аденоме, а также имеет зубчатую архитектуру, аналогичную той, которая наблюдается для HP и SSA / P.Характерны выраженная цитоплазматическая эозинофилия и характер роста ворсинок ().
Пример традиционной зубчатой аденомы (исходное увеличение × 400). Обратите внимание на наличие люминальной зазубрины, цитологической дисплазии низкой степени и цитологической эозинофилии
Дисплазия при воспалительном заболевании кишечника
Воспалительное заболевание кишечника (ВЗК) является хорошо известным фактором риска развития дисплазии и карциномы. Диспластические поражения на фоне ВЗК могут быть плоскими (эндоскопически невидимыми) или выпуклыми (51,52), которые классифицируются как неопределенные для дисплазии, дисплазии низкой степени или дисплазии высокой степени.Возвышенные поражения обычно называют поражениями или массами, связанными с дисплазией (DALM), и их трудно или невозможно отличить от спорадических аденом. Однако несколько исследований показали, что аденомоподобные поражения у пациентов с ВЗК, независимо от того, представляют ли они поражение DALM, связанное с ВЗК, или спорадическую аденому, можно адекватно лечить с помощью полипэктомии и постоянного эндоскопического наблюдения, если нет сопутствующей плоской дисплазии (53 -55).
Учитывая значение лечения, рекомендуется, чтобы диагноз дисплазии на фоне ВЗК был подтвержден опытным патологом (56).Неопределенный диагноз дисплазии не должен превращаться в мусорную корзину, и его следует использовать только для случаев, демонстрирующих тревожные цитологические и архитектурные изменения, но также демонстрирующих поверхностное созревание или обильное воспаление. Диагноз также подходит, если поверхность слизистой оболочки не может быть оценена из-за тангенциального разреза ткани, наличия заметного эффекта прижигания или наличия других артефактов обработки.
Синдром Линча
Синдром Линча является наиболее частым наследственным синдромом колоректального рака (57).Он характеризуется повышенным риском рака в течение жизни, в первую очередь желудочно-кишечного и гинекологического трактов, причем наиболее распространены колоректальные и эндометриальные карциномы. Совокупный риск развития колоректального рака в течение жизни оценивается в 66% для мужчин и 43% для женщин (58). У пациентов с синдромом Линча в относительно молодом возрасте развиваются муцинозные, малодифференцированные, недифференцированные или медуллярные карциномы в правой ободочной кишке. Могут быть заметны инфильтрирующие опухоль лимфоциты и перитуморальная лимфоидная реакция типа Крона.
Синдром Линча возникает в результате мутации зародышевой линии в одном из четырех генов восстановления несоответствия ДНК (MMR) ( MLh2, MSh3, MSH6, PMS2 ) и передается по аутосомно-доминантному типу. Почти 90% пациентов имеют мутации в гене MLh2 или MSh3 (57,59). Мутации в генах MSH6 и PMS2 встречаются гораздо реже. Диагноз устанавливается в соответствии с Амстердамскими критериями II () (60) и тестированием MSI в соответствии с пересмотренными рекомендациями Bethesda () (61).Пациенты с опухолью MSI, но без идентифицируемого дефекта зародышевой линии в гене MMR, могут по-прежнему иметь синдром Линча, если исключены другие причины MSI, такие как метилирование промотора MLh2 .
Таблица 1
Амстердамские критерии II для синдрома Линча (60)| Должно быть не менее трех родственников с раком, связанным с синдромом Линча (колоректальный рак, рак эндометрия, тонкой кишки, мочеточника или почечной лоханки. ) |
| Должны быть соблюдены все следующие критерии |
| 1.Один должен быть родственником первой степени родства двух других |
| 2. По крайней мере, два следующих друг за другом поколения должны быть затронуты |
| 3. По крайней мере одно должно быть диагностировано до достижения возраста 50 лет |
| 4. Семейный аденоматозный полипоз должен быть исключен в случае (ах) колоректального рака, если таковой имеется |
| 5. Опухоли должны быть проверены патологическим исследованием |
Таблица 2
Пересмотренное руководство Bethesda по тестированию MSI (61 )| 1.Колоректальный рак диагностирован у пациента младше 50 лет |
| 2. Наличие синхронных, метахронных колоректальных или других опухолей, связанных с синдромом Линча, * независимо от возраста |
| 3. Колоректальный рак с гистология MSI-H **, диагностированная у пациента младше 60 лет |
| 4. Колоректальный рак диагностирован у одного или нескольких родственников первой степени родства с опухолью, связанной с синдромом Линча, с одной из рак, диагностированный в возрасте до 50 лет |
| 5.Колоректальный рак диагностирован у двух или более родственников первой или второй степени родства с опухолями, связанными с синдромом Линча, независимо от возраста |
Семейный аденоматозный полипоз
Семейный аденоматозный полипоз (FAP) является редким аутосомно-доминантным наследственным колоректальным синдромом ( 62,63), характеризующиеся ранним развитием сотен и тысяч аденоматозных полипов в толстой кишке (). Если не лечить, прогрессирование колоректального рака практически неизбежно в среднем в возрасте 35-40 лет (63,64).Эти пациенты также подвержены риску развития аденоматозных полипов в тонкой кишке (65) и полипов фундальных желез в желудке (66). Хотя синдромальные полипы фундальных желез чаще демонстрируют дисплазию низкой степени, чем спорадические аналоги (67–69), вероятность прогрессирования до дисплазии высокой степени или инвазивной карциномы чрезвычайно низка.
Случай семейного аденоматозного полипоза. Обратите внимание на наличие бесчисленных полипов в толстой кишке
Диагностические критерии FAP включают: (I) 100 колоректальных аденоматозных полипов; (II) мутация зародышевой линии гена аденоматозного полипоза coli ( APC ); или (III) семейный анамнез ФАП и любого количества аденом в молодом возрасте (70).Пациенты с ослабленным FAP имеют <100 колоректальных аденоматозных полипов, обычно в среднем около 30. Их пожизненный риск развития колоректального рака снижается примерно до 70%, и у большинства пациентов онкологические заболевания развиваются позже (63,71). Синдром Гарднера - вариант ФАП. У пациентов с этим синдромом также есть эпидермоидные кисты, остеомы, аномалии зубов и десмоидные опухоли. Синдром Тюрко - еще один вариант, который включает опухоли головного мозга, как правило, медуллобластому (70).
Ген-супрессор опухоли APC представляет собой большой ген, который содержит 21 экзон, охватывающий область размером 120 т.п.н. и кодирующий белок из 2843 аминокислот.Большинство мутаций зародышевой линии представляют собой бессмысленные мутации и мутации сдвига рамки считывания и группируются в «горячей точке» в самом большом экзоне 15 (72,73), что приводит к синтезу усеченного белка, что, в свою очередь, приводит к аберрантному накоплению β -катенин и последующая активация комплекса факторов транскрипции β-катенин / Tcf, чтобы способствовать неконтролируемой активации сигнального пути Wnt онкогенеза (74).
Синдром Пейтца-Егерса
Это аутосомно-доминантный наследственный онкологический синдром, характеризующийся гамартоматозными полипами в желудочно-кишечном тракте, пигментными кожно-слизистыми поражениями и повышенным риском желудочно-кишечных и экстрагастроинтестинальных злокачественных новообразований (75).Кумулятивный риск развития колоректального рака в течение жизни приближается к 40% (76). Однако остается под вопросом, являются ли злокачественные новообразования кишечника результатом прямой трансформации гамартоматозных полипов, поскольку дисплазия этих полипов чрезвычайно редка. Пациенты с синдромом Пейтца-Егерса имеют мутации зародышевой линии в гене LKB1 / STK11 (77-79). Гамартоматозные полипы при синдроме Пейтца-Егерса чаще всего встречаются в тонком кишечнике, но также могут возникать в толстой кишке.Они состоят из пролиферативного эпителия, стромы и гладких мышц, расположенных ветвистым узором ().
Полип Пейтца-Йегерса в толстой кишке. Обратите внимание на дольчатый рисунок крипт толстой кишки, разделенных пучками гладких мышц (исходное увеличение × 100)
Синдром ювенильного полипоза
Это также аутосомно-доминантный наследственный онкологический синдром, диагностированный, если: (I) 5 ювенильных полипов в толстой кишке; (II) ювенильные полипы желудочно-кишечного тракта; или (III) любое количество ювенильных полипов и семейный анамнез ювенильного полипоза (80).Подобно синдрому Пейтца-Егерса, совокупный риск развития колоректального рака в течение жизни у пациентов с синдромом ювенильного полипоза также приближается к 40% (80,81). Однако, в отличие от синдрома Пейтца-Егерса, считается, что колоректальный рак у пациентов с синдромом ювенильного полипоза развивается непосредственно в результате неопластической трансформации в ювенильном полипе, поскольку дисплазия является частой находкой в этих полипах. Примерно 50-60% пациентов имеют мутации зародышевой линии в генах SMAD4 или BMPR1A (82).Гистологически ювенильные полипы характеризуются кистозно расширенными криптами с отечной и воспаленной стромой (). Поверхность полипа может быть эродированной, с грануляционной тканью и регенеративными изменениями эпителия.
Ювенильный полип с расширенными криптами и воспаленной стромой (исходное увеличение × 40)
Следует отметить, что синдромальные ювенильные полипы нельзя отличить от спорадических аналогов, и их можно спутать с воспалительными полипами на гистологическом основании. Несмотря на название, ювенильные полипы могут встречаться у взрослых и даже пожилых людей.Пациенты со спорадическими ювенильными полипами не имеют повышенного риска злокачественных новообразований (83).
MUTYH- ассоциированный полипозMUTYH -ассоциированный полипоз (MAP) — это синдром аутосомно-рецессивного полипоза, который несет повышенный риск развития колоректального рака (84,85). Это вызвано двуаллельными мутациями зародышевой линии в гене MUTYH (также известном как ген MYH ), который кодирует фермент эксцизионной репарации оснований (BER), ответственный за предотвращение мутаций после окислительного повреждения ДНК.Наиболее частыми мутациями являются миссенс-варианты Y165C и G382D, на которые приходится> 70% всех мутантных аллелей (86,87). Пациенты с MAP обычно имеют> 10 синхронных колоректальных аденом и могут иметь несколько сотен или даже до 1000 полипов. Однако у большинства пациентов на момент постановки диагноза имеется <100 полипов (88). Следовательно, MAP часто фенотипически неотличим от ослабленного FAP. Однако, в отличие от FAP, мутации гена APC у пациентов с MAP отсутствуют. Кроме того, зазубренные полипы (гиперпластические и зазубренные полипы на животе) часто встречаются у пациентов с MAP (89), что можно спутать с зазубренным полипозом (описанным ниже).Кроме того, из-за своего рецессивного типа наследования, MAP имеет тенденцию пропускать поколения, что затрудняет идентификацию пациентов с MAP, поскольку многие пациенты, по-видимому, представляют собой спорадические случаи.
Зубчатый полипоз
Зубчатый полипоз — это новый термин, используемый ВОЗ, который исторически назывался гиперпластическим полипозом (40). Он определяется: (I) как минимум 5 зубчатыми полипами проксимальнее сигмовидной кишки с 2 или более полипами> 1 см; (II) любое количество зубчатых полипов проксимальнее сигмовидной кишки у человека, у которого есть родственник первой степени родства с зубчатым полипозом; или (III)> 20 зубчатых полипов любого размера по всей толстой кишке.Полипы могут быть как SSA / Ps, так и HP.
Дисплазия высокой степени
Патологическая оценка аденоматозного полипа и дисплазии включает определение наличия или отсутствия дисплазии высокой степени, которая является непосредственным предшественником инвазивной колоректальной аденокарциномы. Дисплазия высокой степени проявляется как сочетание архитектурной сложности и цитологической атипии, которые имеют более злокачественный вид, чем те, которые наблюдаются при обычной аденоме (). С архитектурной точки зрения, области с высоким содержанием обычно демонстрируют повышенную железистую плотность с переполненными железами, имеющими решетчатую структуру или структуру роста спина к спине.Цитологически клетки с дисплазией высокой степени проявляют округлые ядра, грубый хроматин, заметные ядрышки и потерю ядерной полярности, при этом ядра больше не ориентированы перпендикулярно базальной мембране. В просвете диспластических желез можно увидеть некротический мусор.
Дисплазия высокой степени со сложной архитектурой и выраженной ядерной атипией (исходное увеличение × 400)
Дисплазия высокой степени обычно является очаговой и располагается на поверхностной части полипа и, следовательно, не требует дополнительного лечения, кроме полипэктомии, если полип полностью удален эндоскопически.Как обсуждалось ранее, дисплазия толстой кишки высокой степени является синонимом карциномы in situ или интраэпителиальной карциномы. Внутримукозная аденокарцинома, определяемая инвазией собственной пластинки, включая инвазию в (но не через) слизистую оболочку мышечной ткани, по-прежнему относится к категории дисплазии высокой степени из-за ее незначительного потенциала метастазирования и может успешно лечиться только полипэктомией (90).
Злокачественный полип
Термин злокачественный полип используется для описания полипа, который содержит инвазивную аденокарциному в подслизистой оболочке.Предыдущие исследования показали распространенность 2-5% аденом, удаленных эндоскопически (91). При обнаружении злокачественного полипа необходимо оценить несколько критических гистологических характеристик, которые включают состояние края резекции, гистологический класс и наличие или отсутствие лимфоваскулярной инвазии. Эти факторы связаны с риском неблагоприятных исходов, таких как метастазирование в лимфоузлы и / или местный рецидив после полипэктомии. Полипы с отрицательным краем полипэктомии, низкой степенью гистологии и отсутствием лимфоваскулярной инвазии можно безопасно лечить с помощью эндоскопической полипэктомии.Было показано, что повышенный риск неблагоприятных исходов связан с положительной границей (определяемой как <2 мм от глубокого прижженного края) (), гистологией высокой степени (плохо дифференцированной) и лимфоваскулярной инвазией. Если присутствует какая-либо из этих особенностей, показана хирургическая резекция (91-93). Поэтому важно, чтобы образцы для полипэктомии были получены одним целым, чтобы патологоанатомы могли точно оценить края. Невозможность оценить краевой статус из-за частичной резекции также следует рассматривать как фактор риска (91,93), и хирургическая резекция может быть рекомендована клинически здоровым пациентам.
Злокачественный полип, показывающий аденокарциноматозные железы, присутствующие в пределах 1 мм от края полипэктомии (исходное увеличение × 100)
Ловушка при оценке аденоматозного полипа — это псевдоинвазия, при которой аденоматозные элементы смещены или грыжа в такой подслизистой основе, обычно вторично по отношению к такой травматизации как скручивание, так и перекручивание стебля (). Гистологические признаки, которые помогают отличить от истинной инвазии, включают лобулярную конфигурацию грыжевых элементов, отсутствие явной архитектурной и цитологической атипии высокой степени, наличие края воспалительных клеток собственной пластинки вокруг захваченных элементов, отсутствие десмопластической реакции, отсутствие прямого контакта с подслизистой оболочкой. мышечные сосуды и наличие гемосидерина или кровоизлияния.Иногда грыжи аденоматозных желез имеют высокую гистологию, которую еще труднее отличить от инвазивной аденокарциномы. Однако другие гистологические признаки, способствующие псевдоинвазии, могут все еще присутствовать. В редких случаях, когда невозможно провести однозначное различие, может быть рассмотрена полная полипэктомия или хирургическая резекция в зависимости от клинических и эндоскопических условий пациента.
Низкое увеличение (A. исходное увеличение × 40) и высокое увеличение (B.исходное увеличение × 200) виды псевдоинвазии в трубчатую аденому. Обратите внимание на наличие кровоизлияния и гемосидерина.
Патогенез и молекулярная классификация
Колоректальный рак представляет собой гетерогенную группу заболеваний с характерным генетическим и эпигенетическим фоном (94). Чтобы улучшить клиническое ведение и лучше предсказать исход болезни, были предприняты попытки классифицировать колоректальный рак на основе локализации, гистологии, этиологических факторов и молекулярных механизмов онкогенеза.Еще в 1980-х годах было признано, что рак, возникающий в проксимальных и дистальных отделах толстой кишки, связан с различными генетическими механизмами (95,96). Например, синдром Линча преимущественно поражает проксимальный отдел ободочной кишки, тогда как при FAP больше полипов наблюдается в левой ободочной кишке. Эти семейные формы колоректального рака послужили прототипами для понимания различных молекулярных механизмов онкогенеза. Как обсуждалось ранее, синдром Линча возникает в результате потери функции одного из генов MMR и следует пути MSI («мутаторный» путь).Напротив, FAP возникает у пациентов с наследственными мутациями в гене APC , который был центром исходной модели Fearon-Vogelstein колоректального туморогенеза (97), которая составляет основу пути хромосомной нестабильности (CIN) («супрессор»). путь).
Пути MSI и CIN описывают патогенез колоректального рака, основанный на генетических аномалиях, которые приводят к потере функции генов-супрессоров опухоли и / или усилению функции онкогенов. В последнее десятилетие эпигенетическая нестабильность привлекла значительное внимание и теперь считается, что она участвует в патогенезе почти одной трети случаев колоректального рака (49).Помимо последовательности и структуры ДНК, экспрессия генов контролируется рядом эпигенетических модификаций, которые включают метилирование ДНК, изменения гистонов и ремоделирование хроматина (98). Одной из наиболее охарактеризованных эпигенетических модификаций, связанных с колоректальным онкогенезом, является подавление генов (генов супрессоров опухолей и / или генов MMR) посредством гиперметилирования их промоторных областей. Хотя обсуждался вопрос о том, представляет ли феномен эпигенетической нестабильности адаптивный клеточный механизм во время канцерогенеза, направленный на прекращение клеточной пролиферации, вторичное изменение еще не идентифицированных генетических мутаций, явление, которое, как ожидается, произойдет во время старения опухолевых клеток, или просто артефакт (99-104 ), подавление транскрипции определенных генов за счет гиперметилирования, несомненно, приводит к развитию опухоли (105-110).В частности, гиперметилирование промотора MLh2 , одного из генов MMR, продемонстрировано в большинстве спорадических колоректальных опухолей с фенотипом MSI (108,111,112). Поскольку многие гены богаты цитозиновыми и гуаниновыми динуклеотидами (CpG-островки) в своих промоторах, метилирование остатков цитозина в CpG-островках является обычным явлением, которое приводит к изменениям хромосомной структуры и подавлению экспрессии генов. Колоректальный рак с фенотипом метилирования островков CpG (CIMP) характеризуется эпигенетической потерей функции генов-супрессоров опухолей без мутаций (49,113).
обобщает текущее понимание молекулярных путей, участвующих в колоректальном онкогенезе. Путь CIN участвует как в спорадическом, так и в синдромальном колоректальном раке. Опухоли CIN характеризуются кариотипическими аномалиями и хромосомными прибавками и потерями, которые можно оценить с помощью анализа плоидности ДНК или потери гетерозиготности (LOH). Эти опухоли почти всегда содержат мутации APC , часто обнаруживают мутации KRAS и p53 и часто имеют аллельную потерю 18q (3,94).Путь MSI также вовлечен как в спорадический, так и в синдромный колоректальный рак и имеет тенденцию быть взаимоисключающим с CIN. Как обсуждалось ранее, опухоли MSI характеризуются потерей функции восстановления несоответствия ДНК. При спорадическом колоректальном раке потеря функции в первую очередь связана с метилированием промотора гена MLh2 , что приводит к эпигенетическому ингибированию экспрессии белка MLh2 и его партнера по связыванию PMS2. Эти опухоли часто обнаруживают мутацию BRAF , но лишь в редких случаях мутации KRAS .При синдроме Линча потеря функции обычно является результатом мутаций зародышевой линии в одном из генов MMR. Эти опухоли никогда не содержат мутаций BRAF . Наконец, путь CIMP представляет собой уникальный молекулярный механизм в колоректальном онкогенезе, который может возникать как в опухолях MSI-H, так и в опухолях MSS.
Молекулярные пути в колоректальном онкогенезе. CRC, колоректальный рак; MSS, микроспутник стабильный; MSI-H, микроспутниковая нестабильность высокого уровня; FAP, семейный аденоматозный полипоз; AFAP, ослабленный FAP; PJS, синдром Пейтца-Егерса; JPS, синдром ювенильного полипоза; MAP, MUTYH-ассоциированный полипоз; CIN, путь хромосомной нестабильности; MSI, микроспутниковая нестабильность; CIMP, фенотип метилатора CpG-островков; ?, пути пока не определены
Молекулярно-генетическое тестирование
С быстрым прогрессом в понимании колоректального туморогенеза и фармакогенетики, требуется все больше и больше молекулярных и генетических тестов, чтобы оптимально разработать индивидуальную терапию для отдельных пациентов, чтобы лучше предсказать прогноз пациента, и более точно определить необходимость семейного консультирования.В настоящее время MSI, KRAS и BRAF являются наиболее часто используемыми тестами в лабораториях патологии.
MSI testing
Как обсуждалось ранее, опухоли MSI составляют ~ 15% колоректальных аденокарцином. Эти опухоли, как правило, демонстрируют уникальные клинико-патологические особенности, имеют тенденцию иметь лучший прогноз со скорректированной стадией по сравнению с опухолями MSS и, по-видимому, устойчивы к лечению 5-фторурацилом (114).
Микросателлиты — это повторяющиеся последовательности ДНК, которые подвержены ошибкам во время репликации ДНК, если система MMR неисправна.MSI определяется как изменение длины микросателлитных последовательностей. Его обычно оценивают путем анализа двух мононуклеотидных повторов (BAT-25 и BAT-26) и трех динуклеотидных повторов (D2S123, D5S346 и D17S250), известных как панель Bethesda (61, 115), путем сравнения образцов ДНК, извлеченных из нормальных и опухолевых клеток. ткани того же пациента. Тест основан на полимеразной цепной реакции (ПЦР) и может проводиться на фиксированных формалином тканях, залитых парафином. Опухоль обозначается как MSI-H, если два или более (> 40%) из пяти микросателлитных маркеров показывают нестабильность, MSI-L (низкий уровень), если только один маркер показывает нестабильность, или MSS, если ни один из маркеров не показывает нестабильность.Клиническое значение MSI-L остается неясным и противоречивым (116), и может быть полезно, если будут протестированы дополнительные микросателлитные маркеры, чтобы повысить точность классификации MSI.
Непрямой анализ статуса MSI может быть выполнен с помощью иммуногистохимического окрашивания белков MMR. Эти белки повсеместно присутствуют в нормальных клетках, но обнаруживают потерю экспрессии в опухолевых клетках MSI. Можно наблюдать несколько паттернов окрашивания на основе лежащих в основе генетических или эпигенетических аномалий ().Интересно отметить, что потеря экспрессии белка MLh2 всегда сопровождается потерей его партнера по связыванию PMS2 (), но потеря экспрессии PMS2 может происходить сама по себе. То же самое верно для MSh3 и его партнера по связыванию MSH6.
Таблица 3
Иммуногистохимические образцы окрашивания и интерпретация для белков MMR
| MLh2 | MSh3 | MSH6 | PMS2 | Интерпретация + | + | Неповрежденный MMR * | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| — | + | + | — | MLh2 зародышевые мутации или гиперметилирование | + | Мутация зародышевой линии MSH3 | |||||||||
| + | + | — | + | MSH6 мутация зародышевой линии | Мутация зародышевой линии PMS2 |
A MSI tumo r показывает потерю экспрессии белков MLh2 (A) и PMS2 (D) и нормальную экспрессию MSh3 (B) и MSH6 (C).Обратите внимание на наличие положительного окрашивания в доброкачественных криптах толстой кишки и воспалительных клетках, которые служат хорошим внутренним контролем для окрашивания (исходное увеличение × 200)
Чувствительность теста MSI на основе ПЦР с использованием панели Bethesda колеблется от 55% до 84%. для обнаружения мутаций в разных генах MMR. Чувствительность повышается, если используются три или более маркера мононуклеотидных повторов. Специфичность теста MSI составляет 90%. Иммуногистохимия была признана надежной заменой MSI с уровнем соответствия> 90%.Он также предоставляет дополнительную информацию о тесте MSI на основе ПЦР, поскольку позволяет анализировать ген-специфическую последовательность ДНК на основе образца окрашивания. Однако иммуногистохимия может пропустить редкие случаи MSI, вызванные мутациями зародышевой линии другими генами, и не отличить мутацию зародышевой линии от эпигенетических изменений при обнаружении потери экспрессии белка MLh2. Таким образом, самой последней рекомендацией является выполнение как теста MSI на основе ПЦР, так и иммуногистохимии, чтобы свести к минимуму вероятность пропуска диагноза синдрома Линча (117).Также в последнее время рекомендуется тестировать все впервые диагностированные колоректальные опухоли независимо от возраста пациента и семейного анамнеза, поскольку около 25% пациентов с синдромом Линча не соответствуют критериям Амстердама II или рекомендациям Bethesda (117). В этих условиях можно выполнить только один тест, иммуногистохимический или MSI-анализ, поскольку стоимость тестов станет проблемой.
Тестирование KRAS
Мутации в гене KRAS (гомолог вирусного онкогена саркомы крысы Кирстен) приводят к экспрессии конститутивно активированного белка KRAS, который обнаруживается примерно в 40% случаев колоректального рака (2118).Мутант KRAS , являющийся критически важной молекулой в сигнальном пути рецептора эпидермального фактора роста (EGFR), делает опухоли устойчивыми к терапии, направленной на EGFR (2,119-121). В результате Американское общество клинической онкологии (ASCO) и Национальная комплексная сеть рака (NCCN) рекомендовали анализ мутаций гена KRAS пациентам-кандидатам, которые будут получать терапию против EGFR (122, 123).
Более 95% мутаций KRAS встречаются в кодонах 12 и 13 экзона 2 (118,124,125), и, таким образом, основанные на ПЦР методологии, разработанные для обнаружения мутаций KRAS , предназначены в первую очередь для этих мутаций.Мутации также могут происходить в других локусах, таких как кодоны 61 и 146 (126), но они, как правило, не подвергаются скринингу из-за редкости. Клинически доступные методы ПЦР в реальном времени включают анализ аллель-специфической амплификации и анализ кривой плавления после ПЦР. Метод аллель-специфической ПЦР в реальном времени обнаруживает семь наиболее распространенных мутаций в кодонах 12 и 13 (127), тогда как анализ кривой плавления обнаруживает все возможные мутации в этих двух кодонах (128,129).
Другой метод обнаружения — это секвенирование ДНК, которое может обнаруживать все возможные мутации в гене KRAS , не ограничиваясь только кодонами 12 и 13.По сравнению с традиционным методом секвенирования по Сэнгеру технология пиросеквенирования предлагает более высокую аналитическую чувствительность и более выгодна для анализа образцов ДНК, выделенных из блоков ткани, залитых парафином (130, 131).
Тестирование BRAF
Помимо KRAS , мутации в других членах сигнального пути EGFR также могут вызывать устойчивость к терапии против EGFR. Хорошим примером является мутация гена BRAF (гомолог B1 вирусного онкогена мышиной саркомы v-raf), о которой сообщалось примерно в 10% случаев колоректального рака (132–134).Есть несколько интересных фактов о мутации BRAF при колоректальном раке. Во-первых, активирующие мутации BRAF и KRAS почти всегда являются взаимоисключающими (135, 136), и, таким образом, тестирование мутации гена BRAF следует рассматривать после отрицательного анализа мутации KRAS . Фактически, многие лаборатории предлагают тест reflex BRAF , если в образце не обнаружена мутация KRAS . Во-вторых, почти все мутации BRAF идентичны точечной мутации V600E (134), которую можно легко обнаружить с помощью ряда коммерчески доступных анализов на основе ПЦР (137).В-третьих, мутация BRAF почти исключительно наблюдается в спорадических опухолях MSI, которые, как предполагается, развиваются по зубчатому канцерогенному пути, но никогда не наблюдались при синдроме Линча (138). Более конкретно, активирующая мутация гена BRAF связана с высоким уровнем глобального метилирования ДНК и эпигенетическим подавлением гена MLh2, обнаруживаемым в 70-90% спорадических колоректальных опухолей с микросателлитным нестабильным фенотипом (136, 139). Следовательно, дальнейшее тестирование мутации BRAF в опухоли MSI поможет прояснить спорадическую или синдромальную природу опухоли (140).В-четвертых, влияние мутации BRAF на прогноз оказывается зависимым от MSI. Как и ожидалось, опухоли BRAF MSI-H дикого типа имеют лучший прогноз, тогда как опухоли MSS с мутацией BRAF связаны с наихудшим исходом. Опухоль BRAF с мутацией MSI-H и опухоль BRAF MSS дикого типа являются промежуточными с точки зрения прогноза (132 133). Таким образом, тестирование на аномалии MMR и мутации BRAF дает дополнительную прогностическую информацию.
Выводы
Колоректальная аденокарцинома — это гетерогенное заболевание, которое включает несколько канцерогенных путей. Патологический анализ предоставляет гистологическую и молекулярную информацию, важную для соответствующего лечения пациента, оценки прогноза и семейного консультирования. Дальнейшее понимание молекулярных механизмов онкогенеза, безусловно, приведет к разработке новых целевых методов лечения и новых молекулярных тестов, которые в конечном итоге принесут пользу пациентам и их семьям.
Благодарности
Раскрытие информации: Авторы заявляют об отсутствии конфликта интересов.
Ссылки
1. Siegel R, Ward E, Brawley O, et al. Статистика рака, 2011 г .: влияние устранения социально-экономических и расовых различий на преждевременную смерть от рака. CA Cancer J Clin 2011; 61: 212-36 [PubMed] [Google Scholar] 2. Ван Х.Л., Лопатеги Дж., Амин М.Б. и др. Тестирование мутации KRAS при раке человека: роль патолога в эпоху персонализированной медицины. Adv Anat Pathol 2010; 17: 23-32 [PubMed] [Google Scholar] 3.Гамильтон С.Р., Босман Ф.Т., Боффетта П. и др. Рак толстой и прямой кишки. В: Классификация опухолей пищеварительной системы ВОЗ. Bosman FT, Carneiro F, Hruban RH, Theise ND, ред. Лион: IARC Press, 2010: 134-46. [Google Scholar] 4. Комптон С.С., Филдинг Л.П., Бургарт Л.Дж. и др. Факторы прогноза при колоректальном раке. Консенсусное заявление Колледжа американских патологов 1999 г. Arch Pathol Lab Med 2000; 124: 979-94 [PubMed] [Google Scholar] 5. Compton CC. Обновленный протокол исследования образцов от пациентов с карциномами толстой и прямой кишки, за исключением карциноидных опухолей, лимфом, сарком и опухолей червеобразного отростка: основа для контрольных списков.Онкологический комитет. Arch Pathol Lab Med 2000; 124: 1016-25 [PubMed] [Google Scholar] 7. Джасс Дж. Р., Аткин В. С., Кузик Дж. И др. Классификация рака прямой кишки: исторические перспективы и многомерный анализ 447 случаев. Гистопатология 1986; 10: 437-59 [PubMed] [Google Scholar] 8. Compton CC. Отчет о патологии при раке толстой кишки: что прогностически важно? Dig Dis 1999; 17: 67-79 [PubMed] [Google Scholar] 9. Эдж С.Б., Берд Д.Р., Комптон С.С. и др. Справочник по стадированию рака AJCC, 7-е издание. Нью-Йорк: Springer, 2010: 173-206.[Google Scholar] 10. Ферхюльст Дж., Фердинанда Л., Деметтер П. и др. Муцинозный подтип как прогностический фактор колоректального рака: систематический обзор и метаанализ. J Clin Pathol 2012; 65: 381-8 [PubMed] [Google Scholar] 11. Канг Х., О’Коннелл Дж. Б., Маггард М.А. и др. 10-летняя оценка результатов муцинозной и перстневидноклеточной карциномы толстой и прямой кишки. Dis Colon Rectum 2005; 48: 1161-8 [PubMed] [Google Scholar] 12. Леопольдо С., Лорена Б., Чинция А. и др. Два подтипа муцинозной аденокарциномы толстой кишки: клинико-патологические и генетические особенности.Энн Сург Онкол 2008; 15: 1429-39 [PubMed] [Google Scholar] 13. Chen JS, Hsieh PS, Chiang JM, et al. Клинические исходы карциномы перстневых клеток и муцинозной аденокарциномы толстой кишки. Chang Gung Med J 2010; 33: 51-7 [PubMed] [Google Scholar] 14. Макино Т., Цудзинака Т., Мисима Х. и др. Первичная клеточная карцинома толстой и прямой кишки: отчет о восьми случаях и обзор 154 случаев в Японии. Гепатогастроэнтерология 2006; 53: 845-9 [PubMed] [Google Scholar] 15. Тирунавукарасу П., Сатаиа М., Сингла С. и др.Медуллярный рак толстой кишки: популяционный анализ. Int J Oncol 2010; 37: 901-7 [Бесплатная статья PMC] [PubMed] [Google Scholar] 16. Хинои Т., Тани М., Лукас П.С. и др. Потеря экспрессии CDX2 и микросателлитная нестабильность являются характерными чертами крупноклеточных минимально дифференцированных карцином толстой кишки. Am J Pathol 2001; 159: 2239-48 [Бесплатная статья PMC] [PubMed] [Google Scholar] 17. Александр Дж., Ватанабе Т., Ву Т.Т. и др. Гистопатологическая идентификация рака толстой кишки с микросателлитной нестабильностью.Am J Pathol 2001; 158: 527-35 [Бесплатная статья PMC] [PubMed] [Google Scholar] 18. Чу П.Г., Вайс Л.М. Экспрессия кератина в тканях и новообразованиях человека. Гистопатология 2002; 40: 403-39 [PubMed] [Google Scholar] 19. МакГрегор Д.К., Ву Т.Т., Рашид А. и др. Снижение экспрессии цитокератина 20 при колоректальных карциномах с высоким уровнем микросателлитной нестабильности. Am J Surg Pathol 2004; 28: 712-8 [PubMed] [Google Scholar] 20. Верлинг Р.В., Язиджи Х., Бакки С.Е. и др. CDX2, высокочувствительный и специфический маркер аденокарцином кишечного происхождения: иммуногистохимическое исследование 476 первичных и метастатических карцином.Am J Surg Pathol 2003; 27: 303-10 [PubMed] [Google Scholar] 21. Каймакчиев В., Терраччиано Л., Торнилло Л. и др. Гомеобоксный фактор кишечной дифференциации CDX2 избирательно экспрессируется в аденокарциномах желудочно-кишечного тракта. Mod Pathol 2004; 17: 1392-9 [PubMed] [Google Scholar] 22. Шеперд Н.А., Бакстер К.Дж., Лав С.Б. Прогностическое значение вовлечения брюшины в рак толстой кишки: проспективная оценка. Гастроэнтерология 1997; 112: 1096-102 [PubMed] [Google Scholar] 24. Нельсон Х., Петрелли Н., Карлин А. и др.Рекомендации 2000 г. по хирургии рака прямой и толстой кишки. J Natl Cancer Inst 2001; 93: 583-96 [PubMed] [Google Scholar] 25. Ван Х., Сафар Б., Векснер С.Д. и др. Клиническое значение удаления жировых лимфатических узлов при инвазивной аденокарциноме прямой кишки после неоадъювантной терапии. Dis Colon Rectum 2009; 52: 1767-73 [PubMed] [Google Scholar] 26. Эрнанц Ф., Гарсия-Сомакаррера Э., Фернандес Ф. Оценка лимфатических узлов, пропущенных в брыжеечной ткани после стандартного вскрытия образцов колоректального рака.Colorectal Dis 2010; 12: e57-e60 [PubMed] [Google Scholar] 27. Märkl B, Kerwel TG, Jähnig HG и др. Диссекция лимфатических узлов с применением метиленового синего в образцах толстой кишки: проспективное рандомизированное исследование. Am J Clin Pathol 2008; 130: 913-9 [PubMed] [Google Scholar] 28. Кервел Т.Г., Спатц Дж., Антхубер М. и др. Введение метиленового синего в нижнюю брыжеечную артерию обеспечивает адекватный забор лимфатических узлов и устраняет патологическую вариабельность узловой стадии рака прямой кишки. Dis Colon Rectum 2009; 52: 935-41 [PubMed] [Google Scholar] 29.Fan L, Levy M, Aguilar CE и др. Извлечение лимфатических узлов из образцов колоректальной резекции аденокарциномы: стоит ли прилагать дополнительные усилия, чтобы найти как минимум 12 узлов? Colorectal Dis 2011; 13: 1377-83 [PubMed] [Google Scholar] 30. Шен С.С., Haupt BX, Ro JY и др. Количество исследованных лимфатических узлов и связанные с ними клинико-патологические факторы колоректальной карциномы. Arch Pathol Lab Med 2009; 133: 781-6 [PubMed] [Google Scholar] 31. Моркос Б., Бейкер Б., Аль Масри М. и др. Выход лимфатических узлов в хирургии рака прямой кишки: эффект предоперационной химиолучевой терапии.Eur J Surg Oncol 2010; 36: 345-9 [PubMed] [Google Scholar] 32. Marks JH, Valsdottir EB, Rather AA и др. После высокодозной химиолучевой терапии рака прямой кишки в хирургическом образце можно ожидать менее 12 лимфатических узлов. Dis Colon Rectum 2010; 53: 1023-9 [PubMed] [Google Scholar] 33. Lo DS, Pollett A, Siu LL, et al. Прогностическое значение узелков брыжеечной опухоли у пациентов с колоректальным раком III стадии. Рак 2008; 112: 50-4 [PubMed] [Google Scholar] 34. Puppa G, Maisonneuve P, Sonzogni A и др.Патологическая оценка периколонических опухолевых отложений при распространенной карциноме толстой кишки: актуальность для прогноза и стадии опухоли. Mod Pathol 2007; 20: 843-55 [PubMed] [Google Scholar] 35. Winawer SJ, Zauber AG, Ho MN, et al. Профилактика колоректального рака с помощью колоноскопической полипэктомии: Национальная рабочая группа по изучению полипов. N Engl J Med 1993; 329: 1977-81 [PubMed] [Google Scholar] 36. Заубер А.Г., Винавер С.Дж., О’Брайен М.Дж. и др. Колоноскопическая полипэктомия и долгосрочное предотвращение смерти от колоректального рака. N Engl J Med 2012; 366: 687-96 [Бесплатная статья PMC] [PubMed] [Google Scholar] 37.Кинзлер К.В., Фогельштейн Б. Уроки наследственного колоректального рака. Cell 1996; 87: 159-70 [PubMed] [Google Scholar] 39. Heitman SJ, Ronksley PE, Hilsden RJ, et al. Распространенность аденом и колоректального рака у лиц среднего риска: систематический обзор и метаанализ. Clin Gastroenterol Hepatol 2009; 7: 1272-8 [PubMed] [Google Scholar] 40. Сновер, округ Колумбия, Анен Д. Д., Берт Р. В. и др. Зубчатые полипы толстой и прямой кишки и зубчатые полипы. В: Классификация опухолей пищеварительной системы ВОЗ.Bosman FT, Carneiro F, Hruban RH, Theise ND, ред. Лион: IARC Press, 2010: 160-5. [Google Scholar] 41. Цай CJ, Лу ДК. Малые колоректальные полипы: гистопатология и клиническое значение. Am J Gastroenterol 1995; 90: 988-94 [PubMed] [Google Scholar] 42. Сновер Д.К., Ясс Дж. Р., Феноглио-Прейзер С. и др. Зазубренные полипы толстой кишки: морфологический и молекулярный обзор развивающейся концепции. Am J Clin Pathol 2005; 124: 380-91 [PubMed] [Google Scholar] 43. Торлакович Э., Сковлунд Э., Сновер Д.К. и др. Морфологическая переоценка зубчатых колоректальных полипов.Am J Surg Pathol 2003; 27: 65-81 [PubMed] [Google Scholar] 44. Гольдштейн Н.С., Бханот П., Одиш Э. и др. Гиперпластические полипы толстой кишки, предшествовавшие микросателлитно-нестабильным аденокарциномам. Am J Clin Pathol 2003; 119: 778-96 [PubMed] [Google Scholar] 45. East JE, Saunders BP, Jass JR. Спорадические и синдромальные гиперпластические полипы и зубчатые аденомы толстой кишки: классификация, молекулярная генетика, естественное течение и клиническое ведение. Gastroenterol Clin North Am 2008; 37: 25-46 [PubMed] [Google Scholar] 46.Глатц К., Притт Б., Глатц Д. и др. Многонациональная интернет-оценка вариабельности наблюдателя при диагностике зубчатых колоректальных полипов. Am J Clin Pathol 2007; 127: 938-45 [PubMed] [Google Scholar] 47. Фаррис А.Б., Мисдраджи Дж., Шривастава А. и др. Сессильная зубчатая аденома: проблема отличия от других зубчатых полипов толстой кишки. Am J Surg Pathol 2008; 32: 30-5 [PubMed] [Google Scholar] 48. Вонг Н.А., Хант Л.П., Novelli MR и др. Согласие наблюдателя в диагностике зубчатых полипов толстой кишки.Гистопатология 2009; 55: 63-6 [PubMed] [Google Scholar] 49. Сновер, округ Колумбия. Обновленная информация о зубчатом пути к колоректальной карциноме. Hum Pathol 2011; 42: 1-10 [PubMed] [Google Scholar] 50. Vu HT, Lopez R, Bennett A, et al. Люди с зубчатыми полипами на сидячем месте проявляют агрессивный колоректальный фенотип. Dis Colon Rectum 2011; 54: 1216-23 [PubMed] [Google Scholar] 51. Blackstone MO, Riddell RH, Rogers BH и др. Поражение или образование, связанное с дисплазией (DALM), обнаруженное с помощью колоноскопии при длительном язвенном колите: показание к колэктомии.Гастроэнтерология 1981; 80: 366-74 [PubMed] [Google Scholar] 52. Батт Дж. Х., Кониси Ф., Морсон BC и др. Макроскопические поражения при дисплазии и карциноме, осложняющие язвенный колит. Dig Dis Sci 1983; 28: 18-26 [PubMed] [Google Scholar] 53. Рубин PH, Фридман С., Харпаз Н. и др. Колоноскопическая полипэктомия при хроническом колите: консервативное лечение после эндоскопической резекции диспластических полипов. Гастроэнтерология 1999; 117: 1295-300 [PubMed] [Google Scholar] 54. Engelsgjerd M, Farraye FA, Odze RD. Полипэктомия может быть адекватным лечением аденомоподобных диспластических поражений при хроническом язвенном колите.Гастроэнтерология 1999; 117: 1288-94 [PubMed] [Google Scholar] 55. Odze RD, Farraye FA, Hecht JL, et al. Долгосрочное наблюдение после лечения полипэктомии по поводу аденомоподобных диспластических поражений при язвенном колите. Clin Gastroenterol Hepatol 2004; 2: 534-41 [PubMed] [Google Scholar] 56. Ицковиц Ш., Присутствует DH. Консенсусная конференция: скрининг колоректального рака и наблюдение за воспалительными заболеваниями кишечника. Воспаление кишечника 2005; 11: 314-21 [PubMed] [Google Scholar] 57. Линч Х.Т., де ла Шапель А. Наследственный колоректальный рак.N Engl J Med 2003; 348: 919-32 [PubMed] [Google Scholar] 58. Стоффель Э., Мукерджи Б., Раймонд В.М. и др. Расчет риска колоректального рака и рака эндометрия у пациентов с синдромом Линча. Гастроэнтерология 2009; 137: 1621-7 [Бесплатная статья PMC] [PubMed] [Google Scholar] 59. Хампель Х., Франкель В.Л., Мартин Э. и др. Скрининг на синдром Линча (наследственный неполипозный колоректальный рак). N Engl J Med 2005; 352: 1851-60 [PubMed] [Google Scholar] 60. Vasen HF, Watson P, Mecklin JP и др. Новые клинические критерии наследственного неполипозного колоректального рака (HNPCC, синдром Линча), предложенные Международной совместной группой по HNPCC.Гастроэнтерология 1999; 116: 1453-6 [PubMed] [Google Scholar] 61. Умар А., Боланд ЧР, Тердиман Дж. П. и др. Пересмотренные рекомендации Bethesda по наследственному неполипозному колоректальному раку (синдром Линча) и микросателлитной нестабильности. J Natl Cancer Inst 2004; 96: 261-8 [Бесплатная статья PMC] [PubMed] [Google Scholar] 62. Бьорк Дж., Акербрант Х., Иселиус Л. и др. Эпидемиология семейного аденоматозного полипоза в Швеции: изменения во времени и различия в фенотипе между мужчинами и женщинами. Сканд Дж. Гастроэнтерол 1999; 34: 1230-5 [PubMed] [Google Scholar] 64.Галиатсатос П., Фоулкс В.Д. Семейный аденоматозный полипоз. Am J Gastroenterol 2006; 101: 385-98 [PubMed] [Google Scholar] 66. Берт RW. Полипы фундальной железы желудка. Гастроэнтерология 2003; 125: 1462-9 [PubMed] [Google Scholar] 67. Bianchi LK, Burke CA, Bennett AE и др. Дисплазия полипа фундальной железы часто встречается при семейном аденоматозном полипозе. Clin Gastroenterol Hepatol 2008; 6: 180-5 [PubMed] [Google Scholar] 68. Ву Т.Т., Корнацкий С., Рашид А. и др. Дисплазия и нарушение регуляции пролиферации фовеолярного и поверхностного эпителия полипов фундальных желез у пациентов с семейным аденоматозным полипозом.Am J Surg Pathol 1998; 22: 293-8 [PubMed] [Google Scholar] 69. Hassan A, Yerian LM, Kuan SF, et al. Иммуногистохимическая оценка экспрессии аденоматозного полипоза кишечной палочки, бета-катенина, c-Myc, циклина D1, p53 и белка ретинобластомы в синдромальных и спорадических полипах фундальной железы. Hum Pathol 2004; 35: 328-34 [PubMed] [Google Scholar] 70. Giardiello FM, Burt RW, Jävinen HJ, et al. Семейный аденоматозный полипоз. В: Классификация опухолей пищеварительной системы ВОЗ. Bosman FT, Carneiro F, Hruban RH, Theise ND, ред.Лион: IARC Press, 2010: 147-51. [Google Scholar] 71. Берт Р.В., Лепперт М.Ф., Слэттери М.Л. и др. Генетическое тестирование и фенотип в большом родстве с ослабленным семейным аденоматозным полипозом. Гастроэнтерология 2004; 127: 444-51 [PubMed] [Google Scholar] 72. Laurent-Puig P, Béroud C, Soussi T.APC gene: база данных зародышевых и соматических мутаций в опухолях и клеточных линиях человека. Nucleic Acids Res 1998; 26: 269-70 [Бесплатная статья PMC] [PubMed] [Google Scholar] 73. Миёси Й., Андо Х., Нагасе Х. и др. Зародышевые мутации гена APC у 53 больных семейным аденоматозным полипозом.Proc Natl Acad Sci USA 1992; 89: 4452-6 [Бесплатная статья PMC] [PubMed] [Google Scholar] 74. Аоки К., Такето ММ. Аденоматозный полипоз кишечной палочки (APC): многофункциональный ген-супрессор опухоли. J Cell Sci 2007; 120: 3327-35 [PubMed] [Google Scholar] 75. Копачова М., Тачечи И., Рейхрт С. и др. Синдром Пейтца-Егерса: диагностический и терапевтический подход. World J Gastroenterol 2009; 15: 5397-408 [Бесплатная статья PMC] [PubMed] [Google Scholar] 76. ван Лиер М.Г., Вагнер А., Матус-Флиген Е.М. и др. Высокий риск рака при синдроме Пейтца-Егерса: систематический обзор и рекомендации по надзору.Am J Gastroenterol 2010; 105: 1258-64 [PubMed] [Google Scholar] 77. Хемминки А., Марки Д., Томлинсон И. и др. Ген серин / треонинкиназы, дефектный при синдроме Пейтца-Егерса. Nature 1998; 391: 184-7 [PubMed] [Google Scholar] 78. Jenne DE, Reimann H, Nezu J и др. Синдром Пейтца-Егерса вызван мутациями в новой сериновой треонинкиназе. Нат Генет 1998; 18: 38-43 [PubMed] [Google Scholar] 79. Каруман П., Гозани О., Одзе Р.Д. и др. Продукт гена Пейтца-Егера LKB1 является медиатором р53-зависимой гибели клеток.Mol Cell 2001; 7: 1307-19 [PubMed] [Google Scholar] 82. ван Хаттем В.А., Бросенс Л.А., де Ленг В.В. и др. Большие геномные делеции SMAD4, BMPR1A и PTEN при ювенильном полипозе. Gut 2008; 57: 623-7 [PubMed] [Google Scholar] 83. Наджент К.П., Талбот И.К., Ходжсон С.В. и др. Одиночные ювенильные полипы: не показатель последующего злокачественного новообразования. Гастроэнтерология 1993; 105: 698-700 [PubMed] [Google Scholar] 84. Аль-Тассан Н., Чмиэль Н.Х., Мейнард Дж. И др. Унаследованные варианты MYH, связанные с соматическими мутациями G : C → T : A в колоректальных опухолях.Нат Генет 2002; 30: 227-32 [PubMed] [Google Scholar] 85. Фаррингтон С.М., Тенеса А., Барнетсон Р. и др. Восприимчивость зародышевой линии к колоректальному раку из-за дефектов гена эксцизионной репарации основания. Am J Hum Genet 2005; 77: 112-9 [Бесплатная статья PMC] [PubMed] [Google Scholar] 86. Липтон Л., Томлинсон И. Фенотип множественной колоректальной аденомы и MYH: основной ген эксцизионной репарации. Clin Gastroenterol Hepatol 2004; 2: 633-8 [PubMed] [Google Scholar] 87. Чидл Дж. П., Сэмпсон-младший. MUTYH-ассоциированный полипоз: от дефекта эксцизионной репарации основания до клинического генетического тестирования.Восстановление ДНК (Amst) 2007; 6: 274-9 [PubMed] [Google Scholar] 88. Сэмпсон-младший, Джонс Н. MUTYH-ассоциированный полипоз. Лучшая практика Res Clin Gastroenterol 2009; 23: 209-18 [PubMed] [Google Scholar] 89. Бопараи К.С., Деккер Э., Ван Иден С. и др. Гиперпластические полипы и зубчатые аденомы сидячей кости как фенотипическое проявление MYH-ассоциированного полипоза. Гастроэнтерология 2008; 135: 2014-8 [PubMed] [Google Scholar] 90. Левин М.Р., Фентон Х., Буркарт А.Л. и др. Плохо дифференцированная колоректальная карцинома с инвазией, ограниченной собственной пластинкой (внутрислизистая карцинома): последующее исследование 15 случаев.Am J Surg Pathol 2007; 31: 1882-6 [PubMed] [Google Scholar] 92. Купер Х.С. Патологические проблемы лечения эндоскопически удаленных злокачественных колоректальных полипов. J Natl Compr Canc Netw 2007; 5: 991-6 [PubMed] [Google Scholar] 93. Батт Дж. М., Тан П., Гонен М. и др. Частота резидуальной болезни после полной эндоскопической резекции злокачественного полипа толстой кишки. Dis Colon Rectum 2012; 55: 122-7 [PubMed] [Google Scholar] 95. Bufill JA. Колоректальный рак: данные о различных генетических категориях, основанных на проксимальном или дистальном расположении опухоли.Энн Интерн Мед 1990; 113: 779-88 [PubMed] [Google Scholar] 96. Беарт Р.У., Мелтон Л.Дж., III, Марута М. и др. Тенденции развития рака правой и левой толстой кишки. Dis Colon Rectum 1983; 26: 393-8 [PubMed] [Google Scholar] 97. Фирон ER, Фогельштейн Б. Генетическая модель колоректального туморогенеза. Cell 1990; 61: 759-67 [PubMed] [Google Scholar] 98. Портела А., Эстеллер М. Эпигенетические модификации и болезни человека. Nat Biotechnol 2010; 28: 1057-68 [PubMed] [Google Scholar] 99. Ямасита К., Дай Т., Дай Й и др. Генетика заменяет эпигенетику фенотипа рака толстой кишки.Cancer Cell 2003; 4: 121-31 [PubMed] [Google Scholar] 100. Байлин С, Бестор ТД. Измененные паттерны метилирования в геномах раковых клеток: причина или следствие? Cancer Cell 2002; 1: 299-305 [PubMed] [Google Scholar] 101. Норри М.В., Хокинс Н.Дж., Тодд А.В. и др. Роль метилирования hMLh2 в развитии синхронных спорадических колоректальных карцином. Dis Colon Rectum 2002; 45: 674-80 [PubMed] [Google Scholar] 103. Ахуджа Н, Исса Дж. П. Старение, метилирование и рак. Histol Histopathol 2000; 15: 835-42 [PubMed] [Google Scholar] 104.Xiong Z, Wu AH, Bender CM и др. Дефицит репарации несоответствия и гиперметилирование CpG-островков при спорадических аденокарциномах толстой кишки. Эпидемиологические биомаркеры рака до 2001 г .; 10: 799-803 [PubMed] [Google Scholar] 105. Chen WY, Zeng X, Carter MG и др. Гетерозиготное нарушение Hic1 предрасполагает мышей к половозависимому спектру злокачественных опухолей. Нат Генет 2003; 33: 197-202 [PubMed] [Google Scholar] 106. Кейн М.Ф., Лода М., Гайда Г.М. и др. Метилирование промотора hMLh2 коррелирует с отсутствием экспрессии hMLh2 в спорадических опухолях толстой кишки и дефектных по восстановлению спаривания линиях опухолевых клеток человека.Cancer Res 1997; 57: 808-11 [PubMed] [Google Scholar] 107. Ма А.Х., Ся Л., Литтман С.Дж. и др. Соматическая мутация hPMS2 как возможная причина спорадического рака толстой кишки человека с микросателлитной нестабильностью. Онкоген 2000; 19: 2249-56 [PubMed] [Google Scholar] 108. Вейгл М.Л., Кастури Л., Олехнович Дж. И др. Двуаллельная инактивация hMLh2 путем подавления эпигенетического гена, нового механизма, вызывающего рак MSI у человека. Proc Natl Acad Sci USA 1998; 95: 8698-702 [Бесплатная статья PMC] [PubMed] [Google Scholar] 109. Шен Л., Кондо Ю., Роснер Г.Л. и др.Метилирование промотора MGMT и дефект поля при спорадическом колоректальном раке. J Natl Cancer Inst 2005; 97: 1330-8 [PubMed] [Google Scholar] 110. Bevilacqua RA, Simpson AJ. Метилирование промотора hMLh2, но отсутствие мутаций hMLh2 в спорадических карциномах желудка с высокой микросателлитной нестабильностью. Int J Cancer 2000; 87: 200-3 [PubMed] [Google Scholar] 111. Герман Дж. Г., Умар А., Поляк К. и др. Частота и функциональные последствия гиперметилирования промотора hMLh2 при колоректальной карциноме. Proc Natl Acad Sci USA 1998; 95: 6870-5 [Бесплатная статья PMC] [PubMed] [Google Scholar] 113.Jass JR. Классификация колоректального рака на основе соотношения клинических, морфологических и молекулярных признаков. Гистопатология 2007; 50: 113-30 [PubMed] [Google Scholar] 114. Sinicrope FA, Sargent DJ. Молекулярные пути: микросателлитная нестабильность при колоректальном раке: прогностические, прогностические и терапевтические последствия. Clin Cancer Res 2012; 18: 1506-12 [Бесплатная статья PMC] [PubMed] [Google Scholar] 115. Боланд CR, Тибодо С.Н., Гамильтон С.Р. и др. Семинар Национального института рака по микросателлитной нестабильности для выявления рака и семейной предрасположенности: разработка международных критериев для определения микросателлитной нестабильности при колоректальном раке.Cancer Res 1998; 58: 5248-57 [PubMed] [Google Scholar] 116. Шнайдер Р., Шнайдер С., Клоор М. и др. Синдром Линча: клинические, патологические и генетические наблюдения. Langenbecks Arch Surg 2012; 397: 513-25 [PubMed] [Google Scholar] 117. Вайсман С.М., Берт Р., Черч Дж. И др. Выявление лиц, подверженных риску синдрома Линча, с использованием целевых оценок и генетического тестирования: Национальное общество консультантов по генетическим вопросам и Совместная группа стран Америки по унаследованному колоректальному раку.Дж. Генет Кунс 2012, 21: 484-93 [PubMed] [Google Scholar] 118. Brink M, de Goeij AF, Weijenberg MP, et al. Мутации онкогена K-ras при спорадическом колоректальном раке в когортном исследовании Нидерландов. Канцерогенез 2003; 24: 703-10 [PubMed] [Google Scholar] 119. Lièvre A, Bachet JB, Le Corre D, et al. Статус мутации KRAS позволяет прогнозировать ответ на терапию цетуксимабом при колоректальном раке. Cancer Res 2006; 66: 3992-5 [PubMed] [Google Scholar] 120. Khambata-Ford S, Garrett CR, Meropol NJ, et al. Экспрессия эпирегулина и амфирегулина, а также статус мутации K-ras позволяют прогнозировать контроль заболевания у пациентов с метастатическим колоректальным раком, получавших цетуксимаб.Дж. Клин Онкол 2007; 25: 3230-7 [PubMed] [Google Scholar] 121. Амадо Р.Г., Вольф М., Петерс М. и др. KRAS дикого типа необходим для эффективности панитумумаба у пациентов с метастатическим колоректальным раком. Дж. Клин Онкол 2008; 26: 1626-34 [PubMed] [Google Scholar] 122. Аллегра CJ, Джессап JM, Somerfield MR, et al. Предварительное клиническое заключение Американского общества клинической онкологии: тестирование мутаций гена KRAS у пациентов с метастатической колоректальной карциномой для прогнозирования ответа на терапию моноклональными антителами к рецептору противоэпидермального фактора роста.Дж. Клин Онкол 2009; 27: 2091-6 [PubMed] [Google Scholar] 123. Национальная всеобъемлющая онкологическая сеть. Руководство NCCN по клинической практике в онкологии: рак толстой кишки v.2.2009. Форт Вашингтон, Пенсильвания: Национальная всеобъемлющая онкологическая сеть. 2009. [Google Scholar] 124. Bos JL. Онкогены Ras при раке человека: обзор. Cancer Res 1989; 49: 4682-9 [PubMed] [Google Scholar] 125. Причард С.С., Акаги Л., Редди П.Л. и др. Анализ кривой плавления с помощью COLD-PCR повышает точность диагностики мутаций KRAS при колоректальной карциноме.BMC Clin Pathol 2010; 10: 6. [Бесплатная статья PMC] [PubMed] [Google Scholar] 126. Лупакис Ф., Руццо А., Кремолини С. и др. Мутации кодона KRAS 61, 146 и BRAF предсказывают устойчивость к цетуксимабу плюс иринотекан в кодоне 12 и 13 KRAS метастатического колоректального рака дикого типа. Br J Cancer 2009; 101: 715-21 [Бесплатная статья PMC] [PubMed] [Google Scholar] 127. Клейтон С.Дж., Скотт Ф.М., Уокер Дж. И др. Обнаружение точечной мутации K-ras при раке легких: сравнение двух подходов к обнаружению соматических мутаций с использованием аллель-специфической амплификации ARMS.Clin Chem 2000; 46: 1929-38 [PubMed] [Google Scholar] 128. Elenitoba-Johnson KS, Bohling SD, Wittwer CT, et al. Мультиплексная ПЦР с помощью многоцветной флуориметрии и флуоресцентного анализа кривой плавления. Nat Med 2001; 7: 249-53 [PubMed] [Google Scholar] 129. Монзон Ф.А., Огино С., Хаммонд М.Э. и др. Роль тестирования мутации KRAS в ведении пациентов с метастатическим колоректальным раком. Arch Pathol Lab Med 2009; 133: 1600-6 [PubMed] [Google Scholar] 130. Огино С., Кавасаки Т., Брахмандам М. и др. Чувствительный метод секвенирования для обнаружения мутации KRAS с помощью пиросеквенирования.J Mol Diagn 2005; 7: 413-21 [Бесплатная статья PMC] [PubMed] [Google Scholar] 131. Дюфорт С., Ричард М.Дж., де Фрайпон Ф. Метод пиросеквенирования для обнаружения мутации KRAS в опухолевых тканях, фиксированных формалином и залитых парафином. Анальная биохимия 2009; 391: 166-8 [PubMed] [Google Scholar] 132. Самовиц В.С., Суини С., Херрик Дж. И др. Низкая выживаемость, связанная с мутацией BRAF V600E, при микросателлитно-стабильном раке толстой кишки. Cancer Res 2005; 65: 6063-9 [PubMed] [Google Scholar] 133. Огино С., Шима К., Мейерхардт Дж. А. и др.Прогностическая и прогностическая роль мутации BRAF при раке толстой кишки III стадии: результаты межгруппового исследования CALGB 89803. Clin Cancer Res 2012; 18: 890-900 [Бесплатная статья PMC] [PubMed] [Google Scholar] 134. Дэвис Х., Бигнелл Г.Р., Кокс С. и др. Мутации гена BRAF при раке человека. Nature 2002; 417: 949-54 [PubMed] [Google Scholar] 135. Раджагопалан Х., Барделли А., Ленгауэр С. и др. Онкогенез: онкогены RAF / RAS и статус несоответствия репарации. Природа 2002; 418: 934. [PubMed] [Google Scholar] 136. Коинума К., Шито К., Миякура Ю. и др.Мутации BRAF связаны с обширным метилированием промотора hMLh2 в спорадических колоректальных карциномах. Int J Cancer 2004; 108: 237-42 [PubMed] [Google Scholar] 137. Lea A, Allingham-Hawkins D, Levine S.BRAF p.Val600Glu (V600E) Тестирование для оценки вариантов лечения метастатического колоректального рака. Версия 2. PLoS Curr 2010; 2: RRN1187. [Бесплатная статья PMC] [PubMed] [Google Scholar] 138. Weisenberger DJ, Siegmund KD, Campan M, et al. Фенотип метилатора CpG-островка лежит в основе спорадической микросателлитной нестабильности и тесно связан с мутацией BRAF при колоректальном раке.Нат Генет 2006; 38: 787-93 [PubMed] [Google Scholar] 139. Каннингем Дж. М., Кристенсен Э. Р., Тестер DJ и др. Гиперметилирование промотора hMLh2 при раке толстой кишки с микросателлитной нестабильностью. Cancer Res 1998; 58: 3455-60 [PubMed] [Google Scholar] 140. Лагерстедт Робинсон К., Лю Т., Вандровцова Дж. И др. Диагностика синдрома Линча (наследственный неполипозный колоректальный рак). J Natl Cancer Inst 2007; 99: 291-9 [PubMed] [Google Scholar]Колоректальная карцинома: патологические аспекты
J Gastrointest Oncol.2012 сен; 3 (3): 153–173.
Кафедра патологии и лабораторной медицины Медицинской школы Дэвида Геффена Калифорнийского университета, Лос-Анджелес, Калифорния, США
Автор, ответственный за переписку.* Равные взносы
Соответствует: Hanlin L. Wang, MD, PhD. Кафедра патологии и лабораторной медицины, Калифорнийский университет в Лос-Анджелесе. 10833 Le Conte Avenue, Лос-Анджелес, Калифорния, США. Тел .: (310) 206-1763; Факс: (310) 267-2058. Электронная почта: ude.alcu.tendem@gnawnilnah.
Поступило 6 апреля 2012 г .; Принято 23 апреля 2012 г.
Copyright 2012 Pioneer Bioscience Publishing Company. Все права защищены.Эта статья цитировалась в других статьях в PMC.Abstract
Колоректальная карцинома является одним из наиболее распространенных видов рака и одной из основных причин смерти от рака в Соединенных Штатах. Патологическое исследование образцов биопсии, полипэктомии и резекции имеет решающее значение для надлежащего ведения пациента, оценки прогноза и семейного консультирования.Молекулярное тестирование играет все более важную роль в эпоху персонализированной медицины. В этой обзорной статье основное внимание уделяется гистопатологии и молекулярной патологии колоректальной карциномы и ее предшественников, с акцентом на их клиническую значимость.
Ключевые слова: Колоректальная карцинома, патология, аденома, молекулярная, MSI, KRAS, BRAF
Введение
Колоректальная карцинома является третьим по распространенности раком в США после рака простаты и легких / бронхов у мужчин и после рака груди. и рак легких / бронхов у женщин.Это также третья по значимости причина смерти от рака в Соединенных Штатах после рака легких / бронхов и простаты у мужчин и после рака легких / бронхов и груди у женщин (1). В 2011 году в Соединенных Штатах было диагностировано 141 210 новых случаев колоректальной карциномы, из которых, по оценкам, умерло 49 380 человек, что составляет примерно 9% всех вновь диагностированных раковых заболеваний и всех смертей, связанных с раком (за исключением базальноклеточного и плоскоклеточного рака кожи).
С быстрым терапевтическим прогрессом в эпоху персонализированной медицины роль патологов в ведении пациентов с колоректальной карциномой значительно расширилась от традиционных морфологов до клинических консультантов для гастроэнтерологов, колоректальных хирургов, онкологов и медицинских генетиков.Помимо точного гистопатологического диагноза, патологоанатомы несут ответственность за точную оценку стадии патологии, анализ границ хирургического вмешательства, поиск прогностических параметров, которые не включены в стадию, таких как лимфоваскулярная и периневральная инвазия, и оценка терапевтического эффекта у пациентов, получавших неоадъявантную терапию. . Патологи также играют центральную роль в анализе гистологических характеристик опухолей, которые указывают на микросателлитную нестабильность (MSI), выборе соответствующих срезов тканей для тестирования MSI и анализа мутаций для KRAS и BRAF, а также интерпретации результатов этих важных терапевтических и прогностических тестов ( 2).
Эта обзорная статья посвящена гистолопатологии колоректальной карциномы и ее предшественников. Обсуждаются последние достижения в области молекулярной патологии и молекулярных тестов. Подчеркивается их клиническая значимость.
Гистопатологическая диагностика колоректальной карциномы
Более 90% колоректальных карцином представляют собой аденокарциномы, происходящие из эпителиальных клеток слизистой оболочки толстой кишки (3). Другие редкие типы колоректальной карциномы включают нейроэндокринную, плоскоклеточную, аденосквамозную, веретено-клеточную и недифференцированные карциномы.Обычная аденокарцинома характеризуется железистым образованием, которое является основой гистологической классификации опухоли. При хорошо дифференцированной аденокарциноме> 95% опухоли формирует железы. Умеренно дифференцированная аденокарцинома показывает образование желез на 50-95%. Плохо дифференцированная аденокарцинома в основном солидная, с образованием желез <50%. На практике большинство колоректальных аденокарцином (~ 70%) диагностируются как умеренно дифференцированные (). На долю хорошо и плохо дифференцированных карцином приходится 10% и 20% соответственно.
Пример умеренно дифференцированной аденокарциномы, демонстрирующей сложные железистые структуры в десмопластической строме (исходное увеличение × 200)
Очевидно, что определение степени опухоли является субъективным упражнением. Многие исследования продемонстрировали, что двухуровневая система оценки, которая сочетает в себе хорошо и умеренно дифференцированную до низкой степени (образование железы 50%) и определяет низкую степень дифференциации как высокую степень (образование железы <50%), снижает вариативность между наблюдателями и улучшает прогностическую значимость ( 4,5).Хотя это противоречиво, степень опухоли обычно рассматривается как независимая от стадии прогностическая переменная, а гистология высокой степени или плохо дифференцированная гистология связана с плохой выживаемостью пациента (6-8). Однако следует подчеркнуть, что гистологическая классификация должна применяться только к обычной аденокарциноме. Некоторые из гистологических вариантов, которые будут обсуждены позже, могут иметь морфологию высокой степени злокачественности, но вести себя как опухоли низкой степени злокачественности из-за своего статуса MSI.
Подавляющее большинство колоректальных карцином первоначально диагностируется с помощью эндоскопической биопсии или полипэктомии.Ключевым аспектом микроскопического исследования является поиск доказательств инвазии. Однако это может быть сложно, если биопсия поверхностная или плохо ориентирована. Если можно идентифицировать мышечную слизистую оболочку, важно определить, не нарушена ли она опухолевыми клетками. Инвазивная карцинома обычно проникает через мышечную слизистую оболочку в подслизистую основу и иногда наблюдается в непосредственной близости от подслизистых кровеносных сосудов. Другой важной особенностью инвазии является наличие десмоплазии или десмопластической реакции (), типа фиброзной пролиферации вокруг опухолевых клеток, вторичной по отношению к инвазивному росту опухоли.Инвазивная колоректальная карцинома также часто показывает характерные некротические образования в просвете железы, так называемый «грязный некроз» (). Эта уникальная функция может быть весьма полезной при обнаружении первичного колоректального рака при обнаружении метастазов неизвестного происхождения.
Десмопластическая реакция, характеризующаяся пролиферацией веретенов, окружающих аденокарциноматозную железу (исходное увеличение × 400)
Некротический мусор («грязный некроз») в просвете аденокарциноматозных желез (исходное увеличение × 400)
Следует отметить, что когда поставлен диагноз инвазивная карцинома, это означает, что карцинома, по крайней мере, проникла в подслизистую оболочку толстой кишки.Это отличается от концепции инвазии в другие части желудочно-кишечного тракта (пищевод, желудок и тонкий кишечник), где наличие инвазии слизистой оболочки является достаточным для диагностики инвазивной карциномы (pT1). В толстой кишке для диагностики опухоли pT1 требуется подслизистая инвазия. По причинам, которые не совсем ясны, но обычно предполагают, что они связаны с относительной недостаточностью лимфатических сосудов, инвазия, ограниченная собственной пластинкой оболочки и мышечной оболочкой, не имеет риска узловых или отдаленных метастазов.Таким образом, внутрислизистая карцинома предпочтительно называется дисплазией высокой степени (обсуждается позже) патологами, чтобы избежать ненужного хирургического вмешательства. В Руководстве по стадированию рака Американского объединенного комитета по раку (AJCC) (9) инвазия слизистой оболочки классифицируется как карцинома in situ (Tis). Тем не менее, термин «внутрислизистый рак» все еще может использоваться некоторыми патологами. Независимо от того, какой термин используется патологами, выявление дисплазии высокой степени или внутрислизистой карциномы в образце биопсии или полипэктомии не должно влиять на принятие решения по ведению пациента.Решение о проведении хирургической резекции должно в конечном итоге определяться общим видом поражения, результатами эндоскопического УЗИ и возможностью эндоскопической резекции.
Гистологические варианты
В классификации Всемирной организации здравоохранения (ВОЗ) перечислен ряд гистологических вариантов колоректальной карциномы, таких как муцинозный, перстневидный, медуллярный, микропапиллярный, зубчатый, ребристый комедонный тип, аденосквамозный, веретено-клеточный и др. и недифференцированный. Здесь обсуждаются только первые 3 варианта.
Муцинозная аденокарцинома
Этот особый тип колоректальной карциномы определяется тем, что> 50% объема опухоли состоит из внеклеточного муцина (3). Опухоли со значительным муцинозным компонентом (> 10%), но <50% обычно называют аденокарциномой с муцинозными признаками или муцинозной дифференцировкой. Муцинозная аденокарцинома обычно показывает большие железистые структуры с пулами внеклеточного муцина (). Можно увидеть переменное количество индивидуальных опухолевых клеток, включая клетки перстня.Прогноз муцинозной аденокарциномы по сравнению с обычной аденокарциномой был неоднозначным в различных исследованиях (10,11). Многие муцинозные аденокарциномы возникают у пациентов с наследственным неполипозным колоректальным раком (HNPCC или синдром Линча) и, таким образом, представляют собой опухоли высокого уровня MSI (MSI-H) (12). Ожидается, что эти опухоли будут вести себя низкоуровневым образом. Напротив, ожидается, что муцинозные аденокарциномы, которые являются микросателлитно-стабильными (MSS), будут вести себя более агрессивно, особенно при обнаружении на поздней стадии.
Муцинозная аденокарцинома с обильным внеклеточным муцином (исходное увеличение × 200)
Аденокарцинома с перстневым кольцом
В отличие от желудочной аденокарциномы с перстневым кольцом в толстой кишке встречается редко, составляя <1% всех колоректальных карцином. Подобно муцинозной карциноме, карцинома с перстневым кольцом определяется наличием> 50% опухолевых клеток, демонстрирующих особенности клеток с перстневым кольцом, характеризующиеся выраженной внутрицитоплазматической муциновой вакуолью, которая выталкивает ядро к периферии ().Клетки с печатным кольцом могут демонстрировать инфильтративный характер роста или присутствовать в пулах внеклеточного муцина. По определению, карцинома из перстневых клеток плохо дифференцирована (высокая степень) и имеет худший исход, чем обычная аденокарцинома (11,13,14). Однако некоторые карциномы из перстневых клеток могут быть опухолями MSI-H и, таким образом, биологически вести себя как опухоли низкой степени злокачественности (3).
Карцинома из перстневых клеток (исходное увеличение × 400)
Медуллярная карцинома
Медуллярная карцинома встречается крайне редко, составляя примерно 5-8 случаев на каждые 10000 диагностированных колоректальных раковых заболеваний, при средней ежегодной заболеваемости 3.47 (± 0,75) на 10 млн населения (15). Эта опухоль характеризуется слоями эпителиоидных неопластических клеток с крупными везикулярными ядрами, выступающими ядрышками и обильной цитоплазмой. Как правило, на образцах после резекции он имеет расширяющуюся границу () и обычно ассоциируется с выраженными лимфоцитами, инфильтрирующими опухоль (). Медуллярная карцинома — это особый гистологический подтип, который тесно связан с MSI-H (16,17). Прогноз обычно благоприятный, несмотря на его плохо дифференцированную или недифференцированную гистологию.
Медуллярная карцинома с раздвигающейся границей на краю опухоли (исходное увеличение × 40)
Медуллярная карцинома с плохо дифференцированной гистологией и инфильтрирующими опухоль лимфоцитами (исходное увеличение × 400)
Иммуногистохимический фенотип
Наиболее широко используемый иммуногистохимический маркер колоректальная аденокарцинома — это цитокератин (CK) 20, CK7 и CDX2. Наиболее распространенным иммунофенотипом колоректальной аденокарциномы является положительный для CK20 и отрицательный для CK7, что является относительно специфическим паттерном окрашивания для колоректального происхождения (18).Однако до 20% опухолей могут демонстрировать CK7-положительный / CK20-отрицательный или CK7-отрицательный / CK20-отрицательный паттерн окрашивания. Было высказано предположение, что снижение или отсутствие экспрессии CK20 при колоректальной карциноме связано с MSI-H (19). CDX2 является маркером кишечной дифференцировки и является положительным в> 90% колоректальных аденокарцином (20,21). Однако CDX2 может быть положительным при любой карциноме, которая проявляет кишечную дифференцировку и, следовательно, не является полностью колоректально-специфической. Интересно, что медуллярные карциномы толстой кишки часто бывают CK20-отрицательными и CDX2-отрицательными, что соответствует концепции MSI (16,19).
Патологическая стадия
Стадия опухоли на сегодняшний день является наиболее важным прогностическим предиктором клинического исхода для пациентов с колоректальной карциномой. Гистологическое исследование хирургически резецированных образцов играет незаменимую роль в определении глубины инвазии опухоли (T) и степени метастазов в лимфоузлы (N). Гистологическое определение T1 (опухоль проникает в подслизистую оболочку), T2 (опухоль проникает в собственную мышечную оболочку) и T3 (опухоль проникает через собственную мышечную мышцу в периколоректальные ткани) обычно не вызывает затруднений при использовании системы стадирования TNM AJCC (9).Однако определение T4a (опухоль проникает на поверхность висцеральной брюшины) и T4b (опухоль непосредственно вторгается или прикрепляется к другим органам или структурам) иногда может быть проблематичным. Во-первых, вовлечение серозной поверхности (висцеральной брюшины) можно не заметить, если образец не взят для гистологического исследования. Во-вторых, серозную поверхность можно спутать с периферическим (радиальным) или брыжеечным краем, который представляет собой неперитонеализированную поверхность, созданную хирургическим путем путем тупого или острого рассечения.Опухоль Т3 может поражать радиальный край, а опухоль Т4 может иметь отрицательный радиальный край. В-третьих, перфорацию, вызванную хирургическим вмешательством в месте опухоли, можно спутать с истинной перфорацией опухоли, что требует уточнения от хирургов. В-четвертых, прилипание других органов или структур к месту опухоли не обязательно соответствует критериям T4b. Гистологически место прикрепления может показывать только воспалительные изменения, образование абсцесса и / или фиброз, но без прямого вовлечения опухоли. Наконец, существует некоторая путаница в определении вовлечения висцеральной брюшины.Ясно, что интерпретация T4a может быть однозначной, если: (I) опухолевые клетки присутствуют на серозной поверхности с воспалительной реакцией, мезотелиальной гиперплазией и / или эрозией; или (II) свободные опухолевые клетки видны на серозной поверхности с лежащей под ними язвой висцеральной брюшины. Однако идентификация опухолевых клеток близко к серозной поверхности, но не на ней, будет рассматриваться некоторыми исследователями как T4a, если есть связанные мезотелиальные воспалительные и / или гиперпластические реакции (22).По-видимому, применение этого третьего критерия подвержено субъективным суждениям и не воспроизводится. Отмечается, что в обновленных протоколах рака и контрольных списках Колледжа американских патологов (CAP) только первые два критерия указаны как диагностические признаки T4a, а третий критерий удален (23).
Опухолевые клетки, расположенные близко к серозной поверхности, но не на ней, с мезотелиальными воспалительными и гиперпластическими реакциями, которые некоторые исследователи могут рассматривать как T4a (исходное увеличение × 40)
Патологи обязаны извлечь столько лимфатических узлов, сколько возможно из хирургических образцов.Подавляющее большинство патологов следуют рекомендациям минимум 12 узлов (24). Дополнительные усилия будут предприняты, если будет извлечено <12 узлов, хотя это увеличит время обработки отчетов о патологии. Дополнительные усилия могут включать повторный ручной поиск, отправку большего количества разделов, использование методов очистки от жира (25,26) или инъекцию метиленового синего ex vivo (27,28). Применение методов очистки от жира имеет несколько потенциальных недостатков, таких как дальнейшая задержка регистрации отчетов о патологии, стоимость, токсичность и утилизация очищающих растворов, а также неизвестное влияние на иммуногистохимию.В результате удаление жира не стало стандартной практикой в лабораториях патологии. Инъекции метиленового синего - относительно новый метод лечения колоректального рака. В этой области было опубликовано всего несколько публикаций, в основном от одной и той же исследовательской группы (27,28). Его клиническое применение требует дальнейшего изучения.
Следует понимать, что общее количество извлеченных узлов не только зависит от диссектора, но также зависит от ряда переменных образца и пациента. Исследования показали положительную корреляцию с длиной образца, шириной периколоректального жира, женским полом и размером опухоли; и отрицательная корреляция с возрастом пациента и ректосигмоидным расположением опухолей (29,30).Неудивительно, что можно ожидать менее 12 узлов, если пациенты получали предоперационную неоадъювантную терапию (31,32). Рекомендуется, чтобы патологоанатомы задокументировали степень усердия своих усилий по поиску лимфатических узлов в образце в отчетах о патологии, если извлечено <12 узлов.
Одним из интересных вопросов при определении стадии узлов является интерпретация дискретных отложений опухоли в периколоректальном жире от основной опухоли, но без идентифицируемой остаточной ткани лимфатических узлов.В AJCC Cancer Staging Manual 5 th edition узел опухоли> 3 мм считался положительным узлом, тогда как узел ≤3 мм классифицировался в категорию прерывистого распространения (T3). В издании 6 th опухолевые отложения считались положительными узлами, если они были круглыми и имели гладкий контур независимо от размера, но классифицировались по категории Т, а также как венозная инвазия, если они имели неправильную форму. В текущем издании (7 th edition) признается тот факт, что отложения опухоли могут представлять собой прерывистое расширение, венозную инвазию с внесосудистым распространением или действительно полностью замененные лимфатические узлы.Учитывая их связь со снижением безрецидивной и общей выживаемости (33,34), эти опухолевые отложения теперь считаются узловыми метастазами, независимо от размера или контура, и обозначаются N1c при отсутствии метастазов в регионарные лимфатические узлы, чтобы способствовать дополнительному послеоперационному лечению. Однако, если также идентифицирован один положительный лимфатический узел, стадия N будет изменена с N1c на N1a. Наличие прерывистых опухолевых отложений не изменяет стадию Т в выпуске 7 th (9).
Прогностическое значение изолированных опухолевых клеток (ITC), определяемых как отдельные опухолевые клетки или небольшие кластеры опухолевых клеток размером ≤0,2 мм, обнаруженных либо с помощью иммуногистохимического окрашивания, либо стандартного окрашивания гематоксилином и эозином в регионарных лимфатических узлах, в настоящее время остается неясным. В отсутствие явных метастазов в лимфоузлы ITC классифицируются как N0, но аннотируются как N0 (i +), где «i» означает «изолированные опухолевые клетки». С другой стороны, микрометастаз (> 0,2 мм, но ≤2,0 мм) обозначается как N1 (микр.).Следует указать количество лимфатических узлов, вовлеченных в ITC или микрометастазирование (9,23).
Отчет о патологии
Большинство патологов используют стандартизированный синоптический отчет о колоректальной карциноме в соответствии с контрольным списком, рекомендованным CAP (23). Подробности, которые должны быть включены в отчет, включают тип образца, локализацию опухоли, размер опухоли, макроскопическую перфорацию опухоли, гистологический тип, гистологический класс, микроскопическое распространение опухоли, границы (проксимальные, дистальные и радиальные), эффект лечения (для опухолей, леченных неоадъювантом. терапия), лимфоваскулярная инвазия, периневральная инвазия, отложения опухоли (прерывистое экстрамуральное распространение), стадия TNM (включая общее количество исследованных лимфатических узлов и общее количество вовлеченных узлов).Некоторые отчеты о патологии могут также включать передний край опухоли (инфильтративный или расширяющийся), наличие или отсутствие зачатка опухоли и оценку гистологических характеристик, которые указывают на MSI, таких как инфильтрирующие опухоль лимфоциты, перитуморальный Крон-подобный лимфоидный ответ и процентное соотношение муцинозного компонента.
Обработка образцов и отбор образцов
В лабораториях патологии образцы после хирургической резекции обрабатываются систематическим образом, чтобы обеспечить полноту и точность отчета о патологии.Перед вскрытием наружную поверхность образца исследуют на предмет возможного серозного поражения, поражения радиального края, перфорации опухоли и удаленных опухолевых имплантатов. При резекции прямой кишки проверяется целостность мезоректума. После того, как образец ориентирован и образец измерен, радиальный край вокруг опухоли окрашивается. Затем образец вскрывают, обычно вдоль антимезентериальной границы, чтобы не прорезать опухоль. Регистрируются расположение и размер опухоли, а также ее расстояние от ближайшего края.Небольшие части свежей опухоли и неопухолевых тканей могут быть закуплены для банка тканей, но это не должно ставить под угрозу количество опухоли для диагностики.
Вскрытый и очищенный образец прикрепляют булавками к восковой доске и погружают в достаточный объем формалина для фиксации на ночь. Затем опухоль разрезается с интервалом 3-4 мм для оценки глубины инвазии. Остальная часть образца также исследуется на предмет дополнительных повреждений. Соответствующие срезы опухоли (обычно 5 срезов в зависимости от размера опухоли) должны быть отправлены на микроскопическое исследование, чтобы включить область наиболее глубокой инвазии и максимизировать вероятность обнаружения лимфоваскулярной и периневральной инвазии.Включение опухоли и прилегающей не пораженной толстой кишки в одни и те же секции желательно, потому что всегда есть вероятность того, что случай может быть использован для исследования в будущем. Дополнительные срезы должны включать проксимальный и дистальный края, радиальный край (если он не включен в срезы опухоли), любые дополнительные полипы или поражения, а также произвольно не пораженный толстый кишечник.
После взятия указанных выше срезов брыжеечный жир или периколоректальные мягкие ткани удаляются и исследуются на лимфатические узлы.Все явно отрицательные лимфатические узлы полностью подвергаются микроскопическому исследованию. Макро-положительные лимфатические узлы могут быть представлены частично или полностью в зависимости от их размера.
Образец для полипэктомии имеет чернила на прижатом основании, но ножка может втягиваться, и поэтому ее трудно идентифицировать. Образец делится пополам или серийно, в зависимости от его размера, и представляется полностью. Сечение должно следовать в вертикальной плоскости ножки, чтобы максимизировать гистологическую оценку края полипэктомии и вовлечения подслизистого слоя.Однако, если образец получен несколькими частями, оценка запаса может стать невозможной.
Предшествующие поражения
Хорошо известно, что подавляющее большинство колоректальных аденокарцином возникает из предшественников поражений, таких как аденомы и дисплазия. Резидуальная аденома — частая находка при колоректальных аденокарциномах. Эндоскопическая полипэктомия снижает частоту возникновения колоректального рака у пролеченных пациентов и предотвращает смерть от колоректального рака (35,36). Здесь обсуждаются некоторые из распространенных предшественников поражений.
Аденомы
По крайней мере, половина взрослых в западных странах будет иметь аденоматозный полип в течение жизни, и одна десятая этих поражений будет прогрессировать до аденокарциномы (37). Риск увеличивается после 50 лет. Эндоскопически аденомы могут быть на ножке или сидячими. По определению, аденомы — это клональные поражения, которые демонстрируют, по крайней мере, дисплазию низкой степени, характеризующуюся увеличенными, гиперхроматическими и удлиненными (пенцилловидными) ядрами, расположенными в стратифицированной конфигурации вдоль базальной мембраны.Аденоматозные клетки могут демонстрировать истощение муцина и повышенную апоптотическую активность. Интересно, что аденоматозные полипы, по-видимому, развиваются по механизму «сверху вниз» (38). Таким образом, небольшие поражения часто имеют только аденоматозный эпителий в их поверхностных частях.
Обычные аденомы делятся на тубулярные, трубчато-ворсинчатые и ворсинчатые в зависимости от их архитектурных особенностей (). Тубулярные аденомы состоят из простых криптоподобных диспластических желез и содержат менее 25% ворсинчатого компонента.Ворсинчатые аденомы на> 75% состоят из ворсинчатого компонента, напоминающего пальцеобразные выступы. Тубуловиллярные аденомы представляют собой промежуточные поражения с 25-75% ворсинчатого компонента. Аденомы большого размера (> 1 см) или преимущественно ворсинчатые, или содержащие дисплазию высокой степени (обсуждается ниже), считаются «продвинутыми аденомами» (39), которые требуют более агрессивного эндоскопического наблюдения.
Примеры трубчатой аденомы (A. исходное увеличение × 200) и трубчатой аденомы (B. исходное увеличение × 100)
Зубчатые полипы
Зубчатые полипы — это общий термин для любых полипов с зубчатыми (пилообразными или звездчатыми) архитектура эпителиального компартмента.Это гетерогенная группа поражений, в которую в основном входят гиперпластический полип, зубчатая аденома / полип на сидячей кости и традиционная зубчатая аденома (40).
Гиперпластические полипы (ГП) являются наиболее частыми зубчатыми поражениями, которые чаще встречаются в дистальном отделе толстой кишки и обычно имеют небольшой размер (<5 мм). Только редкие HP> 1 см. Эндоскопически трудно отличить HP от аденомы (41). Гистологически ГП характеризуются простой трубчатой архитектурой с удлиненными и прямыми криптами и люминальной зубчатостью, которая более выражена в верхних частях крипт с появлением поверхностного созревания ().Зона пролиферации ограничена базальной частью крипт, которая остается узкой и не зазубренной (42). HPs можно далее разделить на микровезикулярные, бокаловидные клетки и подтипы с низким содержанием муцина (43), но эта гистологическая подклассификация, по-видимому, не имеет никакого клинического значения.
Гиперпластический полип (исходное увеличение × 100)
Сессильная зубчатая аденома (SSA) и зубчатый полип сидячей кости (SSP) относятся к одному и тому же зубчатому поражению и в настоящее время используются взаимозаменяемо.SSA / P чаще встречаются в проксимальном отделе толстой кишки и обычно больше, чем HP (44). Гистологическая диагностика SSA / Ps полностью основана на архитектурных особенностях, характеризующихся чрезмерной зазубринами крипт, зазубринами по всей длине крипты, гипермуцинозным эпителием, дилатацией крипт, ветвлением крипт, горизонтальными расширениями крипт в основании крипт и аберрантной пролиферацией (45). Несмотря на название, SSA / Ps не имеют диспластических ядерных изменений, которые характерны для обычных аденом. Следует помнить, что SSA / P — относительно новая организация, которая раньше классифицировалась как HP.Таким образом, патологи могут столкнуться с трудностями при различении SSA / P и HP на гистологическом основании (46–48). В случаях, когда разделение непросто, может быть поставлен описательный диагноз «зубчатый полип» с комментарием.
Тем не менее, отделение SSA / P от HP представляется важным, потому что SSA / P теперь считается предшественником поражения колоректальной карциномы с MSI и, вероятно, также для метилированных CpG-островков карцином MSS (40), тогда как HP обычно считается поражением. быть безобидным.Наиболее надежные признаки, позволяющие отличить SSA / P от HP, — это расширение крипт в основании, часто предполагающее L, перевернутую букву T или конфигурацию в форме якоря (). Эти необычные формы («архитектурная дисплазия») часто наблюдаются в двух или более смежных криптах и, как полагают, являются результатом аномальной пролиферации и / или снижения апоптоза (42–44). Учитывая предполагаемый предраковый потенциал, для пациентов с SSA / Ps, вероятно, оправдано эндоскопическое наблюдение, аналогичное таковым с обычными аденомами.Кроме того, часть этих поражений потенциально может прогрессировать до карциномы быстрее, чем обычные аденомы. Таким образом, пациентам с этими поражениями может потребоваться еще более агрессивное эндоскопическое наблюдение (49,50).
Вид с малым увеличением (A. исходное увеличение × 40) и большим увеличением (B. исходное увеличение × 200) зубчатого полипа на сидячем месте. Обратите внимание на наличие базальной зубчатости
Традиционная зубчатая аденома (TSA) — это уникальный и необычный тип истинной аденомы, которая демонстрирует ядерную дисплазию низкой степени, аналогичную той, которая наблюдается при обычной аденоме, а также имеет зубчатую архитектуру, аналогичную той, которая наблюдается для HP и SSA / P.Характерны выраженная цитоплазматическая эозинофилия и характер роста ворсинок ().
Пример традиционной зубчатой аденомы (исходное увеличение × 400). Обратите внимание на наличие люминальной зазубрины, цитологической дисплазии низкой степени и цитологической эозинофилии
Дисплазия при воспалительном заболевании кишечника
Воспалительное заболевание кишечника (ВЗК) является хорошо известным фактором риска развития дисплазии и карциномы. Диспластические поражения на фоне ВЗК могут быть плоскими (эндоскопически невидимыми) или выпуклыми (51,52), которые классифицируются как неопределенные для дисплазии, дисплазии низкой степени или дисплазии высокой степени.Возвышенные поражения обычно называют поражениями или массами, связанными с дисплазией (DALM), и их трудно или невозможно отличить от спорадических аденом. Однако несколько исследований показали, что аденомоподобные поражения у пациентов с ВЗК, независимо от того, представляют ли они поражение DALM, связанное с ВЗК, или спорадическую аденому, можно адекватно лечить с помощью полипэктомии и постоянного эндоскопического наблюдения, если нет сопутствующей плоской дисплазии (53 -55).
Учитывая значение лечения, рекомендуется, чтобы диагноз дисплазии на фоне ВЗК был подтвержден опытным патологом (56).Неопределенный диагноз дисплазии не должен превращаться в мусорную корзину, и его следует использовать только для случаев, демонстрирующих тревожные цитологические и архитектурные изменения, но также демонстрирующих поверхностное созревание или обильное воспаление. Диагноз также подходит, если поверхность слизистой оболочки не может быть оценена из-за тангенциального разреза ткани, наличия заметного эффекта прижигания или наличия других артефактов обработки.
Синдром Линча
Синдром Линча является наиболее частым наследственным синдромом колоректального рака (57).Он характеризуется повышенным риском рака в течение жизни, в первую очередь желудочно-кишечного и гинекологического трактов, причем наиболее распространены колоректальные и эндометриальные карциномы. Совокупный риск развития колоректального рака в течение жизни оценивается в 66% для мужчин и 43% для женщин (58). У пациентов с синдромом Линча в относительно молодом возрасте развиваются муцинозные, малодифференцированные, недифференцированные или медуллярные карциномы в правой ободочной кишке. Могут быть заметны инфильтрирующие опухоль лимфоциты и перитуморальная лимфоидная реакция типа Крона.
Синдром Линча возникает в результате мутации зародышевой линии в одном из четырех генов восстановления несоответствия ДНК (MMR) ( MLh2, MSh3, MSH6, PMS2 ) и передается по аутосомно-доминантному типу. Почти 90% пациентов имеют мутации в гене MLh2 или MSh3 (57,59). Мутации в генах MSH6 и PMS2 встречаются гораздо реже. Диагноз устанавливается в соответствии с Амстердамскими критериями II () (60) и тестированием MSI в соответствии с пересмотренными рекомендациями Bethesda () (61).Пациенты с опухолью MSI, но без идентифицируемого дефекта зародышевой линии в гене MMR, могут по-прежнему иметь синдром Линча, если исключены другие причины MSI, такие как метилирование промотора MLh2 .
Таблица 1
Амстердамские критерии II для синдрома Линча (60)| Должно быть не менее трех родственников с раком, связанным с синдромом Линча (колоректальный рак, рак эндометрия, тонкой кишки, мочеточника или почечной лоханки. ) |
| Должны быть соблюдены все следующие критерии |
| 1.Один должен быть родственником первой степени родства двух других |
| 2. По крайней мере, два следующих друг за другом поколения должны быть затронуты |
| 3. По крайней мере одно должно быть диагностировано до достижения возраста 50 лет |
| 4. Семейный аденоматозный полипоз должен быть исключен в случае (ах) колоректального рака, если таковой имеется |
| 5. Опухоли должны быть проверены патологическим исследованием |
Таблица 2
Пересмотренное руководство Bethesda по тестированию MSI (61 )| 1.Колоректальный рак диагностирован у пациента младше 50 лет |
| 2. Наличие синхронных, метахронных колоректальных или других опухолей, связанных с синдромом Линча, * независимо от возраста |
| 3. Колоректальный рак с гистология MSI-H **, диагностированная у пациента младше 60 лет |
| 4. Колоректальный рак диагностирован у одного или нескольких родственников первой степени родства с опухолью, связанной с синдромом Линча, с одной из рак, диагностированный в возрасте до 50 лет |
| 5.Колоректальный рак диагностирован у двух или более родственников первой или второй степени родства с опухолями, связанными с синдромом Линча, независимо от возраста |
Семейный аденоматозный полипоз
Семейный аденоматозный полипоз (FAP) является редким аутосомно-доминантным наследственным колоректальным синдромом ( 62,63), характеризующиеся ранним развитием сотен и тысяч аденоматозных полипов в толстой кишке (). Если не лечить, прогрессирование колоректального рака практически неизбежно в среднем в возрасте 35-40 лет (63,64).Эти пациенты также подвержены риску развития аденоматозных полипов в тонкой кишке (65) и полипов фундальных желез в желудке (66). Хотя синдромальные полипы фундальных желез чаще демонстрируют дисплазию низкой степени, чем спорадические аналоги (67–69), вероятность прогрессирования до дисплазии высокой степени или инвазивной карциномы чрезвычайно низка.
Случай семейного аденоматозного полипоза. Обратите внимание на наличие бесчисленных полипов в толстой кишке
Диагностические критерии FAP включают: (I) 100 колоректальных аденоматозных полипов; (II) мутация зародышевой линии гена аденоматозного полипоза coli ( APC ); или (III) семейный анамнез ФАП и любого количества аденом в молодом возрасте (70).Пациенты с ослабленным FAP имеют <100 колоректальных аденоматозных полипов, обычно в среднем около 30. Их пожизненный риск развития колоректального рака снижается примерно до 70%, и у большинства пациентов онкологические заболевания развиваются позже (63,71). Синдром Гарднера - вариант ФАП. У пациентов с этим синдромом также есть эпидермоидные кисты, остеомы, аномалии зубов и десмоидные опухоли. Синдром Тюрко - еще один вариант, который включает опухоли головного мозга, как правило, медуллобластому (70).
Ген-супрессор опухоли APC представляет собой большой ген, который содержит 21 экзон, охватывающий область размером 120 т.п.н. и кодирующий белок из 2843 аминокислот.Большинство мутаций зародышевой линии представляют собой бессмысленные мутации и мутации сдвига рамки считывания и группируются в «горячей точке» в самом большом экзоне 15 (72,73), что приводит к синтезу усеченного белка, что, в свою очередь, приводит к аберрантному накоплению β -катенин и последующая активация комплекса факторов транскрипции β-катенин / Tcf, чтобы способствовать неконтролируемой активации сигнального пути Wnt онкогенеза (74).
Синдром Пейтца-Егерса
Это аутосомно-доминантный наследственный онкологический синдром, характеризующийся гамартоматозными полипами в желудочно-кишечном тракте, пигментными кожно-слизистыми поражениями и повышенным риском желудочно-кишечных и экстрагастроинтестинальных злокачественных новообразований (75).Кумулятивный риск развития колоректального рака в течение жизни приближается к 40% (76). Однако остается под вопросом, являются ли злокачественные новообразования кишечника результатом прямой трансформации гамартоматозных полипов, поскольку дисплазия этих полипов чрезвычайно редка. Пациенты с синдромом Пейтца-Егерса имеют мутации зародышевой линии в гене LKB1 / STK11 (77-79). Гамартоматозные полипы при синдроме Пейтца-Егерса чаще всего встречаются в тонком кишечнике, но также могут возникать в толстой кишке.Они состоят из пролиферативного эпителия, стромы и гладких мышц, расположенных ветвистым узором ().
Полип Пейтца-Йегерса в толстой кишке. Обратите внимание на дольчатый рисунок крипт толстой кишки, разделенных пучками гладких мышц (исходное увеличение × 100)
Синдром ювенильного полипоза
Это также аутосомно-доминантный наследственный онкологический синдром, диагностированный, если: (I) 5 ювенильных полипов в толстой кишке; (II) ювенильные полипы желудочно-кишечного тракта; или (III) любое количество ювенильных полипов и семейный анамнез ювенильного полипоза (80).Подобно синдрому Пейтца-Егерса, совокупный риск развития колоректального рака в течение жизни у пациентов с синдромом ювенильного полипоза также приближается к 40% (80,81). Однако, в отличие от синдрома Пейтца-Егерса, считается, что колоректальный рак у пациентов с синдромом ювенильного полипоза развивается непосредственно в результате неопластической трансформации в ювенильном полипе, поскольку дисплазия является частой находкой в этих полипах. Примерно 50-60% пациентов имеют мутации зародышевой линии в генах SMAD4 или BMPR1A (82).Гистологически ювенильные полипы характеризуются кистозно расширенными криптами с отечной и воспаленной стромой (). Поверхность полипа может быть эродированной, с грануляционной тканью и регенеративными изменениями эпителия.
Ювенильный полип с расширенными криптами и воспаленной стромой (исходное увеличение × 40)
Следует отметить, что синдромальные ювенильные полипы нельзя отличить от спорадических аналогов, и их можно спутать с воспалительными полипами на гистологическом основании. Несмотря на название, ювенильные полипы могут встречаться у взрослых и даже пожилых людей.Пациенты со спорадическими ювенильными полипами не имеют повышенного риска злокачественных новообразований (83).
MUTYH- ассоциированный полипозMUTYH -ассоциированный полипоз (MAP) — это синдром аутосомно-рецессивного полипоза, который несет повышенный риск развития колоректального рака (84,85). Это вызвано двуаллельными мутациями зародышевой линии в гене MUTYH (также известном как ген MYH ), который кодирует фермент эксцизионной репарации оснований (BER), ответственный за предотвращение мутаций после окислительного повреждения ДНК.Наиболее частыми мутациями являются миссенс-варианты Y165C и G382D, на которые приходится> 70% всех мутантных аллелей (86,87). Пациенты с MAP обычно имеют> 10 синхронных колоректальных аденом и могут иметь несколько сотен или даже до 1000 полипов. Однако у большинства пациентов на момент постановки диагноза имеется <100 полипов (88). Следовательно, MAP часто фенотипически неотличим от ослабленного FAP. Однако, в отличие от FAP, мутации гена APC у пациентов с MAP отсутствуют. Кроме того, зазубренные полипы (гиперпластические и зазубренные полипы на животе) часто встречаются у пациентов с MAP (89), что можно спутать с зазубренным полипозом (описанным ниже).Кроме того, из-за своего рецессивного типа наследования, MAP имеет тенденцию пропускать поколения, что затрудняет идентификацию пациентов с MAP, поскольку многие пациенты, по-видимому, представляют собой спорадические случаи.
Зубчатый полипоз
Зубчатый полипоз — это новый термин, используемый ВОЗ, который исторически назывался гиперпластическим полипозом (40). Он определяется: (I) как минимум 5 зубчатыми полипами проксимальнее сигмовидной кишки с 2 или более полипами> 1 см; (II) любое количество зубчатых полипов проксимальнее сигмовидной кишки у человека, у которого есть родственник первой степени родства с зубчатым полипозом; или (III)> 20 зубчатых полипов любого размера по всей толстой кишке.Полипы могут быть как SSA / Ps, так и HP.
Дисплазия высокой степени
Патологическая оценка аденоматозного полипа и дисплазии включает определение наличия или отсутствия дисплазии высокой степени, которая является непосредственным предшественником инвазивной колоректальной аденокарциномы. Дисплазия высокой степени проявляется как сочетание архитектурной сложности и цитологической атипии, которые имеют более злокачественный вид, чем те, которые наблюдаются при обычной аденоме (). С архитектурной точки зрения, области с высоким содержанием обычно демонстрируют повышенную железистую плотность с переполненными железами, имеющими решетчатую структуру или структуру роста спина к спине.Цитологически клетки с дисплазией высокой степени проявляют округлые ядра, грубый хроматин, заметные ядрышки и потерю ядерной полярности, при этом ядра больше не ориентированы перпендикулярно базальной мембране. В просвете диспластических желез можно увидеть некротический мусор.
Дисплазия высокой степени со сложной архитектурой и выраженной ядерной атипией (исходное увеличение × 400)
Дисплазия высокой степени обычно является очаговой и располагается на поверхностной части полипа и, следовательно, не требует дополнительного лечения, кроме полипэктомии, если полип полностью удален эндоскопически.Как обсуждалось ранее, дисплазия толстой кишки высокой степени является синонимом карциномы in situ или интраэпителиальной карциномы. Внутримукозная аденокарцинома, определяемая инвазией собственной пластинки, включая инвазию в (но не через) слизистую оболочку мышечной ткани, по-прежнему относится к категории дисплазии высокой степени из-за ее незначительного потенциала метастазирования и может успешно лечиться только полипэктомией (90).
Злокачественный полип
Термин злокачественный полип используется для описания полипа, который содержит инвазивную аденокарциному в подслизистой оболочке.Предыдущие исследования показали распространенность 2-5% аденом, удаленных эндоскопически (91). При обнаружении злокачественного полипа необходимо оценить несколько критических гистологических характеристик, которые включают состояние края резекции, гистологический класс и наличие или отсутствие лимфоваскулярной инвазии. Эти факторы связаны с риском неблагоприятных исходов, таких как метастазирование в лимфоузлы и / или местный рецидив после полипэктомии. Полипы с отрицательным краем полипэктомии, низкой степенью гистологии и отсутствием лимфоваскулярной инвазии можно безопасно лечить с помощью эндоскопической полипэктомии.Было показано, что повышенный риск неблагоприятных исходов связан с положительной границей (определяемой как <2 мм от глубокого прижженного края) (), гистологией высокой степени (плохо дифференцированной) и лимфоваскулярной инвазией. Если присутствует какая-либо из этих особенностей, показана хирургическая резекция (91-93). Поэтому важно, чтобы образцы для полипэктомии были получены одним целым, чтобы патологоанатомы могли точно оценить края. Невозможность оценить краевой статус из-за частичной резекции также следует рассматривать как фактор риска (91,93), и хирургическая резекция может быть рекомендована клинически здоровым пациентам.
Злокачественный полип, показывающий аденокарциноматозные железы, присутствующие в пределах 1 мм от края полипэктомии (исходное увеличение × 100)
Ловушка при оценке аденоматозного полипа — это псевдоинвазия, при которой аденоматозные элементы смещены или грыжа в такой подслизистой основе, обычно вторично по отношению к такой травматизации как скручивание, так и перекручивание стебля (). Гистологические признаки, которые помогают отличить от истинной инвазии, включают лобулярную конфигурацию грыжевых элементов, отсутствие явной архитектурной и цитологической атипии высокой степени, наличие края воспалительных клеток собственной пластинки вокруг захваченных элементов, отсутствие десмопластической реакции, отсутствие прямого контакта с подслизистой оболочкой. мышечные сосуды и наличие гемосидерина или кровоизлияния.Иногда грыжи аденоматозных желез имеют высокую гистологию, которую еще труднее отличить от инвазивной аденокарциномы. Однако другие гистологические признаки, способствующие псевдоинвазии, могут все еще присутствовать. В редких случаях, когда невозможно провести однозначное различие, может быть рассмотрена полная полипэктомия или хирургическая резекция в зависимости от клинических и эндоскопических условий пациента.
Низкое увеличение (A. исходное увеличение × 40) и высокое увеличение (B.исходное увеличение × 200) виды псевдоинвазии в трубчатую аденому. Обратите внимание на наличие кровоизлияния и гемосидерина.
Патогенез и молекулярная классификация
Колоректальный рак представляет собой гетерогенную группу заболеваний с характерным генетическим и эпигенетическим фоном (94). Чтобы улучшить клиническое ведение и лучше предсказать исход болезни, были предприняты попытки классифицировать колоректальный рак на основе локализации, гистологии, этиологических факторов и молекулярных механизмов онкогенеза.Еще в 1980-х годах было признано, что рак, возникающий в проксимальных и дистальных отделах толстой кишки, связан с различными генетическими механизмами (95,96). Например, синдром Линча преимущественно поражает проксимальный отдел ободочной кишки, тогда как при FAP больше полипов наблюдается в левой ободочной кишке. Эти семейные формы колоректального рака послужили прототипами для понимания различных молекулярных механизмов онкогенеза. Как обсуждалось ранее, синдром Линча возникает в результате потери функции одного из генов MMR и следует пути MSI («мутаторный» путь).Напротив, FAP возникает у пациентов с наследственными мутациями в гене APC , который был центром исходной модели Fearon-Vogelstein колоректального туморогенеза (97), которая составляет основу пути хромосомной нестабильности (CIN) («супрессор»). путь).
Пути MSI и CIN описывают патогенез колоректального рака, основанный на генетических аномалиях, которые приводят к потере функции генов-супрессоров опухоли и / или усилению функции онкогенов. В последнее десятилетие эпигенетическая нестабильность привлекла значительное внимание и теперь считается, что она участвует в патогенезе почти одной трети случаев колоректального рака (49).Помимо последовательности и структуры ДНК, экспрессия генов контролируется рядом эпигенетических модификаций, которые включают метилирование ДНК, изменения гистонов и ремоделирование хроматина (98). Одной из наиболее охарактеризованных эпигенетических модификаций, связанных с колоректальным онкогенезом, является подавление генов (генов супрессоров опухолей и / или генов MMR) посредством гиперметилирования их промоторных областей. Хотя обсуждался вопрос о том, представляет ли феномен эпигенетической нестабильности адаптивный клеточный механизм во время канцерогенеза, направленный на прекращение клеточной пролиферации, вторичное изменение еще не идентифицированных генетических мутаций, явление, которое, как ожидается, произойдет во время старения опухолевых клеток, или просто артефакт (99-104 ), подавление транскрипции определенных генов за счет гиперметилирования, несомненно, приводит к развитию опухоли (105-110).В частности, гиперметилирование промотора MLh2 , одного из генов MMR, продемонстрировано в большинстве спорадических колоректальных опухолей с фенотипом MSI (108,111,112). Поскольку многие гены богаты цитозиновыми и гуаниновыми динуклеотидами (CpG-островки) в своих промоторах, метилирование остатков цитозина в CpG-островках является обычным явлением, которое приводит к изменениям хромосомной структуры и подавлению экспрессии генов. Колоректальный рак с фенотипом метилирования островков CpG (CIMP) характеризуется эпигенетической потерей функции генов-супрессоров опухолей без мутаций (49,113).
обобщает текущее понимание молекулярных путей, участвующих в колоректальном онкогенезе. Путь CIN участвует как в спорадическом, так и в синдромальном колоректальном раке. Опухоли CIN характеризуются кариотипическими аномалиями и хромосомными прибавками и потерями, которые можно оценить с помощью анализа плоидности ДНК или потери гетерозиготности (LOH). Эти опухоли почти всегда содержат мутации APC , часто обнаруживают мутации KRAS и p53 и часто имеют аллельную потерю 18q (3,94).Путь MSI также вовлечен как в спорадический, так и в синдромный колоректальный рак и имеет тенденцию быть взаимоисключающим с CIN. Как обсуждалось ранее, опухоли MSI характеризуются потерей функции восстановления несоответствия ДНК. При спорадическом колоректальном раке потеря функции в первую очередь связана с метилированием промотора гена MLh2 , что приводит к эпигенетическому ингибированию экспрессии белка MLh2 и его партнера по связыванию PMS2. Эти опухоли часто обнаруживают мутацию BRAF , но лишь в редких случаях мутации KRAS .При синдроме Линча потеря функции обычно является результатом мутаций зародышевой линии в одном из генов MMR. Эти опухоли никогда не содержат мутаций BRAF . Наконец, путь CIMP представляет собой уникальный молекулярный механизм в колоректальном онкогенезе, который может возникать как в опухолях MSI-H, так и в опухолях MSS.
Молекулярные пути в колоректальном онкогенезе. CRC, колоректальный рак; MSS, микроспутник стабильный; MSI-H, микроспутниковая нестабильность высокого уровня; FAP, семейный аденоматозный полипоз; AFAP, ослабленный FAP; PJS, синдром Пейтца-Егерса; JPS, синдром ювенильного полипоза; MAP, MUTYH-ассоциированный полипоз; CIN, путь хромосомной нестабильности; MSI, микроспутниковая нестабильность; CIMP, фенотип метилатора CpG-островков; ?, пути пока не определены
Молекулярно-генетическое тестирование
С быстрым прогрессом в понимании колоректального туморогенеза и фармакогенетики, требуется все больше и больше молекулярных и генетических тестов, чтобы оптимально разработать индивидуальную терапию для отдельных пациентов, чтобы лучше предсказать прогноз пациента, и более точно определить необходимость семейного консультирования.В настоящее время MSI, KRAS и BRAF являются наиболее часто используемыми тестами в лабораториях патологии.
MSI testing
Как обсуждалось ранее, опухоли MSI составляют ~ 15% колоректальных аденокарцином. Эти опухоли, как правило, демонстрируют уникальные клинико-патологические особенности, имеют тенденцию иметь лучший прогноз со скорректированной стадией по сравнению с опухолями MSS и, по-видимому, устойчивы к лечению 5-фторурацилом (114).
Микросателлиты — это повторяющиеся последовательности ДНК, которые подвержены ошибкам во время репликации ДНК, если система MMR неисправна.MSI определяется как изменение длины микросателлитных последовательностей. Его обычно оценивают путем анализа двух мононуклеотидных повторов (BAT-25 и BAT-26) и трех динуклеотидных повторов (D2S123, D5S346 и D17S250), известных как панель Bethesda (61, 115), путем сравнения образцов ДНК, извлеченных из нормальных и опухолевых клеток. ткани того же пациента. Тест основан на полимеразной цепной реакции (ПЦР) и может проводиться на фиксированных формалином тканях, залитых парафином. Опухоль обозначается как MSI-H, если два или более (> 40%) из пяти микросателлитных маркеров показывают нестабильность, MSI-L (низкий уровень), если только один маркер показывает нестабильность, или MSS, если ни один из маркеров не показывает нестабильность.Клиническое значение MSI-L остается неясным и противоречивым (116), и может быть полезно, если будут протестированы дополнительные микросателлитные маркеры, чтобы повысить точность классификации MSI.
Непрямой анализ статуса MSI может быть выполнен с помощью иммуногистохимического окрашивания белков MMR. Эти белки повсеместно присутствуют в нормальных клетках, но обнаруживают потерю экспрессии в опухолевых клетках MSI. Можно наблюдать несколько паттернов окрашивания на основе лежащих в основе генетических или эпигенетических аномалий ().Интересно отметить, что потеря экспрессии белка MLh2 всегда сопровождается потерей его партнера по связыванию PMS2 (), но потеря экспрессии PMS2 может происходить сама по себе. То же самое верно для MSh3 и его партнера по связыванию MSH6.
Таблица 3
Иммуногистохимические образцы окрашивания и интерпретация для белков MMR
| MLh2 | MSh3 | MSH6 | PMS2 | Интерпретация + | + | Неповрежденный MMR * | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| — | + | + | — | MLh2 зародышевые мутации или гиперметилирование | + | Мутация зародышевой линии MSH3 | |||||||||
| + | + | — | + | MSH6 мутация зародышевой линии | Мутация зародышевой линии PMS2 |
A MSI tumo r показывает потерю экспрессии белков MLh2 (A) и PMS2 (D) и нормальную экспрессию MSh3 (B) и MSH6 (C).Обратите внимание на наличие положительного окрашивания в доброкачественных криптах толстой кишки и воспалительных клетках, которые служат хорошим внутренним контролем для окрашивания (исходное увеличение × 200)
Чувствительность теста MSI на основе ПЦР с использованием панели Bethesda колеблется от 55% до 84%. для обнаружения мутаций в разных генах MMR. Чувствительность повышается, если используются три или более маркера мононуклеотидных повторов. Специфичность теста MSI составляет 90%. Иммуногистохимия была признана надежной заменой MSI с уровнем соответствия> 90%.Он также предоставляет дополнительную информацию о тесте MSI на основе ПЦР, поскольку позволяет анализировать ген-специфическую последовательность ДНК на основе образца окрашивания. Однако иммуногистохимия может пропустить редкие случаи MSI, вызванные мутациями зародышевой линии другими генами, и не отличить мутацию зародышевой линии от эпигенетических изменений при обнаружении потери экспрессии белка MLh2. Таким образом, самой последней рекомендацией является выполнение как теста MSI на основе ПЦР, так и иммуногистохимии, чтобы свести к минимуму вероятность пропуска диагноза синдрома Линча (117).Также в последнее время рекомендуется тестировать все впервые диагностированные колоректальные опухоли независимо от возраста пациента и семейного анамнеза, поскольку около 25% пациентов с синдромом Линча не соответствуют критериям Амстердама II или рекомендациям Bethesda (117). В этих условиях можно выполнить только один тест, иммуногистохимический или MSI-анализ, поскольку стоимость тестов станет проблемой.
Тестирование KRAS
Мутации в гене KRAS (гомолог вирусного онкогена саркомы крысы Кирстен) приводят к экспрессии конститутивно активированного белка KRAS, который обнаруживается примерно в 40% случаев колоректального рака (2118).Мутант KRAS , являющийся критически важной молекулой в сигнальном пути рецептора эпидермального фактора роста (EGFR), делает опухоли устойчивыми к терапии, направленной на EGFR (2,119-121). В результате Американское общество клинической онкологии (ASCO) и Национальная комплексная сеть рака (NCCN) рекомендовали анализ мутаций гена KRAS пациентам-кандидатам, которые будут получать терапию против EGFR (122, 123).
Более 95% мутаций KRAS встречаются в кодонах 12 и 13 экзона 2 (118,124,125), и, таким образом, основанные на ПЦР методологии, разработанные для обнаружения мутаций KRAS , предназначены в первую очередь для этих мутаций.Мутации также могут происходить в других локусах, таких как кодоны 61 и 146 (126), но они, как правило, не подвергаются скринингу из-за редкости. Клинически доступные методы ПЦР в реальном времени включают анализ аллель-специфической амплификации и анализ кривой плавления после ПЦР. Метод аллель-специфической ПЦР в реальном времени обнаруживает семь наиболее распространенных мутаций в кодонах 12 и 13 (127), тогда как анализ кривой плавления обнаруживает все возможные мутации в этих двух кодонах (128,129).
Другой метод обнаружения — это секвенирование ДНК, которое может обнаруживать все возможные мутации в гене KRAS , не ограничиваясь только кодонами 12 и 13.По сравнению с традиционным методом секвенирования по Сэнгеру технология пиросеквенирования предлагает более высокую аналитическую чувствительность и более выгодна для анализа образцов ДНК, выделенных из блоков ткани, залитых парафином (130, 131).
Тестирование BRAF
Помимо KRAS , мутации в других членах сигнального пути EGFR также могут вызывать устойчивость к терапии против EGFR. Хорошим примером является мутация гена BRAF (гомолог B1 вирусного онкогена мышиной саркомы v-raf), о которой сообщалось примерно в 10% случаев колоректального рака (132–134).Есть несколько интересных фактов о мутации BRAF при колоректальном раке. Во-первых, активирующие мутации BRAF и KRAS почти всегда являются взаимоисключающими (135, 136), и, таким образом, тестирование мутации гена BRAF следует рассматривать после отрицательного анализа мутации KRAS . Фактически, многие лаборатории предлагают тест reflex BRAF , если в образце не обнаружена мутация KRAS . Во-вторых, почти все мутации BRAF идентичны точечной мутации V600E (134), которую можно легко обнаружить с помощью ряда коммерчески доступных анализов на основе ПЦР (137).В-третьих, мутация BRAF почти исключительно наблюдается в спорадических опухолях MSI, которые, как предполагается, развиваются по зубчатому канцерогенному пути, но никогда не наблюдались при синдроме Линча (138). Более конкретно, активирующая мутация гена BRAF связана с высоким уровнем глобального метилирования ДНК и эпигенетическим подавлением гена MLh2, обнаруживаемым в 70-90% спорадических колоректальных опухолей с микросателлитным нестабильным фенотипом (136, 139). Следовательно, дальнейшее тестирование мутации BRAF в опухоли MSI поможет прояснить спорадическую или синдромальную природу опухоли (140).В-четвертых, влияние мутации BRAF на прогноз оказывается зависимым от MSI. Как и ожидалось, опухоли BRAF MSI-H дикого типа имеют лучший прогноз, тогда как опухоли MSS с мутацией BRAF связаны с наихудшим исходом. Опухоль BRAF с мутацией MSI-H и опухоль BRAF MSS дикого типа являются промежуточными с точки зрения прогноза (132 133). Таким образом, тестирование на аномалии MMR и мутации BRAF дает дополнительную прогностическую информацию.
Выводы
Колоректальная аденокарцинома — это гетерогенное заболевание, которое включает несколько канцерогенных путей. Патологический анализ предоставляет гистологическую и молекулярную информацию, важную для соответствующего лечения пациента, оценки прогноза и семейного консультирования. Дальнейшее понимание молекулярных механизмов онкогенеза, безусловно, приведет к разработке новых целевых методов лечения и новых молекулярных тестов, которые в конечном итоге принесут пользу пациентам и их семьям.
Благодарности
Раскрытие информации: Авторы заявляют об отсутствии конфликта интересов.
Ссылки
1. Siegel R, Ward E, Brawley O, et al. Статистика рака, 2011 г .: влияние устранения социально-экономических и расовых различий на преждевременную смерть от рака. CA Cancer J Clin 2011; 61: 212-36 [PubMed] [Google Scholar] 2. Ван Х.Л., Лопатеги Дж., Амин М.Б. и др. Тестирование мутации KRAS при раке человека: роль патолога в эпоху персонализированной медицины. Adv Anat Pathol 2010; 17: 23-32 [PubMed] [Google Scholar] 3.Гамильтон С.Р., Босман Ф.Т., Боффетта П. и др. Рак толстой и прямой кишки. В: Классификация опухолей пищеварительной системы ВОЗ. Bosman FT, Carneiro F, Hruban RH, Theise ND, ред. Лион: IARC Press, 2010: 134-46. [Google Scholar] 4. Комптон С.С., Филдинг Л.П., Бургарт Л.Дж. и др. Факторы прогноза при колоректальном раке. Консенсусное заявление Колледжа американских патологов 1999 г. Arch Pathol Lab Med 2000; 124: 979-94 [PubMed] [Google Scholar] 5. Compton CC. Обновленный протокол исследования образцов от пациентов с карциномами толстой и прямой кишки, за исключением карциноидных опухолей, лимфом, сарком и опухолей червеобразного отростка: основа для контрольных списков.Онкологический комитет. Arch Pathol Lab Med 2000; 124: 1016-25 [PubMed] [Google Scholar] 7. Джасс Дж. Р., Аткин В. С., Кузик Дж. И др. Классификация рака прямой кишки: исторические перспективы и многомерный анализ 447 случаев. Гистопатология 1986; 10: 437-59 [PubMed] [Google Scholar] 8. Compton CC. Отчет о патологии при раке толстой кишки: что прогностически важно? Dig Dis 1999; 17: 67-79 [PubMed] [Google Scholar] 9. Эдж С.Б., Берд Д.Р., Комптон С.С. и др. Справочник по стадированию рака AJCC, 7-е издание. Нью-Йорк: Springer, 2010: 173-206.[Google Scholar] 10. Ферхюльст Дж., Фердинанда Л., Деметтер П. и др. Муцинозный подтип как прогностический фактор колоректального рака: систематический обзор и метаанализ. J Clin Pathol 2012; 65: 381-8 [PubMed] [Google Scholar] 11. Канг Х., О’Коннелл Дж. Б., Маггард М.А. и др. 10-летняя оценка результатов муцинозной и перстневидноклеточной карциномы толстой и прямой кишки. Dis Colon Rectum 2005; 48: 1161-8 [PubMed] [Google Scholar] 12. Леопольдо С., Лорена Б., Чинция А. и др. Два подтипа муцинозной аденокарциномы толстой кишки: клинико-патологические и генетические особенности.Энн Сург Онкол 2008; 15: 1429-39 [PubMed] [Google Scholar] 13. Chen JS, Hsieh PS, Chiang JM, et al. Клинические исходы карциномы перстневых клеток и муцинозной аденокарциномы толстой кишки. Chang Gung Med J 2010; 33: 51-7 [PubMed] [Google Scholar] 14. Макино Т., Цудзинака Т., Мисима Х. и др. Первичная клеточная карцинома толстой и прямой кишки: отчет о восьми случаях и обзор 154 случаев в Японии. Гепатогастроэнтерология 2006; 53: 845-9 [PubMed] [Google Scholar] 15. Тирунавукарасу П., Сатаиа М., Сингла С. и др.Медуллярный рак толстой кишки: популяционный анализ. Int J Oncol 2010; 37: 901-7 [Бесплатная статья PMC] [PubMed] [Google Scholar] 16. Хинои Т., Тани М., Лукас П.С. и др. Потеря экспрессии CDX2 и микросателлитная нестабильность являются характерными чертами крупноклеточных минимально дифференцированных карцином толстой кишки. Am J Pathol 2001; 159: 2239-48 [Бесплатная статья PMC] [PubMed] [Google Scholar] 17. Александр Дж., Ватанабе Т., Ву Т.Т. и др. Гистопатологическая идентификация рака толстой кишки с микросателлитной нестабильностью.Am J Pathol 2001; 158: 527-35 [Бесплатная статья PMC] [PubMed] [Google Scholar] 18. Чу П.Г., Вайс Л.М. Экспрессия кератина в тканях и новообразованиях человека. Гистопатология 2002; 40: 403-39 [PubMed] [Google Scholar] 19. МакГрегор Д.К., Ву Т.Т., Рашид А. и др. Снижение экспрессии цитокератина 20 при колоректальных карциномах с высоким уровнем микросателлитной нестабильности. Am J Surg Pathol 2004; 28: 712-8 [PubMed] [Google Scholar] 20. Верлинг Р.В., Язиджи Х., Бакки С.Е. и др. CDX2, высокочувствительный и специфический маркер аденокарцином кишечного происхождения: иммуногистохимическое исследование 476 первичных и метастатических карцином.Am J Surg Pathol 2003; 27: 303-10 [PubMed] [Google Scholar] 21. Каймакчиев В., Терраччиано Л., Торнилло Л. и др. Гомеобоксный фактор кишечной дифференциации CDX2 избирательно экспрессируется в аденокарциномах желудочно-кишечного тракта. Mod Pathol 2004; 17: 1392-9 [PubMed] [Google Scholar] 22. Шеперд Н.А., Бакстер К.Дж., Лав С.Б. Прогностическое значение вовлечения брюшины в рак толстой кишки: проспективная оценка. Гастроэнтерология 1997; 112: 1096-102 [PubMed] [Google Scholar] 24. Нельсон Х., Петрелли Н., Карлин А. и др.Рекомендации 2000 г. по хирургии рака прямой и толстой кишки. J Natl Cancer Inst 2001; 93: 583-96 [PubMed] [Google Scholar] 25. Ван Х., Сафар Б., Векснер С.Д. и др. Клиническое значение удаления жировых лимфатических узлов при инвазивной аденокарциноме прямой кишки после неоадъювантной терапии. Dis Colon Rectum 2009; 52: 1767-73 [PubMed] [Google Scholar] 26. Эрнанц Ф., Гарсия-Сомакаррера Э., Фернандес Ф. Оценка лимфатических узлов, пропущенных в брыжеечной ткани после стандартного вскрытия образцов колоректального рака.Colorectal Dis 2010; 12: e57-e60 [PubMed] [Google Scholar] 27. Märkl B, Kerwel TG, Jähnig HG и др. Диссекция лимфатических узлов с применением метиленового синего в образцах толстой кишки: проспективное рандомизированное исследование. Am J Clin Pathol 2008; 130: 913-9 [PubMed] [Google Scholar] 28. Кервел Т.Г., Спатц Дж., Антхубер М. и др. Введение метиленового синего в нижнюю брыжеечную артерию обеспечивает адекватный забор лимфатических узлов и устраняет патологическую вариабельность узловой стадии рака прямой кишки. Dis Colon Rectum 2009; 52: 935-41 [PubMed] [Google Scholar] 29.Fan L, Levy M, Aguilar CE и др. Извлечение лимфатических узлов из образцов колоректальной резекции аденокарциномы: стоит ли прилагать дополнительные усилия, чтобы найти как минимум 12 узлов? Colorectal Dis 2011; 13: 1377-83 [PubMed] [Google Scholar] 30. Шен С.С., Haupt BX, Ro JY и др. Количество исследованных лимфатических узлов и связанные с ними клинико-патологические факторы колоректальной карциномы. Arch Pathol Lab Med 2009; 133: 781-6 [PubMed] [Google Scholar] 31. Моркос Б., Бейкер Б., Аль Масри М. и др. Выход лимфатических узлов в хирургии рака прямой кишки: эффект предоперационной химиолучевой терапии.Eur J Surg Oncol 2010; 36: 345-9 [PubMed] [Google Scholar] 32. Marks JH, Valsdottir EB, Rather AA и др. После высокодозной химиолучевой терапии рака прямой кишки в хирургическом образце можно ожидать менее 12 лимфатических узлов. Dis Colon Rectum 2010; 53: 1023-9 [PubMed] [Google Scholar] 33. Lo DS, Pollett A, Siu LL, et al. Прогностическое значение узелков брыжеечной опухоли у пациентов с колоректальным раком III стадии. Рак 2008; 112: 50-4 [PubMed] [Google Scholar] 34. Puppa G, Maisonneuve P, Sonzogni A и др.Патологическая оценка периколонических опухолевых отложений при распространенной карциноме толстой кишки: актуальность для прогноза и стадии опухоли. Mod Pathol 2007; 20: 843-55 [PubMed] [Google Scholar] 35. Winawer SJ, Zauber AG, Ho MN, et al. Профилактика колоректального рака с помощью колоноскопической полипэктомии: Национальная рабочая группа по изучению полипов. N Engl J Med 1993; 329: 1977-81 [PubMed] [Google Scholar] 36. Заубер А.Г., Винавер С.Дж., О’Брайен М.Дж. и др. Колоноскопическая полипэктомия и долгосрочное предотвращение смерти от колоректального рака. N Engl J Med 2012; 366: 687-96 [Бесплатная статья PMC] [PubMed] [Google Scholar] 37.Кинзлер К.В., Фогельштейн Б. Уроки наследственного колоректального рака. Cell 1996; 87: 159-70 [PubMed] [Google Scholar] 39. Heitman SJ, Ronksley PE, Hilsden RJ, et al. Распространенность аденом и колоректального рака у лиц среднего риска: систематический обзор и метаанализ. Clin Gastroenterol Hepatol 2009; 7: 1272-8 [PubMed] [Google Scholar] 40. Сновер, округ Колумбия, Анен Д. Д., Берт Р. В. и др. Зубчатые полипы толстой и прямой кишки и зубчатые полипы. В: Классификация опухолей пищеварительной системы ВОЗ.Bosman FT, Carneiro F, Hruban RH, Theise ND, ред. Лион: IARC Press, 2010: 160-5. [Google Scholar] 41. Цай CJ, Лу ДК. Малые колоректальные полипы: гистопатология и клиническое значение. Am J Gastroenterol 1995; 90: 988-94 [PubMed] [Google Scholar] 42. Сновер Д.К., Ясс Дж. Р., Феноглио-Прейзер С. и др. Зазубренные полипы толстой кишки: морфологический и молекулярный обзор развивающейся концепции. Am J Clin Pathol 2005; 124: 380-91 [PubMed] [Google Scholar] 43. Торлакович Э., Сковлунд Э., Сновер Д.К. и др. Морфологическая переоценка зубчатых колоректальных полипов.Am J Surg Pathol 2003; 27: 65-81 [PubMed] [Google Scholar] 44. Гольдштейн Н.С., Бханот П., Одиш Э. и др. Гиперпластические полипы толстой кишки, предшествовавшие микросателлитно-нестабильным аденокарциномам. Am J Clin Pathol 2003; 119: 778-96 [PubMed] [Google Scholar] 45. East JE, Saunders BP, Jass JR. Спорадические и синдромальные гиперпластические полипы и зубчатые аденомы толстой кишки: классификация, молекулярная генетика, естественное течение и клиническое ведение. Gastroenterol Clin North Am 2008; 37: 25-46 [PubMed] [Google Scholar] 46.Глатц К., Притт Б., Глатц Д. и др. Многонациональная интернет-оценка вариабельности наблюдателя при диагностике зубчатых колоректальных полипов. Am J Clin Pathol 2007; 127: 938-45 [PubMed] [Google Scholar] 47. Фаррис А.Б., Мисдраджи Дж., Шривастава А. и др. Сессильная зубчатая аденома: проблема отличия от других зубчатых полипов толстой кишки. Am J Surg Pathol 2008; 32: 30-5 [PubMed] [Google Scholar] 48. Вонг Н.А., Хант Л.П., Novelli MR и др. Согласие наблюдателя в диагностике зубчатых полипов толстой кишки.Гистопатология 2009; 55: 63-6 [PubMed] [Google Scholar] 49. Сновер, округ Колумбия. Обновленная информация о зубчатом пути к колоректальной карциноме. Hum Pathol 2011; 42: 1-10 [PubMed] [Google Scholar] 50. Vu HT, Lopez R, Bennett A, et al. Люди с зубчатыми полипами на сидячем месте проявляют агрессивный колоректальный фенотип. Dis Colon Rectum 2011; 54: 1216-23 [PubMed] [Google Scholar] 51. Blackstone MO, Riddell RH, Rogers BH и др. Поражение или образование, связанное с дисплазией (DALM), обнаруженное с помощью колоноскопии при длительном язвенном колите: показание к колэктомии.Гастроэнтерология 1981; 80: 366-74 [PubMed] [Google Scholar] 52. Батт Дж. Х., Кониси Ф., Морсон BC и др. Макроскопические поражения при дисплазии и карциноме, осложняющие язвенный колит. Dig Dis Sci 1983; 28: 18-26 [PubMed] [Google Scholar] 53. Рубин PH, Фридман С., Харпаз Н. и др. Колоноскопическая полипэктомия при хроническом колите: консервативное лечение после эндоскопической резекции диспластических полипов. Гастроэнтерология 1999; 117: 1295-300 [PubMed] [Google Scholar] 54. Engelsgjerd M, Farraye FA, Odze RD. Полипэктомия может быть адекватным лечением аденомоподобных диспластических поражений при хроническом язвенном колите.Гастроэнтерология 1999; 117: 1288-94 [PubMed] [Google Scholar] 55. Odze RD, Farraye FA, Hecht JL, et al. Долгосрочное наблюдение после лечения полипэктомии по поводу аденомоподобных диспластических поражений при язвенном колите. Clin Gastroenterol Hepatol 2004; 2: 534-41 [PubMed] [Google Scholar] 56. Ицковиц Ш., Присутствует DH. Консенсусная конференция: скрининг колоректального рака и наблюдение за воспалительными заболеваниями кишечника. Воспаление кишечника 2005; 11: 314-21 [PubMed] [Google Scholar] 57. Линч Х.Т., де ла Шапель А. Наследственный колоректальный рак.N Engl J Med 2003; 348: 919-32 [PubMed] [Google Scholar] 58. Стоффель Э., Мукерджи Б., Раймонд В.М. и др. Расчет риска колоректального рака и рака эндометрия у пациентов с синдромом Линча. Гастроэнтерология 2009; 137: 1621-7 [Бесплатная статья PMC] [PubMed] [Google Scholar] 59. Хампель Х., Франкель В.Л., Мартин Э. и др. Скрининг на синдром Линча (наследственный неполипозный колоректальный рак). N Engl J Med 2005; 352: 1851-60 [PubMed] [Google Scholar] 60. Vasen HF, Watson P, Mecklin JP и др. Новые клинические критерии наследственного неполипозного колоректального рака (HNPCC, синдром Линча), предложенные Международной совместной группой по HNPCC.Гастроэнтерология 1999; 116: 1453-6 [PubMed] [Google Scholar] 61. Умар А., Боланд ЧР, Тердиман Дж. П. и др. Пересмотренные рекомендации Bethesda по наследственному неполипозному колоректальному раку (синдром Линча) и микросателлитной нестабильности. J Natl Cancer Inst 2004; 96: 261-8 [Бесплатная статья PMC] [PubMed] [Google Scholar] 62. Бьорк Дж., Акербрант Х., Иселиус Л. и др. Эпидемиология семейного аденоматозного полипоза в Швеции: изменения во времени и различия в фенотипе между мужчинами и женщинами. Сканд Дж. Гастроэнтерол 1999; 34: 1230-5 [PubMed] [Google Scholar] 64.Галиатсатос П., Фоулкс В.Д. Семейный аденоматозный полипоз. Am J Gastroenterol 2006; 101: 385-98 [PubMed] [Google Scholar] 66. Берт RW. Полипы фундальной железы желудка. Гастроэнтерология 2003; 125: 1462-9 [PubMed] [Google Scholar] 67. Bianchi LK, Burke CA, Bennett AE и др. Дисплазия полипа фундальной железы часто встречается при семейном аденоматозном полипозе. Clin Gastroenterol Hepatol 2008; 6: 180-5 [PubMed] [Google Scholar] 68. Ву Т.Т., Корнацкий С., Рашид А. и др. Дисплазия и нарушение регуляции пролиферации фовеолярного и поверхностного эпителия полипов фундальных желез у пациентов с семейным аденоматозным полипозом.Am J Surg Pathol 1998; 22: 293-8 [PubMed] [Google Scholar] 69. Hassan A, Yerian LM, Kuan SF, et al. Иммуногистохимическая оценка экспрессии аденоматозного полипоза кишечной палочки, бета-катенина, c-Myc, циклина D1, p53 и белка ретинобластомы в синдромальных и спорадических полипах фундальной железы. Hum Pathol 2004; 35: 328-34 [PubMed] [Google Scholar] 70. Giardiello FM, Burt RW, Jävinen HJ, et al. Семейный аденоматозный полипоз. В: Классификация опухолей пищеварительной системы ВОЗ. Bosman FT, Carneiro F, Hruban RH, Theise ND, ред.Лион: IARC Press, 2010: 147-51. [Google Scholar] 71. Берт Р.В., Лепперт М.Ф., Слэттери М.Л. и др. Генетическое тестирование и фенотип в большом родстве с ослабленным семейным аденоматозным полипозом. Гастроэнтерология 2004; 127: 444-51 [PubMed] [Google Scholar] 72. Laurent-Puig P, Béroud C, Soussi T.APC gene: база данных зародышевых и соматических мутаций в опухолях и клеточных линиях человека. Nucleic Acids Res 1998; 26: 269-70 [Бесплатная статья PMC] [PubMed] [Google Scholar] 73. Миёси Й., Андо Х., Нагасе Х. и др. Зародышевые мутации гена APC у 53 больных семейным аденоматозным полипозом.Proc Natl Acad Sci USA 1992; 89: 4452-6 [Бесплатная статья PMC] [PubMed] [Google Scholar] 74. Аоки К., Такето ММ. Аденоматозный полипоз кишечной палочки (APC): многофункциональный ген-супрессор опухоли. J Cell Sci 2007; 120: 3327-35 [PubMed] [Google Scholar] 75. Копачова М., Тачечи И., Рейхрт С. и др. Синдром Пейтца-Егерса: диагностический и терапевтический подход. World J Gastroenterol 2009; 15: 5397-408 [Бесплатная статья PMC] [PubMed] [Google Scholar] 76. ван Лиер М.Г., Вагнер А., Матус-Флиген Е.М. и др. Высокий риск рака при синдроме Пейтца-Егерса: систематический обзор и рекомендации по надзору.Am J Gastroenterol 2010; 105: 1258-64 [PubMed] [Google Scholar] 77. Хемминки А., Марки Д., Томлинсон И. и др. Ген серин / треонинкиназы, дефектный при синдроме Пейтца-Егерса. Nature 1998; 391: 184-7 [PubMed] [Google Scholar] 78. Jenne DE, Reimann H, Nezu J и др. Синдром Пейтца-Егерса вызван мутациями в новой сериновой треонинкиназе. Нат Генет 1998; 18: 38-43 [PubMed] [Google Scholar] 79. Каруман П., Гозани О., Одзе Р.Д. и др. Продукт гена Пейтца-Егера LKB1 является медиатором р53-зависимой гибели клеток.Mol Cell 2001; 7: 1307-19 [PubMed] [Google Scholar] 82. ван Хаттем В.А., Бросенс Л.А., де Ленг В.В. и др. Большие геномные делеции SMAD4, BMPR1A и PTEN при ювенильном полипозе. Gut 2008; 57: 623-7 [PubMed] [Google Scholar] 83. Наджент К.П., Талбот И.К., Ходжсон С.В. и др. Одиночные ювенильные полипы: не показатель последующего злокачественного новообразования. Гастроэнтерология 1993; 105: 698-700 [PubMed] [Google Scholar] 84. Аль-Тассан Н., Чмиэль Н.Х., Мейнард Дж. И др. Унаследованные варианты MYH, связанные с соматическими мутациями G : C → T : A в колоректальных опухолях.Нат Генет 2002; 30: 227-32 [PubMed] [Google Scholar] 85. Фаррингтон С.М., Тенеса А., Барнетсон Р. и др. Восприимчивость зародышевой линии к колоректальному раку из-за дефектов гена эксцизионной репарации основания. Am J Hum Genet 2005; 77: 112-9 [Бесплатная статья PMC] [PubMed] [Google Scholar] 86. Липтон Л., Томлинсон И. Фенотип множественной колоректальной аденомы и MYH: основной ген эксцизионной репарации. Clin Gastroenterol Hepatol 2004; 2: 633-8 [PubMed] [Google Scholar] 87. Чидл Дж. П., Сэмпсон-младший. MUTYH-ассоциированный полипоз: от дефекта эксцизионной репарации основания до клинического генетического тестирования.Восстановление ДНК (Amst) 2007; 6: 274-9 [PubMed] [Google Scholar] 88. Сэмпсон-младший, Джонс Н. MUTYH-ассоциированный полипоз. Лучшая практика Res Clin Gastroenterol 2009; 23: 209-18 [PubMed] [Google Scholar] 89. Бопараи К.С., Деккер Э., Ван Иден С. и др. Гиперпластические полипы и зубчатые аденомы сидячей кости как фенотипическое проявление MYH-ассоциированного полипоза. Гастроэнтерология 2008; 135: 2014-8 [PubMed] [Google Scholar] 90. Левин М.Р., Фентон Х., Буркарт А.Л. и др. Плохо дифференцированная колоректальная карцинома с инвазией, ограниченной собственной пластинкой (внутрислизистая карцинома): последующее исследование 15 случаев.Am J Surg Pathol 2007; 31: 1882-6 [PubMed] [Google Scholar] 92. Купер Х.С. Патологические проблемы лечения эндоскопически удаленных злокачественных колоректальных полипов. J Natl Compr Canc Netw 2007; 5: 991-6 [PubMed] [Google Scholar] 93. Батт Дж. М., Тан П., Гонен М. и др. Частота резидуальной болезни после полной эндоскопической резекции злокачественного полипа толстой кишки. Dis Colon Rectum 2012; 55: 122-7 [PubMed] [Google Scholar] 95. Bufill JA. Колоректальный рак: данные о различных генетических категориях, основанных на проксимальном или дистальном расположении опухоли.Энн Интерн Мед 1990; 113: 779-88 [PubMed] [Google Scholar] 96. Беарт Р.У., Мелтон Л.Дж., III, Марута М. и др. Тенденции развития рака правой и левой толстой кишки. Dis Colon Rectum 1983; 26: 393-8 [PubMed] [Google Scholar] 97. Фирон ER, Фогельштейн Б. Генетическая модель колоректального туморогенеза. Cell 1990; 61: 759-67 [PubMed] [Google Scholar] 98. Портела А., Эстеллер М. Эпигенетические модификации и болезни человека. Nat Biotechnol 2010; 28: 1057-68 [PubMed] [Google Scholar] 99. Ямасита К., Дай Т., Дай Й и др. Генетика заменяет эпигенетику фенотипа рака толстой кишки.Cancer Cell 2003; 4: 121-31 [PubMed] [Google Scholar] 100. Байлин С, Бестор ТД. Измененные паттерны метилирования в геномах раковых клеток: причина или следствие? Cancer Cell 2002; 1: 299-305 [PubMed] [Google Scholar] 101. Норри М.В., Хокинс Н.Дж., Тодд А.В. и др. Роль метилирования hMLh2 в развитии синхронных спорадических колоректальных карцином. Dis Colon Rectum 2002; 45: 674-80 [PubMed] [Google Scholar] 103. Ахуджа Н, Исса Дж. П. Старение, метилирование и рак. Histol Histopathol 2000; 15: 835-42 [PubMed] [Google Scholar] 104.Xiong Z, Wu AH, Bender CM и др. Дефицит репарации несоответствия и гиперметилирование CpG-островков при спорадических аденокарциномах толстой кишки. Эпидемиологические биомаркеры рака до 2001 г .; 10: 799-803 [PubMed] [Google Scholar] 105. Chen WY, Zeng X, Carter MG и др. Гетерозиготное нарушение Hic1 предрасполагает мышей к половозависимому спектру злокачественных опухолей. Нат Генет 2003; 33: 197-202 [PubMed] [Google Scholar] 106. Кейн М.Ф., Лода М., Гайда Г.М. и др. Метилирование промотора hMLh2 коррелирует с отсутствием экспрессии hMLh2 в спорадических опухолях толстой кишки и дефектных по восстановлению спаривания линиях опухолевых клеток человека.Cancer Res 1997; 57: 808-11 [PubMed] [Google Scholar] 107. Ма А.Х., Ся Л., Литтман С.Дж. и др. Соматическая мутация hPMS2 как возможная причина спорадического рака толстой кишки человека с микросателлитной нестабильностью. Онкоген 2000; 19: 2249-56 [PubMed] [Google Scholar] 108. Вейгл М.Л., Кастури Л., Олехнович Дж. И др. Двуаллельная инактивация hMLh2 путем подавления эпигенетического гена, нового механизма, вызывающего рак MSI у человека. Proc Natl Acad Sci USA 1998; 95: 8698-702 [Бесплатная статья PMC] [PubMed] [Google Scholar] 109. Шен Л., Кондо Ю., Роснер Г.Л. и др.Метилирование промотора MGMT и дефект поля при спорадическом колоректальном раке. J Natl Cancer Inst 2005; 97: 1330-8 [PubMed] [Google Scholar] 110. Bevilacqua RA, Simpson AJ. Метилирование промотора hMLh2, но отсутствие мутаций hMLh2 в спорадических карциномах желудка с высокой микросателлитной нестабильностью. Int J Cancer 2000; 87: 200-3 [PubMed] [Google Scholar] 111. Герман Дж. Г., Умар А., Поляк К. и др. Частота и функциональные последствия гиперметилирования промотора hMLh2 при колоректальной карциноме. Proc Natl Acad Sci USA 1998; 95: 6870-5 [Бесплатная статья PMC] [PubMed] [Google Scholar] 113.Jass JR. Классификация колоректального рака на основе соотношения клинических, морфологических и молекулярных признаков. Гистопатология 2007; 50: 113-30 [PubMed] [Google Scholar] 114. Sinicrope FA, Sargent DJ. Молекулярные пути: микросателлитная нестабильность при колоректальном раке: прогностические, прогностические и терапевтические последствия. Clin Cancer Res 2012; 18: 1506-12 [Бесплатная статья PMC] [PubMed] [Google Scholar] 115. Боланд CR, Тибодо С.Н., Гамильтон С.Р. и др. Семинар Национального института рака по микросателлитной нестабильности для выявления рака и семейной предрасположенности: разработка международных критериев для определения микросателлитной нестабильности при колоректальном раке.Cancer Res 1998; 58: 5248-57 [PubMed] [Google Scholar] 116. Шнайдер Р., Шнайдер С., Клоор М. и др. Синдром Линча: клинические, патологические и генетические наблюдения. Langenbecks Arch Surg 2012; 397: 513-25 [PubMed] [Google Scholar] 117. Вайсман С.М., Берт Р., Черч Дж. И др. Выявление лиц, подверженных риску синдрома Линча, с использованием целевых оценок и генетического тестирования: Национальное общество консультантов по генетическим вопросам и Совместная группа стран Америки по унаследованному колоректальному раку.Дж. Генет Кунс 2012, 21: 484-93 [PubMed] [Google Scholar] 118. Brink M, de Goeij AF, Weijenberg MP, et al. Мутации онкогена K-ras при спорадическом колоректальном раке в когортном исследовании Нидерландов. Канцерогенез 2003; 24: 703-10 [PubMed] [Google Scholar] 119. Lièvre A, Bachet JB, Le Corre D, et al. Статус мутации KRAS позволяет прогнозировать ответ на терапию цетуксимабом при колоректальном раке. Cancer Res 2006; 66: 3992-5 [PubMed] [Google Scholar] 120. Khambata-Ford S, Garrett CR, Meropol NJ, et al. Экспрессия эпирегулина и амфирегулина, а также статус мутации K-ras позволяют прогнозировать контроль заболевания у пациентов с метастатическим колоректальным раком, получавших цетуксимаб.Дж. Клин Онкол 2007; 25: 3230-7 [PubMed] [Google Scholar] 121. Амадо Р.Г., Вольф М., Петерс М. и др. KRAS дикого типа необходим для эффективности панитумумаба у пациентов с метастатическим колоректальным раком. Дж. Клин Онкол 2008; 26: 1626-34 [PubMed] [Google Scholar] 122. Аллегра CJ, Джессап JM, Somerfield MR, et al. Предварительное клиническое заключение Американского общества клинической онкологии: тестирование мутаций гена KRAS у пациентов с метастатической колоректальной карциномой для прогнозирования ответа на терапию моноклональными антителами к рецептору противоэпидермального фактора роста.Дж. Клин Онкол 2009; 27: 2091-6 [PubMed] [Google Scholar] 123. Национальная всеобъемлющая онкологическая сеть. Руководство NCCN по клинической практике в онкологии: рак толстой кишки v.2.2009. Форт Вашингтон, Пенсильвания: Национальная всеобъемлющая онкологическая сеть. 2009. [Google Scholar] 124. Bos JL. Онкогены Ras при раке человека: обзор. Cancer Res 1989; 49: 4682-9 [PubMed] [Google Scholar] 125. Причард С.С., Акаги Л., Редди П.Л. и др. Анализ кривой плавления с помощью COLD-PCR повышает точность диагностики мутаций KRAS при колоректальной карциноме.BMC Clin Pathol 2010; 10: 6. [Бесплатная статья PMC] [PubMed] [Google Scholar] 126. Лупакис Ф., Руццо А., Кремолини С. и др. Мутации кодона KRAS 61, 146 и BRAF предсказывают устойчивость к цетуксимабу плюс иринотекан в кодоне 12 и 13 KRAS метастатического колоректального рака дикого типа. Br J Cancer 2009; 101: 715-21 [Бесплатная статья PMC] [PubMed] [Google Scholar] 127. Клейтон С.Дж., Скотт Ф.М., Уокер Дж. И др. Обнаружение точечной мутации K-ras при раке легких: сравнение двух подходов к обнаружению соматических мутаций с использованием аллель-специфической амплификации ARMS.Clin Chem 2000; 46: 1929-38 [PubMed] [Google Scholar] 128. Elenitoba-Johnson KS, Bohling SD, Wittwer CT, et al. Мультиплексная ПЦР с помощью многоцветной флуориметрии и флуоресцентного анализа кривой плавления. Nat Med 2001; 7: 249-53 [PubMed] [Google Scholar] 129. Монзон Ф.А., Огино С., Хаммонд М.Э. и др. Роль тестирования мутации KRAS в ведении пациентов с метастатическим колоректальным раком. Arch Pathol Lab Med 2009; 133: 1600-6 [PubMed] [Google Scholar] 130. Огино С., Кавасаки Т., Брахмандам М. и др. Чувствительный метод секвенирования для обнаружения мутации KRAS с помощью пиросеквенирования.J Mol Diagn 2005; 7: 413-21 [Бесплатная статья PMC] [PubMed] [Google Scholar] 131. Дюфорт С., Ричард М.Дж., де Фрайпон Ф. Метод пиросеквенирования для обнаружения мутации KRAS в опухолевых тканях, фиксированных формалином и залитых парафином. Анальная биохимия 2009; 391: 166-8 [PubMed] [Google Scholar] 132. Самовиц В.С., Суини С., Херрик Дж. И др. Низкая выживаемость, связанная с мутацией BRAF V600E, при микросателлитно-стабильном раке толстой кишки. Cancer Res 2005; 65: 6063-9 [PubMed] [Google Scholar] 133. Огино С., Шима К., Мейерхардт Дж. А. и др.Прогностическая и прогностическая роль мутации BRAF при раке толстой кишки III стадии: результаты межгруппового исследования CALGB 89803. Clin Cancer Res 2012; 18: 890-900 [Бесплатная статья PMC] [PubMed] [Google Scholar] 134. Дэвис Х., Бигнелл Г.Р., Кокс С. и др. Мутации гена BRAF при раке человека. Nature 2002; 417: 949-54 [PubMed] [Google Scholar] 135. Раджагопалан Х., Барделли А., Ленгауэр С. и др. Онкогенез: онкогены RAF / RAS и статус несоответствия репарации. Природа 2002; 418: 934. [PubMed] [Google Scholar] 136. Коинума К., Шито К., Миякура Ю. и др.Мутации BRAF связаны с обширным метилированием промотора hMLh2 в спорадических колоректальных карциномах. Int J Cancer 2004; 108: 237-42 [PubMed] [Google Scholar] 137. Lea A, Allingham-Hawkins D, Levine S.BRAF p.Val600Glu (V600E) Тестирование для оценки вариантов лечения метастатического колоректального рака. Версия 2. PLoS Curr 2010; 2: RRN1187. [Бесплатная статья PMC] [PubMed] [Google Scholar] 138. Weisenberger DJ, Siegmund KD, Campan M, et al. Фенотип метилатора CpG-островка лежит в основе спорадической микросателлитной нестабильности и тесно связан с мутацией BRAF при колоректальном раке.Нат Генет 2006; 38: 787-93 [PubMed] [Google Scholar] 139. Каннингем Дж. М., Кристенсен Э. Р., Тестер DJ и др. Гиперметилирование промотора hMLh2 при раке толстой кишки с микросателлитной нестабильностью. Cancer Res 1998; 58: 3455-60 [PubMed] [Google Scholar] 140. Лагерстедт Робинсон К., Лю Т., Вандровцова Дж. И др. Диагностика синдрома Линча (наследственный неполипозный колоректальный рак). J Natl Cancer Inst 2007; 99: 291-9 [PubMed] [Google Scholar]Инвазивная карцинома толстой кишки | Отделение патологии UIC
ПОНИМАНИЕ ОТЧЕТА О ПАТОЛОГИИ: ЛИСТ часто задаваемых вопросов
При биопсии или резекции толстой кишки взятые образцы изучались под микроскопом врачом-патологом с многолетней подготовкой.В отчете о патологии вашему лечащему врачу сообщается диагноз по каждой из проб, чтобы помочь вам управлять вашим лечением. Этот лист часто задаваемых вопросов разработан, чтобы помочь вам понять медицинский язык, используемый в отчете о патологии.
Ободочная кишка является частью желудочно-кишечной системы, которая обрабатывает пищу, так что части, которые могут использоваться для получения энергии и построения тела, могут быть поглощены и использованы организмом. Работа толстой кишки состоит в том, чтобы поглощать воду из остатков пищи, а также последних нескольких питательных веществ. Он также накапливает остатки пищи, называемые фекалиями, до тех пор, пока не станет удобно избавляться от них.Толстая кишка большая и иногда ее называют «толстой кишкой». Он начинается в нижней правой части живота и образует почти полный круг по краю живота. Пищевые отходы жидкие, когда попадают в толстую кишку. По мере проталкивания через толстую кишку мускулами в стенке толстой кишки вода выводится из отходов, и отходы становятся более твердыми.
1. Что, если в моем отчете упоминаются «слепая кишка», «восходящая ободочная кишка», «поперечная ободочная кишка», «нисходящая ободочная кишка», «сигмовидная кишка» или «прямая кишка»?
Ободочная кишка делится врачами на разные части, чтобы помочь определить местонахождение поражения.Слепая кишка — это начало толстой кишки, где тонкая кишка переходит в толстую. Далее идет восходящая ободочная кишка, которая идет вверх по правой стороне живота. Затем поперечная ободочная кишка переходит на левую сторону под желудком и печенью и становится нисходящей ободочной кишкой, которая идет вниз вдоль левой стороны живота. Сигмовидная кишка является последней и находится внизу живота. Сигмовидная кишка связана с анусом самой короткой частью толстой кишки, называемой прямой кишкой.Кал или пищевые отходы выходят из организма через задний проход.
2. Что обычно присутствует в толстой кишке?
Ободочная кишка имеет слизистую оболочку, которая состоит из столбчатых клеток, образующих трубки, называемые криптами. Столбчатые ячейки называются столбчатыми, потому что они намного выше ширины. Столбчатые клетки в толстой кишке расположены в криптах, которые выглядят как длинные карманы или трубки. Клетки слизистой вырабатывают муцин, который помогает смазывать движение пищевых отходов по толстой кишке.Снаружи слизистую оболочку окружают мышечные пучки, составляющие стенку толстой кишки. Мышцы в стенке толстой кишки сокращаются и выдавливают отходы пищи к анальному отверстию.
3. Что такое аденокарцинома толстой кишки?
Аденокарцинома толстой кишки — наиболее распространенный тип рака толстой кишки (злокачественная опухоль). Рак толстой кишки не похож. Рак толстой кишки имеет широкий спектр поведения: от очень медленно растущего рака с низким риском причинения вреда до рака, который является более агрессивным и может распространяться на другие области вашего тела.
4. Что означает «инвазивный» или «инфильтрирующий»?
Поскольку рак толстой кишки разрастается и распространяется за пределы внутренней оболочки толстой кишки (слизистой оболочки), его называют «инвазивной аденокарциномой». Затем он может распространиться на другие части тела.
5. Означает ли это, что опухоль проникла глубоко и имеет плохой прогноз?
Не обязательно. При биопсии патолог обычно не может определить глубину инвазии опухоли. Глубина инвазии опухоли, а также прогноз обычно определяются при последующем удалении всей опухоли.
6. Что означает дифференциация?
Дифференциация — это степень рака, определяемая по его микроскопическому виду. Это показатель агрессивности рака. Рак толстой кишки обычно делится на три степени (хорошо дифференцированный, умеренно дифференцированный и слабо дифференцированный) или иногда на две степени (хорошо-умеренно дифференцированный и слабо дифференцированный).
7. Какое значение имеет степень рака толстой кишки?
Степень — это один из многих факторов, которые помогают определить агрессивность данного рака.Плохо дифференцированный рак толстой кишки имеет тенденцию быть более агрессивным, чем хорошо и умеренно дифференцированный рак толстой кишки. Однако другие факторы, помимо степени, например, насколько далеко распространился рак (который не может быть определен при биопсии), также влияют на прогноз.
8. Что означает сосудистая, лимфатическая или лимфоваскулярная инвазия?
Эти термины означают, что рак присутствует в сосудах (артериях, венах и / или лимфатических сосудах) толстой кишки и что существует повышенная вероятность распространения рака за пределы толстой кишки.Однако ваш рак все еще может быть излечим в зависимости от других факторов.
9. Что такое полип?
Полип — это выступ (разрастание) ткани из внутренней оболочки толстой кишки в просвет (полый центр) толстой кишки. Различные типы полипов имеют определенный микроскопический вид. Обычно они не являются злокачественными (доброкачественными), но в некоторых случаях рак может возникать при различных типах полипов.
10. Что это значит, если помимо рака в моем отчете говорится, что существуют и другие полипы, такие как аденоматозный полип (аденома) или гиперпластические полипы?
Полипы очень распространены и при раке в другом месте толстой кишки обычно не влияют на лечение и не о чем беспокоиться.
11. Какое значение имеет упоминание «муцина» или «коллоида» в моем отчете?
Муцин вырабатывается толстой кишкой для смазывания толстой кишки. Рак толстой кишки, который продуцирует большое количество муцина, называется муцинозной или коллоидной аденокарциномой. Однако в образце биопсии наличие «муцина» или «коллоида» не определяет прогноз или лечение.
12. Что означает, если в моем отчете о биопсии упоминаются специальные исследования, такие как микросателлитная нестабильность и MSh3, MSH6, MLh2 и PMS2?
При некоторых формах рака толстой кишки специальные лабораторные исследования могут выявить аномалию, называемую «микросателлитная нестабильность».Нестабильность микросателлитов связана с несколькими белками, включая MSh3, MSH6, MLh2 и PMS2. Нестабильность микросателлитов может быть связана с генетическим дефектом, который может присутствовать у других членов семьи. Иногда могут потребоваться дополнительные тесты, и ваш врач может помочь определить, когда они необходимы. Ваш врач может использовать эти результаты анализов, чтобы изменить ваш план лечения (тип или использование химиотерапии) или направить тестирование других членов семьи.
Рак прямой кишки: Аденокарцинома прямой кишки
Что такое рак прямой кишки (аденокарцинома прямой кишки)
Рак прямой кишки может относиться к типу аденокарциномы и обычно возникает из эпителия (слоя клеток), выстилающего толстую кишку.
Ободочная кишка является частью толстой кишки. Толстый кишечник начинается в конце тонкой кишки (подвздошной кишки), у слепой кишки. Слепая кишка имеет аппендикс. Начало ободочной кишки — восходящая ободочная кишка, и там, где она поднимается, чтобы встретить печень (изгиб печени), она становится поперечной ободочной кишкой. Поперечная ободочная кишка проходит через верхнюю часть живота, пока не становится смежной с селезенкой (селезеночный изгиб), и в этот момент она становится нисходящей ободочной кишкой. В этой точке толстая кишка спускается вниз по брюшной полости к тазу, где она становится сигмовидной кишкой (потому что она изгибается в форме буквы «S», а сигма в переводе с греческого означает «S»).Сигмовидная кишка заканчивается у прямой кишки, которая действует как мешочек для хранения фекалий, прежде чем они будут эвакуированы через задний проход.
В целом функция толстой кишки заключается в поглощении воды из стула. Когда подвздошная кость попадает в слепую кишку, она становится чрезвычайно жидкой и постепенно затвердевает по мере продвижения содержимого по толстой кишке.
Статистика рака прямой кишки (аденокарцинома прямой кишки)
Рак прямой кишки встречается часто, но очень редко встречается у молодых людей.С возрастом рак прямой кишки встречается все чаще. Наибольшему риску подвержены люди в возрасте 50, 60 и 70 лет, при этом половая принадлежность немного чаще встречается у женщин.
Географически опухоль рака прямой кишки встречается во всем мире, но рак прямой кишки наиболее распространен в регионах с низким содержанием клетчатки. Регионы мира с высоким потреблением жиров и низким потреблением клетчатки, такие как Европа, США и Австралия.
Факторы риска рака прямой кишки (аденокарцинома прямой кишки)
Существует ряд факторов, повышающих риск развития рака прямой кишки:
- Наследственные заболевания: Особо высокому риску рака прямой кишки подвержены люди с наследственными заболеваниями, такими как семейный аденоматозный полипоз или наследственный неполипозный колоректальный рак.В этих условиях это может произойти даже у молодых людей, например поздний подростковый возраст и начало 20-х годов.
- Семейный анамнез рака прямой кишки: Родственники первой степени родства пациентов с раком прямой кишки имеют повышенный риск, особенно если у родственника развивается рак прямой кишки в молодом возрасте.
- Полипы: Определенные типы полипов, особенно ворсинчатые аденомы, могут стать злокачественными. Пациентам с раком прямой кишки, у которых ранее был полип в толстой кишке, следует регулярно проходить колоноскопию (спросите своего врача, как часто).
- Воспалительное заболевание кишечника: Пациенты, страдающие язвенным колитом, имеют примерно десятикратный риск развития болезни и должны регулярно проходить колоноскопию.
- Диета: Диета с высоким содержанием жиров и низким содержанием клетчатки, особенно с высоким содержанием красного мяса, является худшей диетой, предрасполагающей к раку прямой кишки. Люди, страдающие ожирением, также подвергаются повышенному риску.
Прогрессирование рака прямой кишки (аденокарцинома прямой кишки)
Опухоль рака прямой кишки распространяется через стенку кишечника.Как только он проходит через мышечный слой в стенке кишечника, он попадает в лимфатические сосуды, распространяясь на местные, а затем региональные лимфатические узлы. Иногда рак прямой кишки распространяется через кровоток в печень, которая является наиболее частой областью метастазирования этой опухоли. Другие органы, которые могут быть затронуты путем распространения с кровью, — это легкие, реже кости и еще реже мозг.
Если много опухолевых клеток проходит через стенку кишечника, они имеют тенденцию перемещаться в виде небольшого количества жидкости в брюшной полости и могут заразить покрытие кишечника (брюшины).При таком посеве в брюшной полости образуются небольшие узелки, которые раздражают ткани и вызывают образование большого количества асцита (жидкости). Прямое распространение из прямой кишки может привести к прикреплению опухоли к мочевому пузырю у мужчин и возникновению свищей. У женщин он может поражать влагалище или соседние органы малого таза.
Как диагностируется рак прямой кишки (аденокарцинома прямой кишки)?
Общие исследования рака прямой кишки могут выявить анемию или нарушение функции печени. Уровень альбумина в крови может быть низким (альбумин вырабатывается в основном в печени.Это помогает предотвратить утечку крови из кровеносных сосудов. Когда уровень альбумина падает, жидкость может скапливаться в лодыжках, легких или брюшной полости). Если поражение печени тяжелое, профиль свертывания будет ненормальным с повышенным МНО.
Прогноз рака прямой кишки (аденокарцинома прямой кишки)
Ранний рак прямой кишки имеет очень хороший прогноз. Если они не проникли через мышечную стенку, подавляющее большинство из них излечиваются хирургическим путем. После того, как опухоль пробила мышечную стенку и перешла в региональные лимфатические узлы, более 60% пациентов с раком прямой кишки будут жить не менее 5 лет.Если опухоль рака прямой кишки распространилась на другие органы, такие как печень или легкие, текущая 5-летняя выживаемость составляет примерно 10%.
5-летняя выживаемость по этапам:
- Dukes A: 90% 5 YS
- Герцоги B: 70% 5 лет
- Dukes C: 50% 5 лет
- Dukes D: 10% 5 YS
Были также попытки дополнительно классифицировать каждую стадию, особенно герцоги B и C, используя классификацию в стиле TNM. Это дает этапы с I по IV (что примерно эквивалентно этапам Dukes, но дает этапы IIA и B, этап IIIA snd B и т. Д.)Прогноз IIIA приближается к прогнозу IIB и т. Д. Это пока не широко используется).
Появление новых химиотерапевтических агентов оказало значительное влияние на прогноз рака прямой кишки. Иринотекан и оксалиплатин в сочетании с 5FU обеспечивают значительные преимущества в течение длительного времени, золотого стандарта 5-дневной болюсной дозы 5FU — режима Мейо. Новые агенты, особенно биологические агенты бевацизумаб и цетуксимаб, похоже, значительно улучшат прогноз этих опухолей рака прямой кишки.
Как лечится рак прямой кишки (аденокарцинома прямой кишки)?
Очевидно, что предпочтительным методом лечения рака прямой кишки является хирургическое вмешательство на ранних стадиях заболевания. Для опухолей стадии А по Дьюку (которые не достигли мышечного слоя в стенке кишечника) это обычно излечивает примерно в 90% случаев.
Операция при раке прямой кишки обычно проводится одним из двух методов:
- Передняя резекция — это место резекции прямой кишки после операции спереди.Анус сохраняется вместе с анальной функцией.
- Абдоминально-перонеальная резекция обычно выполняется при опухолях в нижней части прямой кишки и требует удаления заднего прохода. Затем необходима колостома.
Иногда колостома может использоваться временно при любой операции на кишечнике в качестве защитного метода, позволяющего заживить запланированной операции. Операция по поводу рака прямой кишки обычно проводится для удаления первичной опухоли у всех, кроме Dukes D (болезнь Стадии IV.В некоторых случаях болезни Дюка D, если кишечник выглядит так, как будто он закупорен, первичная опухоль может быть удалена.
Если рак прямой кишки пробил стенку кишечника, особенно если он попал в местные лимфатические узлы, адъювантная химиотерапия повысит шанс излечения. То же самое верно, если он распространился на региональные лимфатические узлы. Существует четкое единодушие во мнении, что стадия С по Дьюку должна получать адъювантную химиотерапию. Опухоли Dukes B также могут получить пользу от адъювантного лечения.Это решение принимается в индивидуальном порядке.
Если рак прямой кишки распространился дальше, например, на печень, более длительное паллиативное лечение может быть достигнуто хирургическим вмешательством на первичной опухоли для предотвращения непроходимости кишечника с последующим специфическим лечением метастазов.
Режимы химиотерапии
Стандартная адъювантная терапия — это 5-фторурацил и фолинат кальция в течение шести месяцев. Стандартная терапия метастазов — иринотекан, 5-фторурацил и лейковорин.Каждый из агентов в этом режиме вводится путем внутривенной инъекции еженедельно в течение 4 недель каждые 6 недель. При метастазах в печень новый метод заключается в помещении радиоактивного материала в кровеносные сосуды, снабжающие печень. Радиоактивный материал попадает в кровеносные сосуды, кровоснабжающие опухоль, и облучает опухоль изнутри. Это можно комбинировать с химиотерапией в попытке уничтожить любые другие опухолевые клетки, которые распространились в другом месте. Следите за новостями на этом сайте о раке прямой кишки.
Если есть только единичные метастазы в одну сторону печени, есть довольно веский аргумент в пользу операции по удалению единичных метастазов у пациентов с раком прямой кишки, которые в остальном физически довольно здоровы.После резекции печени обычно назначают химиотерапию.
Если рак прямой кишки распространился на кость и вызывает боль, местная лучевая терапия может быть очень полезной для контроля местных симптомов. Из-за анатомического положения прямой кишки (относительно удаленной от других частей кишечника) лучевая терапия часто назначается после операции в качестве адъювантного лечения. При рецидивирующем местном заболевании лучевая терапия также играет очень важную роль в предотвращении его распространения.
Улучшение симптомов рака прямой кишки — важное измерение.Конкретный мониторинг может осуществляться путем измерения СЕА в сыворотке. Если была достигнута радикальная хирургическая резекция, рекомендуется проводить ежегодные повторные проверки с помощью колоноскопии. Визуализацию обычно проводят с помощью УЗИ или КТ для выявления рецидива в печени или лимфатических узлах. При метастатическом заболевании сывороточный CEA может быть очень полезным для определения ответа на лечение. Можно отслеживать аномальные функциональные тесты печени и выполнять визуализацию любых метастазов в мягких тканях, таких как печень или легкие.
Симптомы рака прямой кишки, которые могут требовать внимания, включают усталость от анемии и чувство тенезмов (желание открыть кишечник при отсутствии стула может быть особенно неприятным, особенно когда оно болезненно). Пациентам с раком прямой кишки может потребоваться лечение висцеральной боли из-за метастазов в печень и реже соматической боли из-за метастазов в кости. При наличии метастазов в легких возможно появление плеврального выпота, вызывающего одышку. Выпот может потребовать дренажа.
.