Эрадикационная терапия хеликобактер пилори — схема и препараты
Марина Поздеева о принципах и схемах антихеликобактерной терапии
Колонизация Helicobacter pylori поверхности и складок слизистой оболочки желудка значительно затрудняет антибактериальную терапию. Успешная схема лечения основана на сочетании препаратов, которые предотвращают возникновение резистентности и настигают бактерию в различных участках желудка. Терапия должна гарантировать, что даже небольшая популяция микроорганизмов не останется жизнеспособной.
Эрадикационная терапия Helicobacter pylori включает комплекс нескольких препаратов. Распространенная ошибка, которая зачастую приводит к непредсказуемым результатам, — замена даже одного хорошо изученного препарата из стандартной схемы на другой препарат той же группы.
Ингибиторы протонной помпы (ИПП)
Терапия ИПП доказала эффективность в различных клинических исследованиях. Хотя in vitro ИПП и оказывают прямой антибактериальный эффект на H. pylori, тем не менее они не играют важной роли в эрадикации инфекции.
Механизм синергии ИПП при сочетании с противомикробными препаратами, который повышает клиническую эффективность эрадикационной терапии, полностью не установлен. Предполагается, что антисекреторные препараты группы ИПП могут способствовать повышению концентрации антимикробных средств, в частности метронидазола и кларитромицина, в просвете желудка. ИПП уменьшают объем желудочного сока, вследствие чего вымывание антибиотиков с поверхности слизистой уменьшается, и концентрация, соответственно, увеличивается. Кроме того, снижение объема соляной кислоты поддерживает стабильность антимикробных препаратов.
Препараты висмута
Висмут стал одним из первых препаратов для эрадикации H. pylori. Существуют доказательства, что висмут оказывает непосредственное бактерицидное действие, хотя его минимальная ингибирующая концентрация (МИК — наименьшее количество препарата, ингибирующее рост возбудителя) в отношении H. pylori слишком высока. Как и другие тяжелые металлы, такие как цинк и никель, соединения висмута снижают активность фермента уреазы, который принимает участие в жизненном цикле H. pylori. Кроме того, препараты висмута обладают местной антимикробной активностью, действуя непосредственно на клеточную стенку бактерий и нарушая ее целостность.
Метронидазол
H. pylori, как правило, очень чувствительны к метронидазолу, эффективность которого не зависит от pH среды. После перорального или инфузионного применения в желудочном соке достигаются высокие концентрации препарата, что позволяет достичь максимального терапевтического эффекта. Метронидазол — это пролекарство, которое в процессе метаболизма проходит активацию бактериальной нитроредуктазой. Метронидазол приводит к потере спиральной структуры ДНК H. pylori, в результате чего происходит поломка в ДНК и бактерия погибает.
NB! Результат лечения считается положительным, если результаты теста на H. pylori, проведенного не ранее 4 недель после курса лечения, будут отрицательными. Проведение теста до истечения 4 недель после эрадикационной терапии значительно повышает риск ложноотрицательных результатов. Предпочтительна отмена приема ИПП за две недели до диагностики.
 Эрадикационная терапия хеликобактер пилори: схема
Эрадикационная терапия хеликобактер пилори: схема
Кларитромицин
Кларитромицин, 14‑членный макролид, представляет собой производное эритромицина с аналогичным спектром активности и показаниями к применению. Однако в отличие от эритромицина он более устойчив к воздействию кислот и имеет более длительный период полувыведения. Результаты исследований, доказывающих, что схема тройной эрадикационной терапии хеликобактер пилори с использованием кларитромицина дает положительный результат в 90 % случаев, привели к широкому использованию антибиотика.
В связи с этим в последние годы было зафиксировано увеличение распространенности устойчивых к кларитромицину штаммов H. pylori. Нет никаких доказательств того, что увеличение дозы кларитромицина позволит преодолеть проблему антибиотикорезистентности к препарату.
Амоксициллин
Антибиотик пенициллинового ряда, амоксициллин и структурно, и по спектру активности очень близок к ампициллину. Амоксициллин стабилен в кислой среде. Препарат ингибирует синтез клеточной стенки бактерий, действует и местно, и системно после абсорбции в кровоток и последующего проникновения в просвет желудка. H. pylori демонстрирует хорошую чувствительность к амоксициллину in vitro, однако для эрадикации бактерии требуется комплексная терапия.
Тетрациклины
Точкой приложения тетрациклинов является бактериальная рибосома. Антибиотик прерывает биосинтез белка и специфически связывается с 30‑S субъединицей рибосомы, исключая добавление аминокислот к растущей пептидной цепи. Тетрациклин доказал in vitro эффективность против H. pylori и сохраняет активность при низком pH.

Показания к эрадикационной терапии
В соответствии с принципами, утвержденными в Маастрихте в 2000 году (the Maastricht 2–2000 Consensus Report), эрадикация H. pylori настоятельно рекомендуется:
- всем больным с язвенной болезнью;
- пациентам с низкодифференцированной MALT-лимфомой;
- лицам с атрофическим гастритом;
- после резекции по поводу рака желудка;
- родственникам больных раком желудка первой степени родства.
Необходимость проведения эрадикационной терапии пациентам с функциональной диспепсией, ГЭРБ, а также лицам, длительно принимающим нестероидные противовоспалительные препараты, пока остается предметом дискуссий. Доказательств того, что эрадикация H. pylori у подобных больных влияет на течение заболевания, нет. Однако хорошо известно, что у лиц с H. pylori, страдающих неязвенной диспепсией и корпус-преобладающим гастритом, повышается риск развития аденокарциномы желудка. Таким образом, эрадикацию H. pylori следует рекомендовать также и пациентам с неязвенной диспепсией, особенно если в гистологии выявляется корпус-преобладающий гастрит.
Аргумент против антихеликобактерной терапии у пациентов, принимающих НПВП, таков: организм защищает слизистую оболочку желудка от повреждающего действия лекарственных препаратов, повышая активность циклооксигеназы и синтез простагландина, а ИПП снижают естественную защиту. Тем не менее ликвидация H. pylori до назначения НПВП достоверно снижает риск язвенной болезни на фоне последующего лечения (исследование американских ученых под руководством Франсиса Чана (Francis K. Chan), опубликованное в The Lancet в 1997 году).
Эрадикационная терапия
Несмотря на применение комбинированных схем лечения, у 10–20 % пациентов, инфицированных H. pylori, не удается достичь элиминации возбудителя. Наилучшей стратегией считается подбор наиболее эффективной схемы лечения, однако не следует исключать возможность использования двух и даже более последовательных схем в случае недостаточной эффективности терапии выбора.
В случае неудачной первой попытки эрадикации H. pylori рекомендуют сразу перейти к терапии второй линии. Посев на чувствительность к антибиотикам и переход на схемы терапии спасения показан только тем пациентам, у которых терапия второй линии также не приведет к эрадикации возбудителя.

Одной из самых эффективных «схем спасения» является комбинация ИПП, рифабутина и амоксициллина (или левофлоксацина по 500 мг) на протяжении 7 дней. Исследование итальянских ученых, проведенное под руководством Фабрицио Перри (Fabrizio Perri) и опубликованное в Alimentary Pharmacology & Therapeutics в 2000 году, подтвердило, что схема с рифабутином эффективна против штаммов H. pylori, резистентных к кларитромицину или метронидазолу. Однако высокая цена рифабутина ограничивает его широкое применение.
NB! Во избежание формирования резистентности одновременно к метронидазолу и кларитромицину эти препараты никогда не комбинируют в одной схеме. Эффективность подобной комбинации очень высока, однако у пациентов, не ответивших на терапию, обычно формируется устойчивость сразу к обоим препаратам (исследование немецких ученых под руководством Ульриха Пейтца (Ulrich Peitz), опубликованное в Alimentary Pharmacology & Therapeutics в 2002 году). И дальнейший подбор терапии вызывает серьезные затруднения.
Данные исследований подтверждают, что 10‑дневная схема терапии спасения, включающей рабепразол, амоксициллин и левофлоксацин, гораздо эффективнее, чем стандартная эрадикационная терапия второй линии (исследование итальянских ученых под руководством Энрико Ниста (Enrico C Nista), опубликованное в Alimentary Pharmacology & Therapeutics в 2003 году).
www.katrenstyle.ru
Эрадикация Нelicobacter pylori – пути достижения эффективности | Лоранская И.Д., Степанова Е.В., Ракитская Л.Г., Мамедова Л.Д.
Представлены данные о хеликобактериозе, побочных эффектах эрадикационной терапии Нelicobacter (Н.) pylori, адъювантном варианте эрадикации.
Эрадикационная терапия не всегда является успешной, что сопряжено с растущей резистентностью штаммов Н. pylori к антибактериальным препаратам, а также с низкой комплаентностью пациентов, прекращением терапии из-за развития побочных эффектов. Использование пробиотических препаратов, в частности Lactobacillus (L.) reuteri, позволяет улучшить переносимость эрадикационной терапии, а также снизить количество и активность Н. pylori.
Применение штамма L. reuteri, обладающего выраженной антихеликобактерной активностью, в качестве адъюванта антихеликобактерной терапии представляется перспективным.
Н. pylori – неинвазивный микроб, колонизирующий преимущественно поверхностные слои слизистой оболочки (CO) желудка. Представляет собой грамотрицательную спиралевидную бактерию, имеющую на одном своем конце 4–5 жгутиков. Н. pylori сумел адаптироваться к резко кислой среде желудка благодаря небольшому размеру генома и способности к быстрым мутациям в неблагоприятных условиях для его жизнедеятельности. С помощью униполярно расположенных жгутиков Н. pylori перемещается в слое желудочной слизи в поисках оптимальных условий для колонизации CO желудка. При возникновении угрозы для существования спиралевидные формы Н. pylori трансформируются в кокковые, у которых резко снижен обмен веществ и редуцирована репродуктивная способность, но повышена устойчивость к неблагоприятным внешним воздействиям. Это позволяет им выжить при транзите через кишечник и сохраняться во внешней среде (в фекалиях, возможно, в почве и/или воде). Главным источником Н. pylori-инфекции является сам человек, а основным путем инфицирования – фекально-оральный; орально-оральный путь имеет вспомогательное значение [10, 23].
Попадая в желудок, бактерия продуцирует уреазу, которая расщепляет мочевину желудочного содержимого, вследствие чего образуются аммиак и СО2. Аммиак способствует защите микроба от соляной кислоты и вызывает повреждение СО желудка. Выделяя фермент муциназу, Н. pylori разрушает белок муцин, содержащийся в желудочной слизи, в результате чего создаются условия для проникновения бактерии через слой слизи и адгезии ее на эпителий СО желудка [4, 7].
В микробиоме желудка Н. pylori является «хозяином», хотя эффект его доминирования неясен [25]. Существует 196 штаммов Н. pylori [24]. Маркерами вирулентности Н. pylori могут служить такие гены, как cagА (способствующий индукции воспаления и секреции цитотоксичных веществ), vacА (продуцирующий вакуолизирующий цитотоксин), iceА (наиболее токсичен ice А1, способствующий адгезии Н. pylori на эпителиоцитах СО желудка) [5, 10].
Примерно 60% населения земного шара инфицировано H. рylori; распространена инфекция преимущественно в развивающихся странах, а также у пожилых. Длительное время остается асимптомной. Эффективной вакцины для предотвращения инфекции в настоящее время не существует [13, 28].
Н. pylori-инфекция является наиболее частой причиной (60–75%) развития неатрофического антрального гастрита, который постепенно (в течение 15–18 лет) может эволюционировать в антральный атрофический хронический гастрит, распространяться в антрокардиальном направлении, поражая фундальный отдел желудка, а в части случаев вызывать развитие мультифокального атрофического хронического гастрита, появление в СО желудка очагов кишечной метаплазии, эпителиальной дисплазии, неоплазии (предрака). С Н. рylori ассоциированы язвенная болезнь, реже – рак желудка и МАLТ-лимфома желудка [10, 23].
Протеазы, высвобождающиеся полиморфноядерными лейкоцитами в ответ на инфекцию Н. pylori, разрушают эпителий желез СО желудка, что в конце концов ведет к развитию атрофии [6, 15]. Кроме того, инфекция Н. pylori способствует выработке антител, которые перекрестно реагируют с париетальными клетками и могут вызвать их атрофию. В свою очередь, ахлоргидрия способствует размножению бактерий в желудке, трансформирующих нитраты в нитриты и приводящих к образованию N-нитрозосоединений, обладающих канцерогенными свойствами. Под действием Н. pylori изменяется баланс между процессами пролиферации и апоптоза, в результате чего нарушается физиологическая регенерация СО желудка, увеличивается образование свободных радикалов, аммиака, оксида азота, также обладающих канцерогенными свойствами. При длительном существовании инфекции Н. pylori возможны мутации гена р53, обеспечивающего противоопухолевую защиту, в результате чего могут появляться эпителиальные клетки с поврежденной ДНК и прогрессировать явления дисплазии эпителия. Инфекция Н. pylori приводит к снижению содержания аскорбиновой кислоты, β-каротина, α-токоферола, обеспечивающих противоопухолевую защиту [6, 14]. В 1994 г. Международным агентством по изучению рака (IARC) Н. pylori отнесен к канцерогенам 1 класса («определенно доказанным»). Наличие инфекции Н. pylori повышает риск развития рака желудка в 4–20 раз [6, 19].
Известно, что некоторые популяции с высоким уровнем инфицирования Н. pylori (в странах Восточной Азии) имеют высокую заболеваемость раком желудка, тогда как другие высокоинфицированные (в странах Южной и Западной Африки) имеют низкую частоту развития рака. Этот феномен назван «африканской загадкой» и может быть объяснен разностью генотипов Н. pylori, особенно cagА и vacА [25].
Основой лечения заболеваний, ассоциированных с Н. pylori, является эрадикация этой инфекции. Известно, что риск возникновения пептической язвы и рака желудка возрастает с повышением уровня инфицирования Н. pylori, следовательно, подавление Н. pylori-инфекции снижает риск этих заболеваний [20]. Кроме того, эрадикация Н. рylori признана наиболее перспективной стратегией снижения заболеваемости раком желудка [1, 21].
Последнее согласительное совещание «Маастрихт-4» (2010 г.) ограничило число применяемых схем эрадикации инфекции Н. pylori до 5:
– стандартная 3-компонентная терапия (ингибитор протонной помпы (ИПП) в стандартной дозе 2 р./сут + амоксициллин по 1000 мг 2 р./сут + кларитромицин 500 мг 2 р./сут в течение 7–14 дней;
– 4-компонентная терапия с препаратами висмута (ИПП в стандартной дозе 2 р./сут + тетрациклин 500 мг 4 р./сут + метронидазол 500 мг 3 р./сут + висмута трикалия дицитрат 120 мг 4 р./сут) в течение 10–14 дней;
– последовательная терапия (в течение первых 5 дней – ИПП в стандартной дозе 2 р./сут + амоксициллин по 1000 мг 2 р./сут, следующие 5 дней – ИПП в стандартной дозе 2 р./сут + кларитромицин 500 мг 2 р./сут + метронидазол 500 мг 3 р./сут;
– 4-компонентная терапия без препаратов висмута (ИПП в стандартной дозе 2 р./сут + амоксициллин 1000 мг 2 р./сут + кларитромицин 500 мг 2 р./сут + еще один антибактериальный препарат, например метронидазол 500 мг 3 р./сут) в течение 10–14 дней;
– 3-компонентная терапия с левофлоксацином (ИПП в стандартной дозе 2 р./сут + амоксициллин 1000 мг 2 р./сут + левофлоксацин 500 мг 2 р./сут) в течение 10–14 дней.
В зонах с низкой (<10%) резистентностью штаммов Н. pylori к кларитромицину (в России этот показатель составляет 7,6%) в качестве схемы первой линии назначают стандартную 3-компонентную терапию, последовательную или 4-компонентную терапию с препаратами висмута. В качестве схем эрадикации второй линии применяют 4-компонентную терапию с препаратами висмута, 3-компонентную терапию с левофлоксацином. Схема эрадикации третьей линии формируется с учетом результатов определения чувствительности штаммов Н. pylori к антибиотикам.
В зонах с высокой резистентностью к кларитромицину в качестве режимов эрадикации первой линии применяют 4-компонентные схемы с препаратами висмута, последовательную 4-компонентную терапию без препаратов висмута. В качестве терапии второй линии применяется 3-компонентная схема с левофлоксацином, а схема эрадикации третьей линии формируется с учетом результатов определения чувствительности Н. pylori к антибиотикам.
При наличии аллергии к пенициллину в зонах с низкой резистентностью к кларитромицину назначают схему с ИПП, кларитромицином и метронидазолом, в зонах с высокой резистентностью к кларитромицину – 4-компонентные схемы с препаратами висмута.
С целью повышения эффективности стандартной тройной терапии можно использовать следующие меры: назначение удвоенной (по сравнению со стандартной) дозы ИПП, увеличение продолжительности стандартной тройной терапии с 7 до 10–14 дней, добавление к стандартной тройной терапии висмута трикалия дицитрата, добавление к стандартной тройной терапии пробиотика Saсcharomyces boulardii и контроль за соблюдением пациентом режима приема лекарственных препаратов.
Контроль эрадикации следует проводить не ранее чем через 4 нед. после окончания терапии, используя для этого уреазный дыхательный тест (УДТ) или определение антигена в кале [6].
С открытием Н. pylori в 1983 г. австралийскими учеными B.J. Marshall и R. Warren и провозглашением стратегии на тотальную эрадикацию в соответствии с известным постулатом D.Y. Graham («хороший хеликобактер – это мертвый хеликобактер») этот процесс стал лавинообразно нарастать [10]. Однако эффективность эрадикации Н. pylori-инфекции в последние годы снизилась до 80% (а стандартная 3-компонентная схема эрадикации достигает успеха лишь у 70%) [11, 17, 28], в основном за счет увеличения резистентности штаммов Н. pylori к антибиотикам, а также нежелательных лекарственных реакций, которые приводят к низкой комплаентности, ухудшению качества жизни пациентов и самостоятельному прекращению лечения [27, 28].
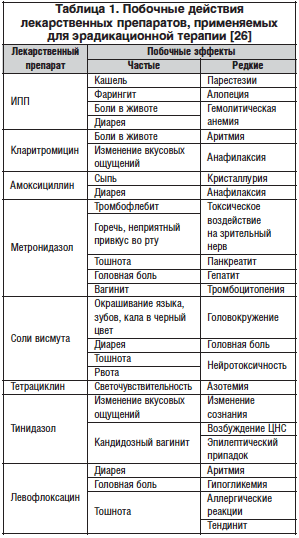
Побочные эффекты лекарственных препаратов, используемых для эрадикации Н. pylori, приведены в таблице 1.
В мире проведено более 30 исследований в период с 1993 по 2009 г., показавших общую устойчивость Н. pylori к амоксициллину, кларитромицину, метронидазолу, тетрациклину, фуразолидону, левофлоксацину. Уровни устойчивости Н. pylori к антибиотикам различны в разных странах. Частично это определяется географическими особенностями. В Европе наблюдается большая разница между южной и северной частями (например, устойчивость к кларитромицину у взрослого населения южно-европейских стран более 35%, что на 20% выше по сравнению с северными европейскими странами). В США устойчивость Н. pylori к кларитромицину составила 10–15%, к метронидазолу – 20–40%, а к амоксициллину отмечалась редко. В Китае за период с 2000 по 2009 г. уровень устойчивости Н. pylori к метронидазолу вырос с 12,8 до 56,6%, к кларитромицину – с 12,8 до 23,8%, тогда как к амоксициллину снизился с 2,1 до 0,3%. В Японии уровень устойчивости Н. pylori к кларитромицину возрос с 7 до 15,2%, к метронидазолу – до 69%, а к амоксициллину приблизился к 0%.
Главный механизм устойчивости Н. pylori – это точечные мутации бактериальной хромосомы, вследствие чего значительно изменяется фенотип бактерии. Другой предполагаемый механизм – снижение проницаемости бактериальной клетки к антибиотику. Нужно отметить, что Н. pylori заселяет труднодоступные для терапии участки СО. Первое препятствие для биодоступности антибиотика – кислота полости желудка (например, кларитромицин распадается под действием кислого желудочного содержимого и пепсина; повышение интрагастрального рН при помощи ИПП способствует положительному влиянию на эрадикацию Н. pylori). Второй барьер, который должен преодолеть антибиотик, – пристеночная слизь. Кроме того, антибактериальный препарат должен достичь высокой концентрации на достаточное время для уничтожения бактерии, где бы она ни находилась. Перспективна попытка преодолеть устойчивость Н. pylori к антибиотикам путем выявления генетических механизмов устойчивости Н. pylori [25].
Антибиотико-ассоциированная диарея (ААД) является одним из наиболее частых осложнений эрадикационной терапии, наблюдается у 5–39% пациентов в зависимости от популяции, типа антибиотика. Повышен риск развития ААД у пациентов старше 65 лет, при применении антибиотиков широкого спектра действия, у находящихся в условиях стационара [29]. Под термином «антибиотико-ассоциированная диарея» понимают необъяснимую другими причинами диарею, развившуюся в связи с приемом антибиотиков (во время их приема или в первые 2 мес., чаще в течение 2–3 нед. после окончания приема). Спектр клинических проявлений ААД широк: от легкой диареи до псевдомембранозного колита. Антибактериальные препараты способны разрушать нормальные колонии кишечной микрофлоры, изменять карбогидратный метаболизм и антимикробную активность кишки, приводя к осмотической диарее и к диарее, вызванной патогенными бактериями. Наибольший риск развития ААД наблюдается на фоне приема амоксициллина с клавулановой кислотой и цефиксима. Ампициллин, амоксициллин, клиндамицин, линкомицин, цефалоспорины II и III поколений – препараты, при приеме которых наиболее часто наблюдается ААД, ассоциированная с Clostridium difficile.
Рост устойчивости Н. pylori к антибактериальным препаратам, увеличивающиеся сроки и побочные эффекты эрадикационной терапии свидетельствуют о необходимости разработки альтернативного метода лечения и способов профилактики [3, 12]. Ряд исследований показали, что пробиотики могут использоваться и усиливать эффект эрадикационной терапии, а также повысить комплаентность пациента. Предполагались следующие эффекты пробиотиков: улучшение переносимости антибактериальной терапии и уменьшение ее побочных эффектов, повышение уровня завершенности терапии, иммуномодулирующий, антибактериальный эффекты. Указывались возможные эффекты лактобацилл: усиление защитного барьера, снижение адгезии и ингибирование роста Н. pylori за счет выработки лактата, бактериоцинов; некоторые штаммы способны ингибировать уреазу Н. pylori [20, 28].
При проведении эрадикационной терапии Н. pylori с профилактической целью и в случае появления диареи назначают пробиотики. Точный механизм антидиарейного действия пробиотиков не установлен. Данные метаанализов исследований эффективности пробиотиков, проведенных в 2010–2011 гг., показали, что применение этой группы препаратов значительно ускоряет выздоровление пациентов при лечении диареи различного генеза, в т. ч. ААД [8, 29, 30].
В схемах эрадикации вместе с антибиотиками могут применяться пробиотики как средства адъювантной терапии, что отражено в Маастрихтском соглашении [6]. При условии кислотоустойчивости штамма (доказано для Saсcharomyces boulardii, Lactobacillus ramnosus GG, L. reuteri, Lactobacillus acidophilus) пробиотики могут оказывать прямое антагонистическое действие в отношении Н. pylori, конкурировать с ним за питательные вещества и рецепторы адгезии, вырабатывать метаболиты, подавляющие рост Н. pylori (летучие жирные кислоты, молочную кислоту, перекись водорода, пироглутамат). Многие штаммы пробиотических культур вырабатывают антибактериальные субстанции, ингибирующие рост других микроорганизмов; Lactobacilli и Bifidobacteria выделяют бактериоцины, которые способны ингибировать рост Н. pylori и уменьшить его адгезию к эпителиоцитам желудка. Кроме того, пробиотики играют важную роль в стабилизации барьерной функции желудка и уменьшают воспаление его СО [20].
Группа немецких исследователей выбрала штамм L. reuteri путем скрининга сотен штаммов Lactobacilli большой коллекции культур. Этот специфический штамм принадлежит к группе Lactobacillus fermentum. L. reuteri специфически коагрегирует с Н. pylori in vitro и в искусственном желудочном соке и не оказывает негативного влияния на другие бактерии симбиотической кишечной флоры. Специфические связи закрывают поверхностные структуры Н. pylori и уменьшают его подвижность, в результате чего связанный патоген не может присоединиться к СО желудка и выводится из него [3].
L. reuteri были обнаружены как в грудном молоке человека, так и в микрофлоре желудочно-кишечного тракта. Было доказано, что штаммы L. reuteri благоприятно влияют на здоровье, в т. ч. при коликах у младенцев, желудочных расстройствах у детей и пищевой непереносимости у недоношенных детей [16].
Микробиологи из Organobalance GmbH (Германия) создали оригинальный штамм L. reuteri DSMZ17648, а затем было начато его производство в концерне Lonza Group Ltd. (Швейцария) под названием Pylopass™. Данный штамм бактерий, имеющий статус GRAS (Generally Recognized AsSafe – абсолютно безопасный), одобрен Управлением по надзору за качеством пищевых продуктов и лекарственных средств США (FDA – Foodand Drug Administration). Технология производства этого штамма принципиально отличается от производства других пробиотиков – вместо лиофильной сушки используется сушка путем распыления лактобацилл, затем они подвергаются ферментации и инактивации, после которых выдерживают изменения условий окружающей среды, в т. ч. низкие рН, и остаются высокостабильными при хранении. Данный кислотоустойчивый штамм специально «обучен» распознавать поверхностные рецепторы Н. pylori и прикрепляться к ним, создавая так называемые ко-агрегаты, которые затем естественным путем выводятся из организма. Pylopass™ коагрегирует с Н. pylori, позволяя уменьшить общую бактериальную обсемененность желудка, что снижает риск развития гастрита, язвы желудка и двенадцатиперстной кишки. Pylopass™ связывается исключительно с Н. pylori и не влияет на другую микрофлору пищеварительного тракта [9].
H. Mehling et al. провели пилотное слепое плацебо-контролируемое исследование с участием 22 H. рylori-позитивных пациентов, у которых не было гастроинтестинальных симптомов, но они имели положительный результат С13 УДТ выше порога 12‰, что указывало на умеренно высокую колонизацию Н. pylori. Уровень обсеменения Н. pylori в динамике определялся с помощью С13 УДТ после 14 дней приема препарата, а также через 6, 12 и 24 нед. после окончания приема препарата. Всем пациентам назначалась L. reuteri DSMZ17648 Pylopass™ в суточной дозе 2х1010 КОЕ, контрольную группу составили Н. pylori-позитивные волонтеры, которые получали плацебо. В опытной группе наблюдалось значительное снижение концентрации Н. pylori в динамике (р<0,05). У пациентов не было отмечено нежелательных лекарственных эффектов в течение 14 дней приема плацебо или L. reuteri DSMZ17648 Pylopass™. Результаты исследования подтвердили потенциал Pylopass™ в качестве нового способа снижения нагрузки Н. pylori [9, 22].
В 2014 г. C. Holz et al. опубликовали результаты углубленного пилотного плацебо-контролируемого исследования применения L. reuteri DSMZ17648 Pylopass™ у лиц, инфицированных Н. pylori и не имевших симптомов заболевания. Исследование 364 пациентов (из них 47 пар близнецов) показало существенное снижение уровня колонизации Н. pylori (подтвержденное С13 УДТ) после приема в течение 14 дней пищевой добавки с L. reuteri DSMZ 17648 (в ежедневной дозе 1 капсула – 2х1010 нежизнеспособных лиофилизированных клеток) [3]. С повышением уровня колонизации эффект уменьшения количества Н. pylori, вызванный приемом L. reuteri DSMZ17648 Pylopass™, оказывался сильнее. Этот эффект уменьшения количества Н. pylori продолжался и по окончании лечения. Потенциальный эффект плацебо был значительно ниже, чем действие L. reuteri DSMZ17648 Pylopass™. В ходе исследования не было зарегистрировано каких-либо изменений качества жизни, например, физической деятельности, питания или здоровья, о которых обследуемые сообщали в анкете. Никаких нежелательных лекарственных реакций не было отмечено ни в одной группе исследования [18].
Противомикробное действие объяснялось не только прямым воздействием на Н. pylori, но и снижением его уреазной активности. Авторы предположили, что уничтожение или замедление роста количественных показателей инфицирования может использоваться в качестве средства профилактики, в т. ч. долговременной (т. к. снижение уровня обсемененности Н. pylori наблюдалось еще 4–6 нед. после лечения) [3]. Это исследование подтвердило, что даже лиофилизированные клетки L. reuteri обладают выраженной антихеликобактерной активностью, что существенно облегчает условия хранения и делает данный вид пробиотика чрезвычайно перспективным. У лиц, инфицированных Н. pylori, без абсолютных показаний к эрадикации (т. е. при отсутствии пептической язвы, рака и МАLТ-лимфомы желудка) назначение L. reuteri DSMZ17648 представляется обоснованным и эффективным [2].
В конце 2014 г. в России появился продукт L. reuteri DSMZ17648 Pylopass™ под названием ХЕЛИНОРМ® в капсулах по 200 мг. Один грамм этого средства содержит около 1 трлн специально обработанных микробных клеток. Продолжительность курса терапии продуктом ХЕЛИНОРМ® составляет 4 нед. В день достаточно принимать всего 1 капсулу, которую рекомендуется проглатывать, не вскрывая, во время еды, запивая небольшим количеством воды. Благодаря высокой безопасности ХЕЛИНОРМ® может назначаться детям старше 6 лет. ХЕЛИНОРМ® можно назначать в виде монотерапии или в комплексной схеме антихеликобактерного лечения для повышения его эффективности.
Пробиотики, как правило, считаются безопасными агентами для применения, а ряд штаммов уже получили признание для использования в клинической практике. Введение безопасных пробиотиков в качестве адъюванта антихеликобактерной терапии представляется весьма перспективным. Дальнейшие исследования механизмов прямых и косвенных эффектов влияния пробиотиков на Н. pylori могут помочь не только оптимизировать лечение, но и способствовать новому пониманию некоторых аспектов патогенеза «взаимоотношений» Н. pylori с человеком. Новый продукт ХЕЛИНОРМ® используется для альтернативного лечения, не увеличивает резистентность Н. pylori к антибиотикам и снижает уровень колонизации этим бактериальным агентом [9].
www.rmj.ru
Эрадикация Helicobacter Pylori
Эти бактерии привыкли жить в кислой среде желудка. Они могут изменять среду вокруг себя и снижать кислотность, что позволяет им выжить. Форма H. pylori позволяет им проникать через слизистый слой желудка, что защищает их от кислоты и иммунных клеток организма.
До восьмидесятых годов ХХ века, когда была обнаружена Хеликобактер Пилори, основными причинами язв считались острая пища, кислота, стресс и образ жизни. Большей части пациентов назначали длительный прием препаратов, снижающих кислотность в желудке. Эти лекарственные средства облегчали симптомы, способствовали заживлению язв, но они не лечили инфекцию. Когда прекращался прием этих препаратов, большинство язв развивались повторно. Теперь врачи знают, что большинство язв вызваны этой бактерией, а правильное лечение может успешно устранить инфекцию почти у всех пациентов и минимизировать риск развития рецидивов.
Как выявляют H. pylori?
Существуют точные и простые тесты для выявления этих бактерий. Они включают анализ крови на антитела к H. pylori, дыхательный тест, анализ кала на наличие антигенов и эндоскопическую биопсию.
Выявление антител к H. pylori в крови может быть проведено быстро и легко. Однако эти антитела могут присутствовать в крови и через много лет после полного устранения бактерий с помощью антибиотиков. Поэтому анализ крови может быть полезным для диагностики инфекции, но он не подходит для оценки эффективности проведенного лечения.
Дыхательный тест с мочевиной – это безопасный, легкий и точный метод выявления H. pylori в желудке. Он основывается на способности этой бактерии расщеплять вещество под названием «мочевина» на углекислый газ, который абсорбируется в желудке и выводится из организма с дыханием.
После перорального приема капсулы с мочевиной, которая помечена радиоактивным углеродом, собирается образец выдыхаемого воздуха. Эту пробу проверяют на наличие помеченного углерода в составе углекислого газа. Его присутствие указывает на активную инфекцию. Анализ становится отрицательным очень быстро после эрадикации H. pylori. Кроме радиоактивного углерода может использоваться нерадиоактивный тяжелый углерод.
Эндоскопия позволяет взять небольшой кусочек слизистой оболочки желудка для проведения дальнейших анализов.
Что такое эрадикация Helicobacter pylori?
Эрадикация Helicobacter pylori – это устранение этих бактерий из желудка с помощью лечения комбинацией антибиотиков с препаратами, подавляющими выработку кислоты и защищающими слизистую желудка. Врач может назначить пациенту сочетание следующих препаратов:
- Антибиотиков (Амоксициллина, Кларитромицина, Метронидазола, Тетрациклина, Тинидазола, Левофлоксацина). Как правило, назначается два препарата из этой группы.
- Ингибиторы протонной помпы (ИПП – Эзомепразол, Пантопразол, Рабепразол), которые снижают выработку кислоты в желудке.
- Препараты висмута, которые помогают убить H. Pylori.
Эрадикационная терапия может состоять из приема очень большого количества таблеток каждый день в течение 10 – 14 дней. Хотя для пациента это очень трудно, важно точно следовать рекомендациям врача. Если больной не будет принимать правильно антибиотики, бактерии в его организме могут стать устойчивыми к ним, что очень осложнит лечение. Через месяц после прохождения курса терапии врач может рекомендовать проведение дыхательного теста, чтобы оценить эффективность лечения.
Существует несколько режимов лечения H. pylori. Выбор схемы лечения основывается на распространенности устойчивых к антибиотику штаммов в регионе проживания человека.
Первая линия лечения:
- Семидневный курс ИПП с Амоксициллином и Кларитромицином или Метронидазолом.
- У пациентов с аллергией на пенициллин используется схема, состоящая из ИПП, Кларитромицина и Метронидазола.
Вторая линия лечения:
- Пациентам, у которых первая линия лечения оказалась неэффективной, назначают ИПП, Амоксициллин и Кларитромицин или Метронидазол (выбирают препарат, который не использовался в терапии первой линии).
- Возможно включение в схему лечения Левофлоксацина или Тетрациклина.
Неэффективность лечения чаще всего связана с плохим соблюдением пациентом рекомендаций врача, а также с устойчивостью H. pylori к антибиотикам. Преимущества проведения эрадикации Хеликобактер Пилори:
- улучшает показатели выздоровления при язвах двенадцатиперстной кишки и желудка, уменьшает количество их повторных развитий;
- снижает частоту кровотечений из дуоденальных язв;
- полезна пациентам с диспепсией, связанной с H. pylori.
- проводится пациентам с лимфомой желудка, у которых обнаружили H. pylori.
mojkishechnik.ru
Эрадикация хеликобактер пилори. Схемы лечения
Врач напугал фразой «эрадикация хеликобактера». Фантазия рисует белые стены операционной, стерильный инструмент и людей в масках. У меня ведь всего лишь гастрит! Или язва!
Что ожидает страдальца? Есть ли смысл опасаться слова «эрадикация» и готовится к оперативному вмешательству?
Немного о хеликобатере пилори и понятие «эрадикация»

Хеликобактер пилори — микроорганизм, который вызывает эрозийные процессы в слизистых оболочках ЖКТ.
Хеликобактер пилори – это патоген, который способен жить и размножаться в условиях агрессивного содержимого желудка человека.
Этот микроорганизм вызывает эрозийные процессы в слизистых оболочках ЖКТ. Методы определения хеликобактера в организме:
- Осмотр и опрос пациента
- Гастроскопии желудка с забором содержимого на анализ
- Анализы крови
- Иммунологические тесты
- Дыхательный тест
- ПЦР-анализы
- Бакпосевы содержимого желудка
- После подтверждения наличия патогена, врач должен принять меры по удалению патогенного микроорганизма.
Эрадикация – медицинский термин, обозначающий комплекс мероприятий, направленных на уничтожение инфекции и создания благоприятных условий для восстановления организма. Попросту говоря – это качественное лечение хеликобактерной инфекции.
Впервые методику «эрадикации» испытал на себе Берри Маршал. Ученый спровоцировал у себя воспалительный процесс в желудке, выпив выделенную культуру хеликобактер пилори. Для лечения Б. Маршал использовал сочетания метронидазола и субцитрата висмута.
Требования к эрадикации рекомендованные ВОЗ
Схемы лечения хеликобактерной инфекции разрабатывались и внедрялись в медицинскую практику в течение 30 лет.
В настоящее время используются рекомендации Маастрихт-IV от 2005 года. Критериями эффективности схемы лечения хеликобактера являются:
- Положительный результат у 80% пациентов
- Длительность активной терапии не более 14 дней
- Использование нетоксичных лекарственных препаратов
- Возникновение побочных эффектов не более чем 10–15% пациентов
- Интенсивность побочек не должна быть таковой, чтобы прекращать лечение
- Низкая резистентность хеликобактера к лекарственному препарату
- Простота использования медикаментов
- Низкая частота приема лекарственных средств. Использование препаратов пролонгированного действия
- Взаимозаменяемость медикаментозных средств в различных схемах лечения
Экономичность лечения

В методике лечения хеликобактера разработано 2 линии эрадикации.
По методике «Маастрихт-IV» разработаны 2 линии эрадикации хеликобактера. Согласно рекомендациям врачей начинают лечение по схемам первой линии.
Если же улучшение не наступает, то пациентам назначают препараты из второй линии эрадикации.
При кровотечении из язвы мероприятия «эрадикации» начинают применять после восстановления питания через рот. Контроль лечения проводится через месяц после окончания курса «эрадикации» хеликобактера.
Первая линия «эрадикации»
Эта схема называется еще «трехкомпонентной линией», так как во время лечения назначают 3 основных лекарственных препарата. Схема №1:
- Ингибиторы протонной помпы – омепразол, омез, рабепрозол и аналоги – для снижения секреции соляной кислоты. Длительность приема составляет 7 дней.
- Антибиотик кларитромицин – 7 дней.
- Антибактериальное средство по выбору врача – метронидазол, трихопол, тинидазол, амоксициллин, нифурател – 7 дней.
Длительность приема может быть увеличена от 10 дней до 2 недель в зависимости от состояния пациента, отклика организма на лечение и переносимости лекарственных препаратов.
Схема №2 применяется при подтвержденной атрофии слизистых оболочек ЖКТ. Ингибиторы протонной помпы или другие препараты, снижающие секрецию соляной кислоты, не назначаются:
- Амоксициллин
- Кларитромицин или нифурател
- Дицитрат висмута
Длительность лечение по схеме №2 составляет от 10 до 14 дней в зависимости от состояния пациента. Схема №3 предназначена для пациентов пожилого возраста. Для этой методики разработаны 2 вариации – 3а и 3б:
- Амоксициллин
- Кларитромици
- Препараты висмута
Лечение по схеме 3а проводится в течение 14 дней. Для схемы 3б требуется более длительный курс – 4 недели. Чтобы избежать привыкания патогена к лекарственному препарату используют «последовательную терапию». Она заключается в том, чтобы разнести прием медикаментозных средств во времени:
Вторая линия «эрадикации»

Тетрациклин — антибиотик используемый при второй линии эрадикации.
Схемы эрадикации второй линии используют при отсутствии эффекта от препаратов первой линии терапии. Для избавления от хеликобактера используют 4 лекарственных вещества. Схема №1:
- Ингибиторы протонной помпы или блокаторы допаминовых рецепторов
- Антибиотик «тетрациклин»
- Метронидазол или трихопол
- Препараты висмут
Схема №2:
- Ингибиторы протонной помпы
- Амоксициллин
- Препараты висмута
- Нитрофураны – нифурател или фуразолидон
Схема №3:
- Ингибиторы протонной помпы
- Амоксициллин
- Препараты висмута
- Рифаксимин – антибиотик широкого спектра действия
Все схемы «второй линии» рассчитаны на лечение в течение 10–14 дней. Если же терапия не дала положительного результата, то разрабатываются схемы «третьей линии».
Для выбора медикаментов проводятся бактериологические исследование, определяется чувствительность хеликобактера к различных антибиотикам и противовоспалительным препаратам.
Все схемы лечения дополняются антигистаминными препаратами, витаминными комплексами, седативными средствами в таблетированной или инъекционной форме.
О лечении хеликобактер пилори узнаете также и из видеоматериала:
https://www.youtube.com/watch?v=_mK79mDc7Q4
Эрадикация хеликобактера прополисом

Водный раствор прополиса отлично помогает в борьбе с хеликобактер пилори.
Эта методика запатентована в 2006 году. Авторами является группа российских ученых.
В настоящее время терапия прополисом не внесена в официальные схемы эрадикации. Исследователи настаивают на ее эффективности. Схема выглядит следующим образом:
- Водный раствор прополиса с массовой долей действующего вещества 25–30% перорально 3 раза в день до еды
- Прополис в масле – 2 раза в день
- Препарат «омепразол» в стандартной дозировке
- Длительность курса лечения колеблется от 2 до 4 недель.
Эрадикация хеликобактера народными средствами

Отвар семени льна — народное средство в лечении хеликобактера.
Препараты фитотерапии широко применяются при лечении хеликобактерной инфекции. Многие из них входят в курсы традиционной медицины и назначаются врачом. Что можно использовать во время лечения:
- Отвар семени льна – готовится по классической технологии – на 1 чайную ложку сырья 250 мл кипятка. Залить и оставить на 2 часа. Принимать слизистый настой вместе с набухшим семенем. Лен оказывает обволакивающее действие на внутреннюю оболочку желудка, препятствует раздражению участков эрозии соляной кислотой, способствует их заживлению.
- Отвар ромашки и тысячелистника, масло облепихи – они оказывают противовоспалительное и ранозаживляющее действие.
- Не применять агрессивные продукты питания и соки. Чеснок и лук, хотя и являются мощными антисептическими продуктами, при эрозийных процессах в ЖКТ запрещены.
Не назначайте себе препараты фитотерапии, другие рецепты народной медицины без консультации с лечащим врачом.
Самостоятельность во время «эрадикации» хеликобактера может окончиться прободением участка желудка или двенадцатиперстной кишки.
Питание при лечении хеликобактерной инфекции

Правильное питание является залогом успешного лечения язвы.
Правильное питание является залогом успешного лечения язвы и прочих заболеванием ЖКТ. Специализированный рацион требуется только при случаях прободения язвы или кровотечения из желудка.
В прочих случаях достаточно придерживаться принципов здорового питания. Блюда должны быть щадящей температуры. Не допускаются горячие и излишне холодные продукты питания. Придется отказаться от:
- Алкоголь
- Табак
- Жареные блюда
- Сырые овощи и фрукты в момент обострения
- Жирные бульоны и блюда на их основе
- Жирная рыба
- Копчености, в том числе колбасы и копченые сыры
- Консервация, в том числе и домашняя овощная
- Острые приправы – уксус
- Специи – перец, смеси с карри
- Грибы
- Крепкий кофе и чай
- Торты, сдоба, прочие сладости
Что должно быть на столе:
- Нежирные супы
- Хлеб только белый, лучше – сухарики домашнего приготовления
- Мясо, речная рыба
- Любые макаронные изделия без острых и жирных соусов
- Каши на воде и молоке
- Овощи – картофель, свекла, морковь, лук и чеснок только в проготовленном виде
- Ягоды и фрукты – желательно в проготовленном виде
- Фруктовые и молочные кисели
- Некрепкий чай
- Профилактические мероприятия
Инфекции проще избежать, чем лечить. Приемы профилактики следует соблюдать до знакомства с патогеном. Но и после лечения хеликобактера придется следить за собой во избежание повторения инфицирования. Что можно делать самостоятельно:
- Снизить физические контакты с незнакомыми лицами
- Забыть о вредных привычках. Алкоголь и сигареты отныне для вас под запретом
- Зубная щетка и помада – ваши и только ваши. Не давайте пользоваться этими вещами другим лицам
- Мойте руки, продукты питания перед едой
- Проходите профилактические осмотры у гастроэнтеролога после лечения
- Не занимайтесь самолечением и при первых признаках заболевания обращайтесь к врачу
Система ЖКТ – это нежная группа органов, а инфекции вездесущи. К тому же многие из них выработали иммунитет ко многим лекарственным препаратам. Заботьтесь о себе, думайте о том, что отправляете в собственный рот, и вам не придется знакомиться с термином «эрадикация» и принимать лекарственные препараты для подавления хеликобактера пилори.
Заметили ошибку? Выделите ее и нажмите Ctrl+Enter, чтобы сообщить нам.
Расскажите друзьям! Расскажите об этой статье своим друзьям в любимой социальной сети с помощью социальных кнопок. Спасибо!
Поделиться
Поделиться
Твит
Телеграм
Класс
Вотсап
pishhevarenie.com
A02BD. Комбинации для эрадикации Helicobacter pylori

96 Н. И. Яблучанский, В. Н. Савченко
Историческая справка
Открытие в 1982 г. австралийскими учеными Р. Уорреном и Б. Маршалом Hеlicobacter pylori (Нр) ознаменовало начало нового этапа в подходах к лечению ряда гастроэнтерологических заболеваний. Признание важности инфекционного агента в патогенезе язвенной болезни (ЯБ) и хронического гастрита привело к тому, что ключевым моментом схем противоязвенной терапии стали считать антибактериальные препараты, направленные на эрадикацию Нр. На смену сформулированному еще в начале ХХ века постулата «Нет кислоты – нет язвы» приходят новые парадигмы: «Нет Нр – нет ЯБ», «Хороший Нр – только мертвый Нр».
АТС классификация
A:ПРЕПАРАТЫ, ВЛИЯЮЩИЕ НА ПИЩЕВАРИТЕЛЬНЫЙ ТРАКТ И ОБМЕН ВЕЩЕСТВ
A02 Препараты для лечения кислотозависимых заболеваний
A02B Средства для лечения пептической язвы и гастроэзофагеальной рефлюксной болезни
A02BD Комбинации для эрадикации Hеlicobacter pylori
A02BD01 Омепразол, амоксициллин и метронидазол
A02BD02 Лансопразол, тетрациклин и метронидазол
A02BD03 Лансопразол, амоксициллин и метронидазол
A02BD04 Пантопразол в комбинации с амоксициллином и кларитромицином A02BD05 Омепразол, амоксициллин и кларитромицин
A02BD06 Эзомепразол, амоксициллин и кларитромицин
На сегодняшний день антихеликобактерная терапия считается стандартом лечения ассоциированных с Нр заболеваний: атрофического гастрита, ЯБ желудка и двенадцатиперстной кишки, MALT-лимфомы желудка, а также после хирургического вмешательства по поводу рака желудка и у близких родственников больных раком желудка. Это отражено в международных Европейских клинических рекомендациях – Маастрихтских соглашениях I (1996 г.), II (2000 г.) и III (2005 г.). Согласно этим документам разработаны следующие схемы эрадикационной терапии.
Антихеликобактерную терапию обычно начинают с тройной схемы (терапии
первой линии):
1) ИПП в стандартной дозе (омепразол, рабепразол и эзомепразол по 20 мг, лансопразол по 30 мг, пантопразол по 40 мг) 2 раза в сутки (утром и вечером до еды)
+
2) Кларитромицин (К) по 500 мг 2 раза в сутки во время еды
+
3) Амоксициллин (А) по 1000 мг 2 раза в сутки

Частная терапевтическая фармакология 97
или
Метронидазол (М) по 500 мг 2 раза в сутки.
Комбинация К + А считается предпочтительной перед К + М, поскольку она, вопервых, может способствовать достижению лучших результатов лечения в случае назначения терапии второй линии, и во-вторых, в нашей популяции резистентность Нр к метронидазолу составляет около 55 %, что делает его использование в составе тройной схемы эрадикационной терапии первой линии нецелесообразным.
В случае отсутствия успеха лечения (отсутствие эрадикации Нр через 4–6 недель после полной отмены антибиотиков и антисекреторных препаратов) назначают
резервную четырѐхкомпонентную схему (квадратерапия или терапия второй линии):
1) ИПП в стандартной дозе
+
2) Висмута субцитрат по 120 мг 4 раза в сутки
или
по 240 мг 2 раза в сутки
+
3) Метронидазол по 500 мг 3 раза в сутки
+
4) Тетрациклин по 500 мг 4 раза в сутки.
Если по каким-либо причинам препарат висмута не может быть назначен в составе четырѐхкомпонентной терапии, то может использоваться схема тройной терапии, включающей ИПП в стандартной дозе, амоксициллин (по 1000 мг 2 раза в сутки) в комбинации с тетрациклином (по 500 мг 4 раза в сутки ) или фуразолидоном (200 мг 2 раза в сутки).
Согласно рекомендациям I и II Маастрихтских соглашений длительность терапии первой и второй линии должна проводится в течение 7 дней. Согласно новому консенсусу (Маастрихт III) длительность терапии рекомендуется увеличить до 14 дней, что повышает эффективность эрадикации Нр на 12 %.
В случае, если эрадикация Нр не была достигнута после двух курсов лечения (первой линии и резервными средствами) рекомендуется использовать следующие
схемы третьей линии («терапии спасения»):
1)ИПП + Амоксициллин в высоких дозах (3 г/сут) в течение 10–14 дней;
2)ИПП + Амоксициллин + Левофлоксацин (500 мг/сут) или Рифабутин (300 мг/сут)
в течение 7–10 дней;
3)ИПП + Амоксициллин + Висмута трикалия дицитрат + Тетрациклин + Фуразо-
лидон (400 мг/сут) в течение 7 дней.
Наиболее изученной и перспективной является схема с включением левофлоксацина, которая легче переносится, чем четырехкомпонентная терапия и приводит к успешной эрадикации Нр в 81–87 %. При этом десятидневный режим лечения имеет преимущества перед семидневным, а доза левофлоксацина в 500 мг также эффективна, как и 1000 мг.

98 Н. И. Яблучанский, В. Н. Савченко
Линия терапии с включением фуразолидона менее изучена. Эрадикация Нр при ее использовании, по разным данным, составляет от 52 до 90 %.
Схема с рифабутином эффективна у 74–91 % пациентов. Рифабутин имеет серьезные побочные эффекты. Кроме того, рифабутин используется в терапии туберкулеза, что делает его применение в нашей стране нецелесообразным.
Методы лечения, изложенные в Маастрихтских консенсусах, исходят из стратегии тотальной эрадикации Нр: «выявлять (Нр) и лечить (эрадикация)» – «test-and-treat strategy». Важнейшей проблемой, возникшей во время практической реализации Маастрихтских соглашений по тотальной эрадикации Нр, стала вторичная резистентность Нр, растущая с каждым годом, что влечет существенное снижение эффективности эрадикационной терапии. Расширение спектра антибактериальных средств ведет к росту числа побочных явлений до 35–40 % (в т. ч. дисбиоза, антибиотик-ассо- циированной диареи). Есть данные о том, что эрадикация Нр при Нр-негативной ЯБ приводит к образованию послеязвенного рубца низкого качества и, как следствие, продлению срока заживления язв, а также более частому рецидивированию и ухудшению течения ЯБ. Поэтому эрадикацию Нр следует проводить по строгим показаниям, после определения чувствительности штаммов Нр к антибиотикам.
studfile.net
РЕКОМЕНДАЦИИ ПО ЛЕЧЕНИЮ ИНФЕКЦИИ HELICOBACTER PYLORI | Лапина Т.Л.
В статье подробно обсуждается вопрос эрадикации H. pylori. На основе собственного материала и международного соглашения по лечению инфекции H. pylori даются конкретные рекомендации для практических врачей. Подчеркивается необходимость единого подхода к диагностике и терапии H. pylori.
The paper discusses H.pylori eradication more specifically. Based on her own findings and the International Consensus Committee’s recommendations for treating H.pylori infection, the author provides guidelines for the practitioners. The paper underlines the need for applying a uniform approach to the diagnosis and treatment of H.pylori infection.
Т.Л. Лапина – ассистент курса “Функциональная диагностика и фармакотерапия в гастроэнтерологии”, кафедры семейной медицины факультета послевузовского профессионального образования
ММА им. И.М. Сеченова
T.L.Lapina, Assistant, Course “Functional Diagnosis and Pharmacotherapy in Gastroenterology”, Department of Family Medicine, Faculty of Postgraduate Training I.M. Sechenov Moscow Medical Academy
С 1983 г., когда впервые был выделен в культуре новый вид микрооганизма – Helicobacter pylori (H. pylori), многочисленными исследованиями доказано его патогенетическое значение (табл. 1). Изучение H. pylori ведется с использованием современнейших научных методов и продвигается вперед огромными шагами. Такое «стремительное» накопление теоретических знаний в данной области, к сожалению, ведет к некоторому отставанию популяризации этой информации среди практических врачей. В итоге это оборачивается ошибками в диагностике, а главное, в выборе лечения инфекции H. pylori. К сожалению, большинство литературных источников, в которых методически правильно описывается практика эрадикационной терапии, т.е. терапии, направленной на уничтожение H. pylori, англоязычны, на русском языке опубликованы пока единичные работы.
Пожалуй, первый документ, направленный на то, чтобы «сделать легитимной» и унифицировать терапию инфекции H. pylori, был принят в феврале 1994 г. специальной конференцией Национального института здоровья США [1]. На конференции был достигнут консенсус по проблеме «Helicobacter pylori и язвенная болезнь»: больных язвенной болезнью с инфекцией H. pylori необходимо лечить антимикробными средствами и при обострении заболевания, и в период ремиссии, причем были рекомендованы определенные схемы терапии.
Однако уже через 2 года эти рекомендации устарели, так как появились данные о более эффективных комбинациях лекарственных препаратов для эрадикации H. pylori. В нескольких странах Европы независимо друг от друга были разработаны аналогичные документы, но необходимость единого подхода к диагностике и терапии H. pylori, основанного на опыте лучших европейских исследователей, привела к созыву в городе Маастрихт в феврале 1996 г. специальной конференции. Конференция, организованная Европейской группой по изучению H. pylori, собрала ученых-экспертов в этой области, практикующих врачей и представителей Национальных обществ гастроэнтерологов. После серьезного обсуждения были приняты рекомендации по лечению инфекции H. pylori, отвечающие современным требованиям [2]. «Маастрихтский консенсус» является руководством для практикующих врачей европейских стран и дает ответы на вопросы о H. pylori, которые могут возникнуть в их повседневной деятельности и ведении гастроэнтерологических больных.
Таблица 1. H. pylori и патология человека
|
Патологические состояния |
Связь с инфекцией H. Pylori |
| Хронический гастрит, вызванный инфекцией H. pylori Язвенная болезнь желудка и двенадцатиперстной кишки Рак желудка MALT лимфома |
Установлена |
| Неязвенная диспепсия Болезнь Менетрие Ишемическая болезнь сердца Задержка роста детей |
Вероятна |
| Гастроэзофагоеюнальная рефлюксная болезнь Гастродуоденальные изъязвления, связанные с приемом нестероидных противовоспалительных препаратов |
Спорна |
«Рекомендации по диагностике и лечению инфекции Helicobacter pylori у взрослых при язвенной болезни желудка и двенадцатиперстной кишки», разработанные Российской группой по изучению H. pylori, прошли обсуждение на научной конференции, посвященной 100-летию со дня рождения В.Х. Василенко в апреле 1997 г. и на III Национальной гастроэнтерологической неделе в ноябре 1997 г. Они опубликованы в Российском журнале гастроэнтерологии, гепатологии, колопроктологии [3] и с помощью Российской гастроэнтерологической ассоциации (РГА) распространены по различным регионам России. Рекомендации предельно конкретны и призваны помочь практикующим врачам и организаторам здравоохранения.
Таблица 2. Показания к лечению инфекии H. pylori
|
Показания |
Степень научной очевидности |
|
| Российская
гастроэнтерологическая ассоциация по изучению H. pylori, апрель 1997 г. |
Европейская группа по изучению H. pylori Маастрихт, сентябрь 1996 г. | |
| Язвенная болезнь желудка и двенадцатиперстной кишки в стадии обострения и в стадии ремиссии | Обязательно | |
| язвенная болезнь | безусловная | |
| МАLTома желудка | безусловная | |
| гастрит | вероятная | |
| после операции резекции жедудка по поводу рака | вероятная | |
| Желательно | ||
| функциональная диспепсия | возможная | |
| наследственность, отягощенная раком желудка, | возможная | |
| долгий прием ингибиторов протонной помпы по поводу гастроэзофагоеюнальной рефлюксной болезни | вероятная | |
| терапия нестероидными противовоспали-
тельными средствами |
возможная | |
| после операций по поводу язвенной болезни | вероятная | |
| желание пациента | вероятная | |
| Возможно | ||
| для предотвращения рака желудка | возможная | |
| бессимптомные носители | возможная | |
| экстраалиментарные заболевания(ишемическая болезнь сердца, задержка роста у детей) | возможная | |
Принципиальное значение для практики имеет разделение методики диагностики H. pylori до лечения (первичная диагностика – обнаружение инфекции для обоснования назначения лечения) и после проведения эрадикационной терапии (диагностика эрадикации – контроль успешности антибактериальной схемы). Дело в том, что H. pylori обнаруживаются в 100% случаев при хроническом гастрите, язвенной болезни желудка и двенадцатиперстной кишки. Поэтому для того, чтобы начать антихеликобактерную терапию, достаточно подтвердить наличие бактерии одним из доступных методов (естественно, при соблюдении правил выполнения этих методов и надлежащей стерилизации эндоскопической аппаратуры). Эти методы перечислены в «Рекомендациях»:
1. Бактериологический: посев биоптата слизистой оболочки желудка на дифференциально-диагностическую среду.
2. Морфологические:
– гистологический «золотой стандарт» диагностики H. pylori: окраска бактерии в гистологических препаратах слизистой оболочки желудка по Гимзе, толуидиновым синим, Вартину – Старри, Генте;
– цитологический: окраска бактерии в мазках-отпечатках биоптатов слизистой оболочки желудка по Гимзе, Граму.
3. Дыхательный: определение в выдыхаемом больным воздухе изотопов 14С или 13С, которые выделяются в результате расщепления в желудке больного меченной мочевины под действием уреазы бактерии H. pylori.
4. Уреазный: определение уреазной активности в биоптате слизистой оболочки желудка путем помещения его в жидкую или гелеобразную среду, содержащую субстрат, буфер и индикатор.
Таблица 3. Тройная терапия на основе препаратов висмута
|
Препарат висмута |
Антибактериальные препараты |
|||
| Коллоидный субцитрат висмута или субсалицилат висмута или галлат висмута по 120 мг 4 раза в день(в пересчете на окись вимута) | + | Тетрациклин
по 500 мг 4 раза в день |
+ |
Метронидазол |
|
Продолжительность лечения – 7 дней |
||||
В «Рекомендациях» дано определение понятия «эрадикация» – это полное уничтожение бактерии H. pylori (как вегетативной, так и кокковидной форм) в желудке и двенадцатиперстной кишке человека. Эрадикационная терапия – серьезная задача для врача, и не всегда приводит к успеху. Для ведущих научных центров эрадикация H. pylori в 80% случаев является отличным показателем эффективности терапии.
Таблица 4. Соли висмута угнетают H. pylori in vitro
|
Соль висмута |
MIC90, нг/л |
| Висмута субцитрат |
4 – 32 |
| Висмута субсалицилат |
64 |
| Ранитидин-висмут-цитрат |
16 |
| Висмута субгаллат |
32 |
| Висмута субнитрат |
> 128 |
Применение антибактериальных лекарственных препаратов резко снижает количество H. pylori в гастродуоденальной слизистой оболочке. Поэтому сразу после окончания эрадикационного лечения даже в случае его неудачи H. pylori не обнаруживается. Ложноотрицательные результаты обусловлены тем, что H. pylori может отсутствовать в случайно взятых единичных биоптатах слизистой оболочки или находится там в таких незначительных количествах, которые не воспринимаются диагностическими методами (морфологический, уреазный). С уменьшением количества H. pylori связаны сложности его обнаружения после монотерапии висмут-содержащими препаратами, метронидазолом, любыми антибактериальными препаратами, использованными по другим показаниям (например, аугментин по поводу ангины, фурадонин по поводу цистита и др.).
Таблица 5. Тройная терапия на основе ингибиторов протонной помпы париетальных клеток
| Ингибиторы протонной помпы Антибактериальные препараты | ||
|
Омепразол |
+ |
Кларитромицин по 250 мг 2 раза в день + метронидазол по 400 мг 3 раза в день |
|
Или |
или |
|
|
пантопразол |
амоксициллин по 1000 мг 2 раза в день + кларитромицин 500 мг 2 раза в день |
|
|
Или |
или |
|
|
Лансопразол |
Амоксициллин по 500 мг 3 раза в день + метронидазол по 400 мг 3 разав день |
|
|
Продолжительность лечения – 7 дней |
||
Таблица 6. Квадротерапия
|
Блокаторы протонной помпы |
Препарат висмута |
Антибактериальные препараты |
||
|
Омепразол по 20 мг |
Коллоидный субцитрат висмута |
Тетрациклин по 500 мг 4 раза в день |
||
|
или |
Или |
+ |
||
|
Пантопразол по 40 мг 2 раза в день |
Субсалицилат висмута |
Метронидазол по 250 мг 4 раза в день |
||
|
или |
или |
или |
||
|
Лансопразол |
Галлат висмута по 120 мг 4 раза в день |
Тинидазол |
||
|
Продолжительность лечения – 7 дней |
||||
Важно отметить, что применение любых ингибиторов протонной помпы (омепразола, пантопразола, лансопразола) в силу особенностей адаптации H. pylori к определенным значениям рН приводит к перераспределению H. pylori по слизистой оболочке: бактерии элиминируются из антрального отдела и в большем количестве обнаруживаются в теле желудка. Считается, что мощная антисекреторная терапия приводит и к уменьшению общего количества бактерий H. pylori. Таким образом, если проводить исследование на H. pylori во время или сразу после курса терапии ингибиторами протонной помпы не исключен ложноотрицательный результат, особенно если ограничиться биоптатами из антрального отдела [4]. Известен факт ложноотрицательной диагностики H. pylori после лечения омепразолом и с помощью дыхательного теста, для которого не требуется биопсия.
Таблица 7. Терапия на основе ранитидин-висмут-цитрата
|
Ранитидин-висмут-цитрат |
Ранитидин-висмут-цитрат |
Ранитидин-висмут-цитрат |
|
+ |
+ |
+ |
|
тетрациклин |
кларитромицин |
Кларитромицин |
|
+ |
+ |
|
|
Метронидазол |
метронидазол |
|
|
14 дней |
14 дней |
7 дней |
Таблица 8. Принципы терапии инфекции H. pylori
| • Использование многокомпонентных схем лечения – тройная терапия – квадротерапия • Строгое соблюдение выбранной схемы лечения – определенные лекарственные препараты – определенные дозы – определенная продолжительность терапии • Учет синергизма лекарственных препаратов |
Поэтому контроль успешности проведения антибактериального лечения требует особого подхода. Правила диагностики эрадикации по «Рекомендациям» следующие:
1. Диагностика эрадикации должна осуществляться не ранее 4 – 6 недель после окончания курса антихеликобактерной терапии, либо лечения любыми антибиотиками или антисекреторными средствами сопутствующих заболеваний.
2. Диагностика эрадикации осуществляется, как минимум, двумя из указанных диагностических методов, причем при использовании методов непосредственного обнаружения бактерии в биоптате слизистой оболочки желудка (бактериологический, морфологический, уреазный) необходимо исследование 2 биоптатов из тела желудка и 1 биоптата из антрального отдела.
3. Цитологический метод для установления эрадикации неприменим.
Особое место в диагностике инфекции H. pylori имеют иммуноферментный анализ и экспресс-тесты на основе иммунопреципитации, которые позволяют обнаруживать в сыворотке крови или в капиллярной крови пациентов антитела к H. pylori. Эти методы могут быть использованы в качестве скрининговых или в случае установленной болезни для первичной диагностики инфекции H. pylori. Понятно, что для обнаружения H. pylori после лечения серологические методы неприменимы, так как даже после эрадикации бактерии антихеликобактерные антитела продолжают циркулировать в крови.
«Рекомендации по диагностике и лечению инфекции Helicobacter pylori у взрослых при язвенной болезни желудка и двенадцатиперстной кишки» устанавливают в качестве показания к эрадикационному лечению только язвенную болезнь как в стадии обострения, так и в стадии ремиссии. Значение H. pylori в патологии человека значительно шире, хотя результаты эрадикационной терапии действительно лучше изучены при этом заболевании. Маастрихтские рекомендации охватывают гораздо более широкий круг показаний для антихеликобактерного лечения, причем указывают степень важности проведения такого лечения и его научную обоснованность (табл. 2). Вероятно, по мере накопления новой информации показания к эрадикационной терапии в Российских рекомендациях будут расширены.
Особенности терапии инфекции H. pylori нашли свое отражение в определенных принципах лечения, которые сформулированы в «Рекомендациях» следующим образом:
Основой лечения является использование комбинированной (трехкомпонентной) терапии:
• способной уничтожать бактерию H. pylori, как минимум, в 80% случаев;
• не вызывающей вынужденной отмены терапии врачом, вследствие побочных эффектов (допустимо менее чем в 5% случаев) или прекращения пациентом приема лекарств по схеме, рекомендованной врачом;
• эффективной при продолжительности курса не более 7 – 14 дней.
Действительно, наиболее эффективные схемы эрадикационной терапии являются трехкомпонентными. К сожалению, лечение с помощью двух лекарственных препаратов оказывается недостаточным для того, чтобы уничтожить H. pylori как минимум у 80% пролеченных пациентов. Давно не используется в клинической практике сочетание де-нола с метронидазолом, эрадикация с помощью такой схемы практически недостижима. Исследования 1995 – 1996 гг. показали, что сочетание омепразола с одним антибиотиком дает слишком большой разброс результатов эрадикации H. pylori. Так, двойная терапия омепразолом с амоксициллином результативна, по данным разных авторов, в 29 – 92% случаев. В среднем эффективность двойной терапии оценивается в пределах 50 – 70%. Эрадикация в контролируемых исследованиях наступает менее чем у 80% пролеченных, и двойной режим лечения не может быть рекомендован для практического здравоохранения. Таким образом, эрадикационные схемы стали трехкомпонентными и даже четырехкомпонентными.
Эрадикационная терапия – это терапия антибиотиками, поэтому естественными являются требования к безопасности и хорошей переносимости такого лечения. К сожалению, укороченный курс менее 7 дней, как правило, приводит к неудаче – эрадикация не наступает. Поэтому, если попытка эрадикационной терапии привела к побочным проявлениям, вынудившим прервать курс (например, аллергическая реакция), с уверенностью можно говорить о персистировании инфекции H. pylori.
Рекомендуемые схемы для эрадикации H. pylori приведены в табл. 3, 5, 6, 7.
Схемы лечения на основе препаратов висмута, в первую очередь коллоидного субцитрата висмута, раньше всего стали использовать по поводу инфекции H. pylori. Препараты висмута в сочетании с тетрациклином и метронидазолом называют даже классической тройной терапией. Дело в том, что соли висмута обладают бактерицидными свойствами в отношении Н.pylori: разрушают бактериальную стенку, ингибируют ферменты бактерий (уреазу, каталазу, липазу/фосфолипазу), предотвращают адгезию Н. рylori к эпителиальным клеткам желудка. Для солей висмута определены минимальные концентрации, ингибирующие Н. рylori (MIC) (табл. 4).
В настоящее время оптимальной считается схема тройной терапии с ингибитором протонной помпы (табл. 5). Благодаря своим особенностям ингибиторы протонного насоса являются незаменимыми в антихеликобактерном лечении. В начале 90-х годов рядом авторов было показано, что монотерапия омепразолом приводит к подавлению Н. pylori (при исследовании биоптатов антрального отдела сразу после курса антисекреторной терапии ингибитором протонного насоса бактерию часто не обнаруживали). Как уже было описано, использование омепразола приводит к перераспределению микроорганизма в слизистой оболочке желудка: их число в антральном отделе снижается, причем часто значительно, а в теле желудка возрастает. Механизм такого регулирующего влияния ингибиторов протонного насоса связан с мощным угнетением желудочной секреции. Синтез АТФ Н. pylori осуществляется благодаря наличию электрохимического градиента ионов водорода. Уреаза бактерии, разлагая мочевину с выделением ионов аммония, приводит к защелачиванию микроокружения бактерии, предохраняющего ее от действия соляной кислоты желудочного сока; в этих условиях синтез АТФ продолжается. Но применение ингибиторов протонного насоса приводит к повышению рН, а эффект уреазы – к суммарному повышению рН, до уровня, который несовместим с жизнедеятельностью микроорганизма. Таким образом, Н. pylori является толерантным к кислым значениям рН (благодаря уникальной уреазной активности), но неустойчивым к щелочной реакции среды «нейтрофилом». При использовании ингибиторов протонного насоса бактерии приходится переселяться в отделы желудка с более низкими значениями рН, т. е. в тело желудка из антрального отдела.
Самые мощные из известных на сегодняшний день антисекреторных препаратов – ингибиторы протонной помпы – не только угнетают Н. pylori в антральном отделе, но и стимулируют защитные механизмы макроорганизма в отношении бактерии. Антитела к Н. pylori, секретируемые на поверхность слизистой оболочки желудка, быстро деградируют под влиянием протеолитических ферментов желудочного сока. Сдвиг рН в щелочную сторону при использовании блокаторов Н+, К+-АТФазы заметно снижает протеолитическую активность содержимого желудка и удлиняет период полужизни антител и их концентрацию. Функциональная активность нейтрофилов также зависит от pH и возрастает при его сдвиге в щелочную сторону. Ингибиторы протонного насоса обладают синергизмом с антибактериальными препаратами. Активность многих антибиотиков повышается при сдвиге значений рН из кислой среды в щелочную. Кроме того, уменьшение объема секрета повышает концентрацию антибактериальных препаратов в желудочном соке [4].
Однако антихеликобактерный эффект ингибиторов протонного насоса объясняется не только подавлением секреции. Эти препараты обладают специфической, присущей только этому классу препаратов способностью подавлять H. pylori in vitro и, вероятно, in vivo. Имеются данные, свидетельствующие о том, что они угнетают уреазу бактерии и одну из ее АТФаз. Подавление уреазной активности микроорганизма не так давно показано не только in vitro, но и в клинических экспериментах. Все производные бензимидазола – омепразол, пантопразол, лансопразол – приводят к одинаковому перераспределению бактерии в слизистой оболочке желудка и обладают сходным бактериостатическим эффектом (известны минимальные ингибирующие концентрации каждого из этих препаратов). Таким образом, антихеликобактерный эффект – это свойство ингибиторов протонного насоса как класса лекарственных препаратов.
Квадротерапию следует рассматривать как терапию резерва. Ее эффективность в отношении H. pylori оценивается как максимальная (табл. 6). Комбинацию четырех лекарственных препаратов целесобразно использовать как лечение «второй линии», после неудачи первого эрадикационного курса, или в особых случаях (например, при лечении MALTомы желудка.)
Новая формула – ранитидин-висмут-цитрат – представляет собой соединение, сочетающее лекарственную активность антисекреторного агента и бактерицидные особенности висмута. Эффект этого комбинированного препарата превосходит суммарные возможности сочетания блокатора Н2-рецепторов гистамина и соли висмута, за счет особого синергизма, присущего данной химической структуре. Особые свойства ранитидин-висмут-цитрата позволяют комбинировать его только с одним антибиотиком – кларитромицином, хотя по сути это сочетание уже трехкомпонентно (табл. 7).
Значительно снижает успешность эрадикационной терапии развитие резистентности H. pylori к антибиотикам. Наиболее распространена устойчивость микроорганизма к метронидазолу, хотя описаны штаммы H. pylori, устойчивые к кларитромицину и амоксициллину. Резистентность, как правило, возникает вследствие бесконтрольного неграмотного назначения антибактериального агента. К сожалению, ситуация с метронидазолом в России может быть описана именно таким образом. По данным Л.В. Кудрявцевой, доложенным на III Российской гастроэнтерологической неделе (1997), первичная резистентность H. pylori к метронидазолу обнаруживается в 30% случаев, при повторном курсе метронидазола бактерия устойчива к нему практически в 100% случаев. Самой серьезной и наиболее частой ошибкой в назначении антибактериальных препаратов при язвенной болезни является использование метронидазола не в составе описанных схем, а в качестве дополнительного препарата вместе с блокаторами Н2-рецепторов гистамина, де-нолом или в качестве монотерапии.
Репаративные свойства метронидазола, если они и есть, настолько слабы, что при использовании современных ингибиторов Н2-рецепторов гистамина или протонной помпы, приводящих к заживлению язвы за 2 нед, рассчитывать на них просто бессмысленно. А вот устойчивость H. pylori к метронидазолу в случае его необоснованного применения возникает неизбежно.
Именно в связи с проблемой резистентности в «Рекомендациях» выделены правила применения антихеликобактерной терапии:
1. Если использование схемы лечения не приводит к наступлению эрадикации, повторять ее не следует.
2. Если использованная схема не привела к эрадикации, это означает, что бактерия приобрела устойчивость к одному из компонентов схемы лечения (производным нитроимидазола, макролидам).
3. Если использование одной, а затем другой схемы лечения не приводит к эрадикации, то следует определять чувствительность штамма H. pylori ко всему спектру используемых антибиотиков.
4. Появление бактерии в организме больного спустя год после лечения следует расценивать как рецидив инфекции, а не реинфекцию*. При рецидиве инфекции необходимо применение более эффективной схемы лечения.
Распространенной ошибкой является уменьшение дозы антибактериальных препаратов или продолжительности лечения, произвольная замена компонентов схемы. Даже замена тетрациклина на доксициклин приводит к уменьшению эффективности лечения, замена кларитромицина на эритромицин практически сводит на нет усилия врача по эрадикации инфекции H. pylori. В большинстве случаев неадекватной является замена ингибиторов протонной помпы антагонистами Н2-рецепторов гистамина (табл. 8). К сожалению, встречается даже «поэтапное» назначение компонентов схемы: сначала неделя омепразола с метронидазолом, а затем неделя приема кларитромицина. Итог один – эрадикация не наступает, больной принимает антибиотики без всякого смысла, число резистентных штаммов H. pylori возрастает.
Таким образом, лишь строгое соблюдение отработанных схем терапии (вид лекарственных препаратов, их сочетание, дозы и продолжительность лечения) дает возможность добиться эрадикации H. pylori у большинства пациентов.
Литература:
1. NIH сonsensus development panel on Helicobacter pylori in peptic ulcer disease. JAMA 1994; 272:65–9.
2. Current European concepts in the management of Helicobacter pylori infection. The Maastricht Consensus Report. Gut 1997; 41(1):8–13.
3. Рекомендации по диагностике и лечению инфекции Helicobacter pylori у взрослых при язвенной болезни желудка и двенадцатиперстной кишки. // Российский журнал гастроэнтерологии, гепатологии, колопроктологии, 1998; № 1.
4. Hunt R.H. The role of acid suppression in the treatment of H. pylori infection. In: Helicobacter pylori. Basic mechanisms to clinical cure. Ed. by R.H. Hunt, G.N.J. Tytgat. Kluwer academic publishers. Dordrecht, Boston, London, 1995; 584–93.
www.rmj.ru
Бактерия helicobacter pylori, эрадикация хеликобактер пилори
В последнее время словосочетание «Хеликобактер пилори» у всех на слуху – о данной бактерии слышно в рекламах фармацевтических препаратов, можно прочитать на форумах и т.д. Многие даже знают, что хеликобактер – причина большого количества желудочных проблем. Как именно влияет на наш организм эта бактерия?
Что такое Хеликобактер?
Еще около двух десятков лет тому назад лечение гастритов и язвенной болезни желудка основывалось на эмпирических данных, в большинстве своем оно было симптоматическим.
Настоящим прорывом в медицине стало повторное открытие в 1981 году микроорганизма Helicobacter pylori (HP), находящегося в слизистой желудка пациентов с хроническим антральным гастритом. Английский ученый Барри Маршал и австралийский патолог Робин Уоррен не только выделили хеликобактерии в отдельный от кампилобактера род, но и доказали их медицинское значение, за что в 2005 году получили Нобелевскую премию. Это открытие вошло в первые ряды ведущих медицинских достижений ХХ века, а эрадикация Helicobacter pylori (полное уничтожение бактерии) стала золотым стандартом лечения хеликобактер-ассоциированных патологий ЖКТ.
Доказано, что H. Pylori вызывает гастриты примерно у 30% населения, является причиной более чем 95% всех гастро-дуоденальных язв и в 65% случаев становится триггером развития рака желудка. В данный момент ведутся исследования по поводу роли хеликобактера в развитии неспецифического язвенного колита (болезни Крона), идиопатической хронической крапивницы, заболеваний печени и желчевыводящих путей.
Формы микроорганизма
 Хеликобактериальные заболевания относятся к кампилобактериозам, а сам микроорганизм выделен в отдельный род. Микробиология H. Pylori следующая: это грамотрицательная спиралевидная бактерия, до 3 мкм длиной и 0,5 мкм в диаметре. Она имеет 4–6 жгутиков и может довольно быстро передвигаться в густых питательных средах. Особенностью бактерии является то, что она микроаэрофильна, т.е. для ее нормального развития и существования необходимо небольшое количество кислорода, гораздо меньшее, чем в воздухе. HP вырабатывает окислительные ферменты, способна формировать защитную биопленку, спасающую от антител и агрессивной желудочной среды.
Хеликобактериальные заболевания относятся к кампилобактериозам, а сам микроорганизм выделен в отдельный род. Микробиология H. Pylori следующая: это грамотрицательная спиралевидная бактерия, до 3 мкм длиной и 0,5 мкм в диаметре. Она имеет 4–6 жгутиков и может довольно быстро передвигаться в густых питательных средах. Особенностью бактерии является то, что она микроаэрофильна, т.е. для ее нормального развития и существования необходимо небольшое количество кислорода, гораздо меньшее, чем в воздухе. HP вырабатывает окислительные ферменты, способна формировать защитную биопленку, спасающую от антител и агрессивной желудочной среды.
В неблагоприятных условиях хеликобактер пилори меняет спиралевидную форму на круглую, изменяя при этом также строение клеточной стенки, вследствие чего иммунная система человека не может узнать известный ранее микроорганизм. Такое явление называется бактериальной мимикрией.
Круглую форму невозможно культивировать в лабораторных условиях. Ее обнаруживают после антибиотикотерапии или по мере «старения» выращенных на питательных средах культур. Круглая форма более устойчива к антибактериальным препаратам, чем спиралевидная, она также обладает большей вирулентностью и канцерогенностью.
Причины хеликобактериоза и пути заражения
 Эпидемиология хеликобактерной инфекции довольна проста. Возбудитель – это антропоноз, т.е. вызывает заболевания только у людей. Бактерия передается через слизь и слюну. Заражение чаще всего происходит при очень тесных контактах, например, через поцелуи, общие столовые приборы, посуду, предметы гигиены. Исследования показывают, что патогенный микроорганизм может передаваться также фекально-оральным способом, но случается это реже, так как хеликобактер не может долго жить вне организма человека. Встречаются случаи передачи инфекции при эндоскопии, когда обследование проводится плохо стерилизованным прибором. Рост случаев передачи возбудителя отмечается в весенний и осенний период, что, связано с сезонными обострениями хронических гастродуоденальных патологий.
Эпидемиология хеликобактерной инфекции довольна проста. Возбудитель – это антропоноз, т.е. вызывает заболевания только у людей. Бактерия передается через слизь и слюну. Заражение чаще всего происходит при очень тесных контактах, например, через поцелуи, общие столовые приборы, посуду, предметы гигиены. Исследования показывают, что патогенный микроорганизм может передаваться также фекально-оральным способом, но случается это реже, так как хеликобактер не может долго жить вне организма человека. Встречаются случаи передачи инфекции при эндоскопии, когда обследование проводится плохо стерилизованным прибором. Рост случаев передачи возбудителя отмечается в весенний и осенний период, что, связано с сезонными обострениями хронических гастродуоденальных патологий.
Источник хеликобактериоза – больной как острой, так и бессимптомной формами болезни. Чаще всего это люди старше 60 лет. В группе риска также находятся лица с состояниями дефицита иммунитета. Бактерия продуцирует цитотоксины, которые проникают сквозь слизисто-бикарбонатный желудочный барьер и разрушают слизистую оболочку.
В большинстве случаев НР-инфекций клинические симптомы отсутствуют и патологические повреждения слизистой минимальны. Появление явных признаков заболевания происходит при развитии значительных нарушений иммунной защиты. При этом отмечается возникновение острого гастрита с выраженной воспалительной реакцией, которая затем переходит в хронический процесс.
Инфицирование H. pylori и повреждение слизистой верхнего отдела тонкого кишечника возможно только при наличии участков метаплазии желудочного эпителия. Доказана прямая связь между хроническим хеликобактериальным гастритом, возникновением язвенной болезни и даже раком желудка.
Симптомы хеликобактериоза
В зависимости от клинико-патологических особенностей заражения Helicobacter pylori появляются определенные симптомы, на основе которых ставится диагноз и назначается лечение. Инкубационный период составляет от нескольких суток до недели. Клинические проявления заболеваний, вызванных хеликобактером, не отличаются от других патологий ЖКТ.
По интенсивности симптоматики выделяют следующие формы HP-ассоциированных заболеваний:

- Бессимптомная – при хорошем иммунитете бактерия не вызывает дискомфорт и болевые ощущения, нарушения функций ЖКТ не особо заметны. Однако многолетнее течение латентного хеликобактериоза может в итоге привести к раку желудка.
- Острый гастрит или гастродуоденит. Большинство пациентов при этом жалуются на слабость, усталость, дискомфорт и боли в эпигастральной области, тошноту, изжогу, рвоту, запор или диарею, изменения аппетита. Часто проявляются также признаки вегето-сосудистой дистонии.
- Хронический антральный гастрит либо дуоденит. Во время обострения хронического процесса также доминируют диспепсический, интоксикационный и болевой синдромы.
- Язва желудка и/или двенадцатиперстной кишки. Клиническое течение болезни более тяжелое, связано с более глубоким поражением слизистой органов. Обострения случаются чаще, обычно возникают при иммунодефицитных состояниях, курении, алкоголизме, наркомании и других провоцирующих факторах. Язвенная болезнь довольно часто осложняется желудочными кровотечениями, перфорацией слизистой, пенетрацией в другие органы, рубцовыми деформациями.
- Другие, редко встречающиеся формы (хеликобактер-ассоциированный эзофагит, колит, энтерит, проктит). Обострения редких форм сопровождаются дисфагией (расстройством глотания), метеоризмом, запорами, диареей.
Даже когда человек является носителем хеликобактера, то есть инфекция протекает бессимптомно, это не следует оставлять без внимания. При благоприятных условиях, на фоне тяжелого иммунодефицита заболевание может перейти в манифестную форму.
При своевременной диагностике и адекватном лечении прогноз для жизни пациента в основном благоприятный. Летальные случаи возможны при запущенных и тяжелых осложнениях язвенной болезни.
Диагностика заболеваний
Для подтверждения клинического диагноза пользуются следующими методами диагностики Helicobacter pylori:
- бактериологическое исследование мазков-отпечатков и выявление бактерий с помощью иммунофлюоресценции или темнопольной микроскопии,
- культуральное выделение возбудителя,
- полимеразная цепная реакция (ПЦР) кала,
- биопсия тканей слизистой желудка и двенадцатиперстной кишки,
- серологические исследования биологического материала больного (крови, слюны), позволяющие обнаружить антитела к хеликобактеру,
- уреазный аэротест, при котором определенное содержание аммиака в выдыхаемом воздухе означает наличие НР у пациента.
Эффективным является изотопный анализ, основанный на определении в моче и выдыхаемом воздухе меченых изотопов мочевины.
Как бороться с НР-инфекциями?
Избавиться от бактерии следует в любом случае, поэтому эрадикационная терапия хеликобактер пилори назначается не только пациентам с острыми и хроническими формами болезни, но и носителям с бессимптомным течением.
Медикаментозное лечение
Эрадикация хеликобактер пилори основана на этиотропной (направленной на устранение причины) и патогенетической (предназначенной для коррекции функциональных нарушений) терапии. Для прямого воздействия на возбудителя при антральном гастрите назначают лекарства, способные убить бактерию, такие как Метронидазол или Тинидазол. При желудочных и дуоденальных язвах прописывают производные висмута, например, Вис-Нол, Гастро-норм, Де-Нол, Улькавис. Медикаменты для этиотропной терапии относятся к препаратам первой линии.
Вторую линию составляют патогенетические лекарственные средства. Характер течения язвенной болезни довольно длительный, с периодическими обострениями и высокой частотой рецидивов. Поэтому для патогенетического лечения с целью коррекции нарушенных функций поврежденных органов и нормализации обмена веществ показано применение ингибиторов протонной помпы (Омепразол, Нексиум) и Н2-гистаминорецепторов (Ранитидин, Фамотидин).

Медикаментозная терапия хеликобактера наиболее эффективна при назначении схемы лечения, которая также направлена на предотвращение рецидивов. При легком течении болезни может быть рекомендована тройная терапия – комбинация из трех препаратов, например, Де-Нола, Омепразола, Метронидазола. Показанием к назначению квадротерапии являются хронические и дефектные формы болезни. При этом используют комбинации следующих групп медикаментов:
- коллоидные субцитраты висмута – Де-Нол, Вис-Нол и др.,
- ингибиторы протонной помпы – Пантопразол, Омепразол,
- антибиотики и противопротозойные фармпрепараты – Метронидазол, Фазижин,
- макролиды – Аугментин, Кларитромицин.
Из противомикробных препаратов широкого спектра действия заменить макролиды способен Амоксициллин, но высокая чувствительность к его компонентам может стать причиной аллергии и, следовательно, противопоказанием.
Во время и после лечения обязателен контроль состояния кишечной микрофлоры для профилактики дисбактериоза.
Эффективным является назначение курса восстановительной терапии, включающего пробиотики (Бифи-форм), прокинетики (Домперидон), витаминные комплексы.
Использование монотерапии или неполноценных схем эрадикации ведет к быстрому развитию у H.pylori резистентности к антибиотикам и отсутствию терапевтического эффекта.
Народная медицина и Хеликобактер
Наряду с традиционной медикаментозной терапией, широко пользуется успехом лечение заболеваний ЖКТ и избавление от хеликобактера народными средствами. Но так как компоненты, используемые в рецептах домашней медицины, оказывают в основном симптоматическое действие, их лучше комбинировать с фармпрепаратами и применять только по рекомендации лечащего врача. При этом обязательно учитываются:
- возраст пациента – ребенку могут быть противопоказаны некоторые средства, подходящие для лечения взрослых,
- наиболее выраженные симптомы,
- секреторная функция желудка – она может быть нормальной, повышенной или сниженной,
- особенности клинического течения и стадия заболевания.
В дополнение к основной терапии, лечить НР-ассоциированные болезни ЖКТ можно с помощью отваров из цветков ромашки и календулы, средств на основе коры дуба, семян льна, алоэ, прополиса, таких трав, как зверобой и шалфей.
Диета при лечении хеликобактерной инфекции
Правильное, сбалансированное питание пациента – залог успеха терапии. Диета при хеликобактерных инфекциях направлена на смягчение болевых ощущений в области ЖКТ и повышение эффективности лечения. Чтобы предотвратить дальнейшее раздражение и повреждение слизистой желудка и двенадцатиперстной кишки, из рациона следует исключить продукты, стимулирующие выработку желудочного сока: копчености, пряности, жареные, жирные и соленые блюда, черный хлеб, богатые клетчаткой фрукты и овощи, кофе, алкоголь.

Пациентам рекомендована обволакивающая слизистую оболочку пища, слабо стимулирующая секреторную функцию желудка, например, перетертые супы из круп и овощей, отварная рыба, паровые котлеты, молоко, яйца, белые сухарики, некрепкий чай, щелочная вода без газа.
Соблюдение лечебного диетического питания в комплексе с терапевтическими мероприятиями приведет к более быстрому улучшению состояния пациента.
Профилактика хеликобактериоза
В качестве меры предосторожности, чтобы минимизировать риски заражения НР-инфекцией, следует должным образом соблюдать правила гигиены – не пользоваться общей посудой, тщательно мыть руки перед приемом пищи, использовать индивидуальные гигиенические средства. Профилактика заболеваний, вызванных хеликобактером, включает в себя корректировку способа жизни. Важно избегать физических и психических перегрузок, проводить санацию очагов возможной инфекции, рационально питаться.
Кроме того, при выявлении данной инфекции в семейном кругу, целесообразно провести эрадикацию всем членам семьи. Через 2–3 месяца после успешной терапии хеликобактериоза желательно снова пройти исследование, например, дыхательный тест, в качестве профилактики повторного инфицирования.
 Загрузка…
Загрузка…kardiobit.ru

