Дисбактериоз с определением чувствительности к антибиотикам и бактериофагам
Количественный метод бактериологического исследования микрофлоры кишечника на специальных обогащенных питательных средах с целью выявления дисбиотических состояний у взрослых. Исследование на определение чувствительности к антибиотикам ставится диско-диффузионным методом с учетом рекомендаций по антибиотикорезистентности. Исследование на определение чувствительности к бактериофагам может быть выполнено в случае, если к обнаруженному возбудителю существует бактериофаг.
В каких случаях обычно назначают посев на дисбактериоз?
Посев на дисбактериоз проводится с целью выявления нарушений баланса микрофлоры кишечника, основывается на определении количественного состава основных бактерий, населяющих кишечник. Полученные результаты сопоставляют с нормальными показателями. С целью оценки динамики показателей, посев кала на дисбактериоз проводят не ранее, чем через 2 недели после окончания терапии антибиотиками или бактериофагами.
Дисбактериоз (нарушение баланса нормальной флоры кишечника) у взрослых и у детей может быть связано с нарушением работы печени, желчевыводящих путей, желудка, поджелудочной железы.
Признаки дисбактериоза могут сопровождать следующие состояния:
- паразитарные инвазии, в том числе лямблиоз;
- хронические инфекции, например, носительство стафилококка;
- аллергии;
- гиповитаминоз;
- сахарный диабет;
- после приема антибиотиков.
Дисбактериоз кишечника может проявляться запором, диареей, метеоризмом, болями и другими расстройствами.
Что именно определяется в процессе анализа?
Исследование позволят выявить и определить количество как нормальной микрофлоры, так и условно- патогенных микроорганизмов. Часть возбудителей кишечных инфекций тоже может быть обнаружена в этом тесте.
Что означают результаты теста?
Анализ позволит выявить изменения биоценоза кишечника и определить степень их выраженности.
Обычный срок выполнения теста:
до 7-8 дней
Нужна ли специальная подготовка к анализу?
Специальная подготовка не требуется. Исследование нельзя проводить на фоне приема антибактериальных препаратов. После окончания лечения должно пройти не менее 2-ух недель.
Анализ на дисбактериоз
Кишечная микрофлора играет важную роль в функционировании организма. Бактерии кишечника участвуют в пищеварении, регулируют газовый состав, препятствуют размножению патогенной флоры. При нарушении состава микрофлоры развивается дисбактериоз. И хотя он не является самостоятельным заболеванием, однако вызывает нарушения в области желудочно-кишечного тракта, провоцирует аллергию, сопровождается слабостью всего организма, бессонницей и так далее. Для первичной диагностики этого отклонения назначается анализ кала на дисбактериоз (анализ на дисбиоз).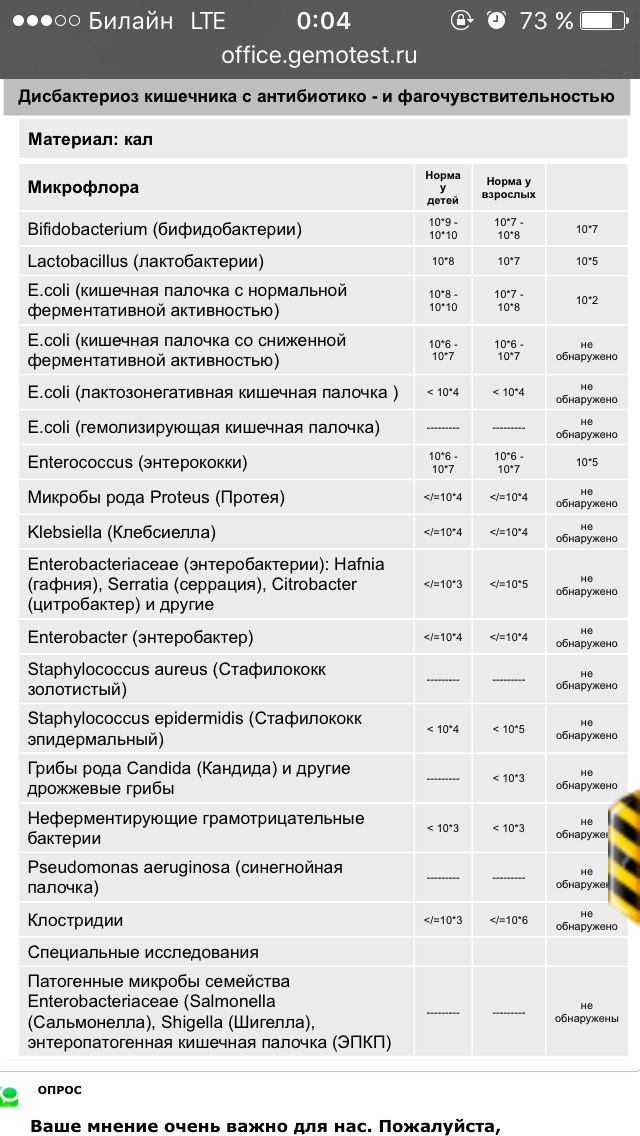
Анализ на дисбактериоз определяет состав флоры кишечника, позволяет обнаружить различные микроорганизмы, которые вызывают такие патологии, как брюшной тиф, сальмонелез, дизентерия и другие.
Показания к назначению анализа:
- Нарушения стула (запор, понос, появление слизи и другие)
- Длительный прием антибиотиков или гормональных средств, химиотерапевтических препаратов, лучевой терапии
- Повышенное газообразование, боли в животе
- Подозрения на кишечные заболевания
- Аллергические заболевания кожного покрова.
Часто анализ на дисбактериоз назначают после различного рода кишечных инфекций, а также при длительном периоде адаптации и выздоровления.
Расшифровка результатов (нормы взрослого человека):
Кишечная палочка- с гемолизирующими свойствами — отрицательно
- со сниженными ферментативными и нормальными ферментативными свойствами — 107— 108 Ед/л
- лактозонегативные — до 105 Ед/л.

Бактерии
- тифопаротифозной и дизентерийной группы — отрицательно
- молочнокислые — 107— 108 Ед/л.
Энтерококки — 105-108 Ед/л.
Клостридии — до 105 Ед/л.
Дрожжевые грибы рода Candida — не более 104 Ед/л.
Условно-патогенная флора — не более 104 Ед/л.
Клостридии — не более 105 Ед/л.
Staphylococcus aureus — отрицательно.
ЭИ, ЭП, ЭТ эшерихии — отрицательно.
Подготовка к анализу кала на дисбактериоз:
- За 72 часа до сдачи исключить прием лекарственных препаратов, продуктов и веществ, которые влияют на перистальтику кишечника, в частности оказывают слабительное действие, а также могут влиять на окраску кала
- В случае назначения пациенту антибиотиков или любых антибактериальных лекарственных средств, забор кала должен производиться до начала приема или спустя две недели после.

Сдать анализ на дисбактериоз вы можете в филиалах сети «Медкомиссия №1». Наши центры расположены в 7 районах Санкт-Петербурга и оснащены высокотехнологичными лабораториями. Результаты анализа будут готовы в кратчайшие сроки.
Анализ на дисбактериоз у детей. Как сдавать кал для анализа. Расшифровка результатов анализа на дисбактериоз
Автор
Евтушенко-Сигаева Мария Вячеславовна Ведущий врачГастроэнтеролог
Что такое дисбактериоз
В норме состояние микрофлоры кишечника таково, что деятельность вредоносных бактерий успешно подавляется, а количество полезных бактерий соответствует потребностям организма. Но если необходимый баланс нарушается, кишечник перестаёт функционировать правильным образом. Подобное состояние и есть дисбактериоз.
Но если необходимый баланс нарушается, кишечник перестаёт функционировать правильным образом. Подобное состояние и есть дисбактериоз.
Зачем нужен анализ на дисбактериоз
Чтобы подтвердить, что проблемы со здоровьем вызваны дисбактериозом, необходимо сделать анализ на дисбактериоз.
Анализ на дисбактериоз позволяет установить концентрацию и определить соотношение:
- полезных микроорганизмов, таких как лактобактерии, бифидобактерии, кишечная палочка Escherichia coli с нормальными ферментативными свойствами;
- условно-патогенных, т.е. населяющих кишечник, но не всегда приводящих к заболеванию. (энтеробактерии, стафилококки, клостридии, грибы рода Candida). Болезненные проявления, наблюдаются, как правило, лишь в том случае, если количество подобных микроорганизмов резко возрастает и начинает превышать норму;
- патогенных, в норме в кишечнике отсутствующих (шигеллы, сальмонеллы).
Когда назначается анализ на дисбактериоз
Анализ на дисбактериоз назначается:
Анализ на дисбактериоз может назначить врач общей практики (терапевт, семейный врач, педиатр) или гастроэнтеролог.
Как сдавать анализ на дисбактериоз
Материалом для анализа является кал. Кал собирается в стерильный контейнер. Для анализа достаточно около 10 мл (меньше столовой ложки). Важно, чтобы в кал не попала моча. Собранный материал нужно доставить в лабораторию в течение 3-х часов.
Подготовка к анализу кала на дисбактериоз
За 3-4 дня до анализа необходимо прекратить прием слабительных препаратов. Также не следует пользоваться ректальными свечами.
Если Вы проходили рентгенографическое исследование желудка или кишечника с введением рентгеноконтрастного вещества, необходимо будет подождать, пока оно полностью выведется из организма, и только потом собрать материал для анализа. Также для анализа не подходит материал, полученный с помощью клизмы.
Расшифровка результатов анализа на дисбактериоз
Патогенные энтеробактерии – в норме отсутствуют. Их присутствие указывает на острую кишечную инфекцию. Энтеробактерии – сальмонеллы и шигеллы – являются возбудителями серьезного заболевания – дизентерии.
Энтеробактерии – сальмонеллы и шигеллы – являются возбудителями серьезного заболевания – дизентерии.
Бифидобактерии – обеспечивают расщепление и переваривание пищи, усвоение железа, нейтрализацию токсинов. Норма – 109-1010 КОЕ/г, у детей первого года жизни 1010-1011. Существенное снижение количества бифидобактерий – явный признак дисбактериоза.
Лактобактерии – расщепляют лактозу, поддерживают необходимый уровень кислотности толстой кишки, повышают активность фагоцитов – клеток иммунной защиты. Норма: 107-108 КОЕ/г, у детей первого года жизни 106-107.
Кишечная палочка (E.coli) с нормальной ферментативной активностью – препятствует развитию условно-патогенной микрофлоры, вырабатывает витамины группы B, способствует усвоению железа и кальция. Нормальное значение: 107-108 КОЕ/г. Результат ниже нормы может указывать на наличие кишечных паразитов – глистов.
Кишечная палочка (E.coli) со сниженной ферментативной активностью – не причиняет вреда, но и не приносит никакой пользы.
Гемолитические кишечные палочки (E.coli) – способны вырабатывать токсины. В норме должны отсутствовать.
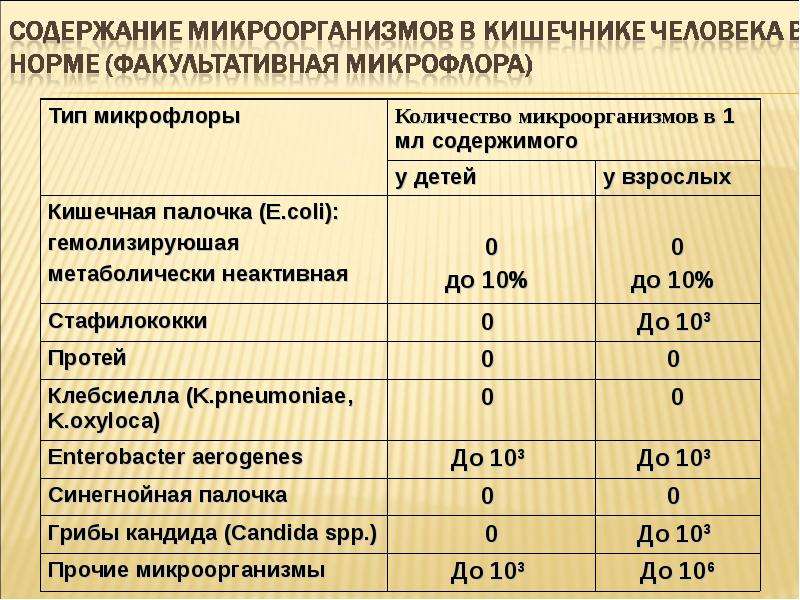
Нормы по условно-патогенным микроорганизмам:
- микробы рода протея – менее 102;
- условно-патогенные энтеробактерии – менее 104;
- энтерококки – 105-108, у детей до года 105-107;
- стафилококк золотистый (S.aureus.) и др. гемолитические стафилококки – отсутствуют;
- стафилококки (сапрофитные, эпидермальный) – менее 104;
- грибы рода Candida – менее 103;
- бактероиды – менее 107;
- клостридии – не более 105.
Не занимайтесь самолечением. Обратитесь к нашим специалистам, которые правильно поставят диагноз и назначат лечение.
Спасибо за оценку
🧬 Анализ на «дисбактериоз»: пожалуйста, хватит
Прилетели как-то на Землю инопланетяне. Посмотрели: ледники тают, озоновые дыры растут, панды не размножаются. Стали думать, отчего это все. Спустились в московский район Бирюлево. Взяли сотню человек, раздели, пощупали, допросили. Сделали вывод: озоновые дыры — из-за брюнетов (много их попалось), панды не размножаются из-за мужиков — их на летающей тарелке оказалось больше половины. Ну, а глобальное потепление — из-за рубля: у всех жителей Бирюлево в карманах оказалась эта валюта. Улетели инопланетяне к себе домой и по результатам исследования напечатали своими зелеными щупальцами десять кандидатских диссертаций.
Посмотрели: ледники тают, озоновые дыры растут, панды не размножаются. Стали думать, отчего это все. Спустились в московский район Бирюлево. Взяли сотню человек, раздели, пощупали, допросили. Сделали вывод: озоновые дыры — из-за брюнетов (много их попалось), панды не размножаются из-за мужиков — их на летающей тарелке оказалось больше половины. Ну, а глобальное потепление — из-за рубля: у всех жителей Бирюлево в карманах оказалась эта валюта. Улетели инопланетяне к себе домой и по результатам исследования напечатали своими зелеными щупальцами десять кандидатских диссертаций.
Вот как-то так и проводится «анализ на дисбактериоз». Поговорим об этом диагнозе с гастроэнтерологом GMS Clinic Головенко Алексеем.
Что не так с этим исследованием? Его же так часто назначают врачи!
- Давайте оговоримся: его назначают врачи только в странах бывшего СССР. За пределами этих государств простой посев стула для выявления дисбаланса микрофлоры не выполняется.
 Вы не найдете указаний на необходимость этого исследования ни в руководстве WGO по синдрому раздраженного кишечника, ни в рекомендациях ACG (Американской коллегии гастроэнтерологов) по острой диарее, ни в стандарте AAFP (Американской ассоциации семейных врачей) по наблюдению новорожденных с коликами. Ну и, естественно, никакого диагноза «дисбактериоз» нет ни в Международной классификации болезней, ни в хотя бы одном (!) нерусскоязычном учебнике.
Вы не найдете указаний на необходимость этого исследования ни в руководстве WGO по синдрому раздраженного кишечника, ни в рекомендациях ACG (Американской коллегии гастроэнтерологов) по острой диарее, ни в стандарте AAFP (Американской ассоциации семейных врачей) по наблюдению новорожденных с коликами. Ну и, естественно, никакого диагноза «дисбактериоз» нет ни в Международной классификации болезней, ни в хотя бы одном (!) нерусскоязычном учебнике. - В нашем желудочно-кишечном тракте обитает не менее 1000 (тысячи!) видов бактерий, а число всех выявленных видов составляет 2172. Выполняя «анализ кала на дисбактериоз» мы помещаем в питательную среду стул и дожидаемся роста (появления колоний) приблизительно 20 видов бактерий, которые мы выбрали только потому, что они в состоянии расти в этой питательной среде. Большая часть кишечных обитателей не культивируется, то есть увидеть своими глазами их колонии в чашке Петри мы не можем. Иными словами, делая выводы о состоянии микрофлоры по размножению 20 видов, мы игнорируем подавляющее большинство бактерий.
 8 в грамме стула. Ссылок на литературу в стандарте полно, но, что подозрительно, среди них нет ни одной зарубежной публикации. Ну а сами статьи и учебники не описывают, как именно сравнивали микрофлору здоровых и больных людей, то есть как именно был сделан вывод о нормальном содержании той или иной бактерии.
8 в грамме стула. Ссылок на литературу в стандарте полно, но, что подозрительно, среди них нет ни одной зарубежной публикации. Ну а сами статьи и учебники не описывают, как именно сравнивали микрофлору здоровых и больных людей, то есть как именно был сделан вывод о нормальном содержании той или иной бактерии. - Бактерии, обнаруживаемые в стуле (который формируется в толстой кишке) — это совсем не те же бактерии, что обитают в ротовой полости или тонкой кишке. Кроме того, бактерии в стуле (то есть в просвете кишки) — это совсем не бактерии, обитающие в слизи, защищающей кишечную стенку. Вообще, через наш пищеварительный тракт «пролетает» безумное количество чужеродных бактерий, грибов и вирусов. К счастью, большая их часть не могут подобраться к кишечной стенке: обитающая там пристеночная микрофлора конкурирует с «пришельцами». Мы называем это явление колонизационной резистентностью, и именно ему мы обязаны тем, что первая же проглоченная со стаканом московской воды условно-патогенная бактерия не вызывает у нас понос.

- Состав и соотношение кишечных бактерий у каждого человека свои. Изучив (не посевом кала, конечно, а сложнейшими генетическими методами) состав бактерий в стуле, можно, например, угадать принадлежит ли образец жителю Нью-Йорка или побережья Амазонки. Ну, или в каком регионе отдельной страны (например, Дании). проживает человек, отправивший на анализ свои фекалии. В общем, истинный состав кишечной микрофлоры — наши «отпечатки пальцев», и предполагать некую общую норму, а уж тем более судить о «нормальности» флоры всего по 20 видам из 1000 — смешно.
- То, будут ли размножаться бактерии на питательной среде, зависит не только от того, какие бактерии в стуле живут, но и от того, как стул собрали (с унитаза, со стерильной бумаги), как хранили (в холодильнике, у батареи, у окна), как быстро доставили в лабораторию. Много ли людей, которым рекомендовали анализ на дисбактериоз читали вот эту инструкцию, согласно которой кал нужно собрать в стерильную посуду, поместить в холодильник и нести в лабораторию не в руках, а в термосе с кубиком льда? Впрочем, даже при совершении этих действий результат анализа на дисбактериоз интерпретировать нормальный врач не может.
 А значит, не должен и пытаться это сделать.
А значит, не должен и пытаться это сделать.
В питательной среде появились колонии бактерий. К счастью для нас, действительно опасная Сальмонелла растет в питательной среде. Большая часть кишечных бактерий, увы, нет.
Так что, нет такого понятия — «дисбактериоз»?
Конечно, есть. Например, псевдомембранозный колит — тяжелое воспаление толстой кишки после антибиотика — самый настоящий дисбактериоз: погибли конкуренты, и поэтому размножается Clostridium difficile. Только для того, чтобы это лечить, совершенно не нужно констатировать очевидное — состав бактерий в кишке изменился. Достаточно подтвердить инфекцию (выявить токсины C.difficile) и назначить лечение.
Кишечная микрофлора, вне сомнения, влияет на все процессы в нашем организме. Пересадив стул от мыши с ожирением мышке с нормальным весом, у последней мы вызываем ожирение. Состав кишечных бактерий принципиально разный у людей с тревожностью и депрессией. Ну, а добавление пробиотика Bacteroides fragilis мышам, у которых искусственно вызвали аутизм, улучшает их социальные навыки. Прочитайте популярную книгу «Смотри, что у тебя внутри» известного микробиолога Роба Найта: наши знания о микрофлоре колоссальны, но применять их на практике (то есть для лечения болезней) мы пока только начинаем.
Ну, а добавление пробиотика Bacteroides fragilis мышам, у которых искусственно вызвали аутизм, улучшает их социальные навыки. Прочитайте популярную книгу «Смотри, что у тебя внутри» известного микробиолога Роба Найта: наши знания о микрофлоре колоссальны, но применять их на практике (то есть для лечения болезней) мы пока только начинаем.
Состав бактерий можно и нужно изучать. Этому посвящено амбициозное международное исследование Human Microbiome Project с бюджетом $115 млн. Естественно, никакие «посевы стула» при этом не используются. Для анализа микробных «джунглей» кишечника используются методы метагеномики. Они позволяют описать, сколько уникальных последовательностей ДНК присутствует у конкретного человека, какие группы бактерий преобладают, а какие отсутствуют. К слову, когда такие технологии (например, секвенирование 16S-рРНК появились, выяснилось, что 75% видов, обнаруживаемых при генетическом анализе того же кала, вообще не известны науке.
Стоп. То есть делать посев стула вообще нет смысла?
Я этого не говорил. Мы обязательно выполняем посев стула, если хотим выявить рост по-настоящему вредных бактерий. Например, у человека с кровавой диареей мы пытаемся найти Сальмонеллу или Шигеллу, Кампилобактерию или особую разновидность кишечной палочки. Здесь посев кала жизненно необходим, ведь так мы сможем назначить лечение антибиотиком — убить конкретного возбудителя.
Грамотный врач выполняет диагностический тест только тогда, когда его результат может изменить лечение. Если и при «дефиците» лактобактерий, и при «избытке» кишечной палочки будет назначено одно и то же лекарство или диета, анализ является пустой тратой денег.
Полноценное исследование собственной микрофлоры уже можно сделать на коммерческой основе в США и Европе. Стоит «удовольствие» около 100 евро, и в результате генетического анализа микрофлоры вы получите заключение (например, вот такое) о преобладающих в вашем пищеварительном тракте бактериях. Проблема в том, что и эти результаты невозможно применить на практике. Потому что:
Проблема в том, что и эти результаты невозможно применить на практике. Потому что:
пока у нас НЕТ способа, избирательно менять состав кишечных бактерий.
Предположим, мы однозначно установили, что у человека имеется дефицит какой-то конкретной микроорганизмы (например, лактобактерий). Мы можем:
- Дать пробиотик (то есть конкретную живую бактерию) и надеяться, что она останется жить в кишечнике.
- Дать пребиотик (то есть «корм» для бактерии) и надеяться, что это усилит рост именно нужной нам бактерии.
- Дать антибиотик (яд для бактерии) и надеяться, что погибнет именно чрезмерно размножившаяся бактерия.
- Пересадить человеку чужую микрофлору — сделать трансплантацию фекальной микробиоты (ввести разбавленный стул здорового человека больному человеку).
Очевидно, избирательным действием можно считать только назначение пробиотика. Максимальная доза лучшего коммерческого пробиотика — это 10 млрд. жизнеспособных бактерий в дозе препарата. В кишечнике обитает около 100 триллионов бактерий. То есть, на каждую бактерию «из аптеки» приходится 10 тысяч бактерий, уже «проживающих» в кишке. Маловероятно, что это ничтожное количество бактерий сможет преодолеть колонизационную резистентность и «заселить» кишку. Кроме того, механизм действия пробиотиков (когда они работают) может вообще быть связан с не с самими бактериями: у трансгенных мышей, предрасположенных в воспалению кишечника это самое воспаление удалось остановить, применяя не «живой» пробиотик, а вообще ДНК и некоторые белки, выделенные из «убитого» температурой препарата.
жизнеспособных бактерий в дозе препарата. В кишечнике обитает около 100 триллионов бактерий. То есть, на каждую бактерию «из аптеки» приходится 10 тысяч бактерий, уже «проживающих» в кишке. Маловероятно, что это ничтожное количество бактерий сможет преодолеть колонизационную резистентность и «заселить» кишку. Кроме того, механизм действия пробиотиков (когда они работают) может вообще быть связан с не с самими бактериями: у трансгенных мышей, предрасположенных в воспалению кишечника это самое воспаление удалось остановить, применяя не «живой» пробиотик, а вообще ДНК и некоторые белки, выделенные из «убитого» температурой препарата.
Ну, а главное: одно дело — теория и лабораторные исследования, другое дело — клинические испытания (то есть изучение эффекта препаратов у людей). Разберем три типовых для России ситуации, когда человеку предлагают сдать «анализ кала на дисбактериоз»:
Колики у новорожденного
Мама жалуется, что ребенок много плачет. К слову, любой ребенок в первые три месяца жизни кричит от 117 до 133 минут в сутки (мета-анализ). Наличие или отсутствие колик (беспричинный крик более 3 часов за день хотя бы 3 дня в неделю), в целом, не влияет на риск задержки развития ребенка. В одном исследовании, простая беседа с родителями о «безопасности» колик уменьшала продолжительность плача с 2,6 до 0,8 часов в день. Дети — эмпаты.
К слову, любой ребенок в первые три месяца жизни кричит от 117 до 133 минут в сутки (мета-анализ). Наличие или отсутствие колик (беспричинный крик более 3 часов за день хотя бы 3 дня в неделю), в целом, не влияет на риск задержки развития ребенка. В одном исследовании, простая беседа с родителями о «безопасности» колик уменьшала продолжительность плача с 2,6 до 0,8 часов в день. Дети — эмпаты.
Чаще бывает не так. Выполняется анализ кала на дисбактериоз, там, естественно (норма-то взята с «потолка»), обнаруживаются «отклонения». Назначается пробиотик. И часто ведь помогает: еще бы, ведь частота колик неумолимо снижается с возрастом ребенка. При этом уверенности в том, что пробиотики вообще эффективны при коликах, у нас нет. Многочисленные мета-анализы, посвященные лечению и профилактике этого состояния, не смогли однозначно подтвердить эффективность пробиотиков. Возможно, какое-то полезное действие оказывает пробиотик Lactobacillus reuteri. Вот только для того, чтобы назначить этот препарат, анализ кала на «дисбактериоз» нам совершенно не нужен.
Атопический дерматит у ребенка
Все уверены, что проблемы с кожей — от «живота». Будь это так, наверное, атопический дерматит прекрасно лечился бы пробиотиками. Но этот подход не слишком эффективен. Последний мета-анализ свидетельствует: применение пробиотиков (главным образом, Lactobacillus rhamnosus GG) несколько уменьшает выраженность экземы, но эффект этот весьма символический, а дополнительная терапия пробиотиком не позволяет сократить частоту применения местных стероидов, которые (вместе с увлажнением кожи) остаются основой лечения атопического дерматита. И вновь: назначить этот пробиотик мы можем вне зависимости от «результатов» «анализа на дисбактериоз».
Вздутие и спазмы в животе у взрослого
Вздутие живота чаще всего является проявлением избыточного бактериального роста в тонкой кишке (СИБРа), при котором помогает не пробиотик, а антибиотик, например, рифаксимин. Это состояние диагностируется при помощи специального дыхательного теста. Нередко постоянное вздутие живота является следствием внешнесекреторной недостаточности поджелудочной железы: дефицит ферментов в стуле можно выявить при помощи теста на фекальную эластазу, назначив при снижении постоянную терапию ферментами. Но чаще всего ощущение «вздутия» связано с повышенной чувствительностью кишки (висцеральной гиперчувствительностью), которая развивается у людей с синдромом раздраженного кишечника. Как вы уже догадались, для того, чтобы оценить количество бактерий в тонкой кишке, функцию поджелудочной железы или чувствительность кишки к растяжению, изучать 20 бактерий в кале бессмысленно. Да и эффективность пробиотиков при синдроме раздраженного кишечника вызывает сомнения.
Нередко постоянное вздутие живота является следствием внешнесекреторной недостаточности поджелудочной железы: дефицит ферментов в стуле можно выявить при помощи теста на фекальную эластазу, назначив при снижении постоянную терапию ферментами. Но чаще всего ощущение «вздутия» связано с повышенной чувствительностью кишки (висцеральной гиперчувствительностью), которая развивается у людей с синдромом раздраженного кишечника. Как вы уже догадались, для того, чтобы оценить количество бактерий в тонкой кишке, функцию поджелудочной железы или чувствительность кишки к растяжению, изучать 20 бактерий в кале бессмысленно. Да и эффективность пробиотиков при синдроме раздраженного кишечника вызывает сомнения.
Так нужно хоть в какой-то ситуации сдавать «кал на дисбактериоз»?
Нет. Никогда. Ни при каких обстоятельствах. Мы не лечим вздутие живота, изучая линии на ладони. Мы не лечим сыпь, глядя в хрустальный шар. Мы не делаем бессмысленный анализ на дисбактериоз, чтобы назначить лечение.
Мы ждем, когда доказательная медицина предложит нам эффективные препараты и практические способы понять, что не так с нашими бактериями.
Жду вместе с вами!
Источник: deti.mail.ru
Новое понимание кишечных фагов
Nobrega, F. L. et al. Механизмы нацеливания хвостатых бактериофагов. Nat. Ред. Microbiol 16 , 760–773 (2018).
CAS PubMed Google Scholar
Дай Р. Л., Рихтер К., Салмонд Г. П. и Файнеран П. С. Замечательные механизмы противостояния фаговым инфекциям у микробов. Annu. Rev. Virol. 1 , 307–331 (2014).
PubMed Google Scholar
Офир Г.С., Р. Современная биология фагов: от классических моделей к новым открытиям. Cell 172 , 1260–1270 (2018).
Google Scholar

Twort, F. W. Исследование природы ультрамикроскопических вирусов. Ланцет 2 , 1241–1243 (1915).
Google Scholar
d’Hérelle, F. О невидимом микробе, антагонистическом по отношению к дизентерийным бациллам. Compte Rendu de. l’Acad.émie des. Sci. 165 , 373–375 (1917).
Google Scholar
d’Hérelle, F. Исследования азиатской холеры. Yale J. Biol. Med 1 , 195–219 (1929).
PubMed PubMed Central Google Scholar
Бабалова, Е.G. et al. [Профилактическое значение высушенного бактериофага дизентерии]. Ж. Микробиол. Эпидемиол. Иммунобиол. 45 , 143–145 (1968).
CAS PubMed Google Scholar
Kutter, E. et al. Фаготерапия в клинической практике: лечение инфекций человека. Curr. Pharm. Biotechnol. 11 , 69–86 (2010).
Curr. Pharm. Biotechnol. 11 , 69–86 (2010).
CAS PubMed Google Scholar
Вайнбауэр М.Г. Экология прокариотических вирусов. FEMS Microbiol Rev. 28 , 127–181 (2004).
CAS PubMed Google Scholar
Чаттерджи А. и Дюркоп Б. А. Помимо бактерий: взаимодействия бактериофага и эукариот-хозяина раскрывают новые парадигмы здоровья и болезней. Front Microbiol 9 , 1394 (2018).
PubMed PubMed Central Google Scholar
Кин, Э. К. и Дантас, Г. Близкие контакты трех видов: бактериофаги, комменсальные бактерии и иммунитет хозяина. Trends Microbiol. 26 , 943–954 (2018).
CAS PubMed PubMed Central Google Scholar
Гогохия Л. и др. Распространение бактериофагов связано с обострением кишечного воспаления и колита. Cell Host Microbe 25 , 285–299 e288 (2019).
Cell Host Microbe 25 , 285–299 e288 (2019).
CAS PubMed PubMed Central Google Scholar
Аггарвала В., Лян Г. и Бушман Ф. Д. Вирусные сообщества кишечника человека: метагеномный анализ состава и динамики. Моб. ДНК 8 , 12 (2017).
PubMed PubMed Central Google Scholar
Шкопоров А. Н. и Хилл К. Бактериофаги кишечника человека: «известное неизвестное» микробиома. Cell Host Microbe 25 , 195–209 (2019).
CAS PubMed Google Scholar
Де Сорди, Л., Лоренко, М. и Дебарбье, Л. Битва внутри: взаимодействие бактериофагов и бактерий в желудочно-кишечном тракте. Cell Host Microbe 25 , 210–218 (2019).
PubMed Google Scholar
Сканлан, П.D. Совместная эволюция бактерий и бактериофагов в хижине человека: значение для микробного разнообразия и функциональности. Trends Microbiol. 25 , 614–623 (2017).
Совместная эволюция бактерий и бактериофагов в хижине человека: значение для микробного разнообразия и функциональности. Trends Microbiol. 25 , 614–623 (2017).
CAS PubMed Google Scholar
Ван Беллегхем Дж. Д., Дабровска К., Ваничутт М., Барр Дж. Дж., Боллыки П. Л. Взаимодействие между бактериофагом, бактериями и иммунной системой млекопитающих. вирусов 11 , pii: E10 (2018).
Roux, S. et al. Выявлено, что скрытые иновирусы распространены среди бактерий и архей в биомах Земли. Nat. Microbiol. 4 (11), 1895–1906 (2019).
CAS PubMed PubMed Central Google Scholar
Zhang, T. et al. Вирусное сообщество РНК в кале человека: преобладание патогенных вирусов растений. PLoS Biol. 4 , e3 (2006).
PubMed Google Scholar

Lim, E. S. et al. Динамика вирома кишечника человека и бактериального микробиома у младенцев в раннем периоде жизни. Nat. Med. 21 , 1228–1234 (2015).
CAS PubMed PubMed Central Google Scholar
Los, M. W. & Wegrzyn, G. Pseudolysogeny. Adv. Вирус Res . 82 , 339–348 (2012).
Манрике П., Диллс М. и Янг М. Дж. Сообщество кишечных фагов человека и его значение для здоровья и болезней. Вирусы 9 , E141 (2017).
PubMed Google Scholar
Reyes, A. et al. Вирусы фекальной микробиоты однояйцевых близнецов и их матерей. Природа 466 , 334–338 (2010).
CAS PubMed PubMed Central Google Scholar
Manrique, P. et al. Здоровый фаге кишечника человека. Proc.Natl Acad. Sci. США 113 , 10400–10405 (2016).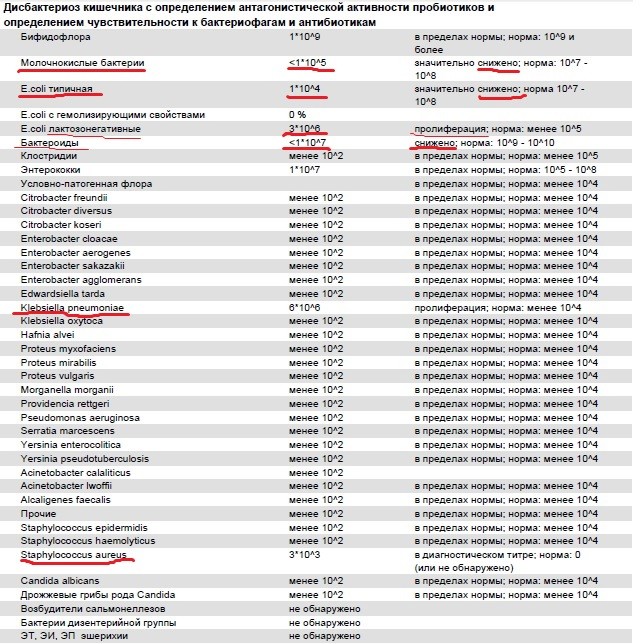
CAS PubMed Google Scholar
Грегори А. К., Заблоки О., Хауэлл А., Болдук Б., Салливан М. Б. База данных по вирому кишечника человека. Колд Спринг Харб. Лаборатория . https://doi.org/10.1101/655910 (2019).
Low, S.J., Dzunkova, M., Chaumeil, P.A., Parks, D.H. & Hugenholtz, P. Оценка филогении конкатенированных белков для классификации двухцепочечных ДНК-вирусов с хвостами, принадлежащих к отряду Caudovirales. Nat. Microbiol. 4 , 1306–1315 (2019).
CAS PubMed Google Scholar
Barylski, J. et al. Анализ споунавирусов как пример просроченной реклассификации хвостатых фагов. Syst. Биол. 69 , 110–123 (2019).
Google Scholar
Minot, S. et al. Виром кишечника человека: индивидуальная изменчивость и динамический ответ на диету. Genome Res. 21 , 1616–1625 (2011).
Genome Res. 21 , 1616–1625 (2011).
CAS PubMed PubMed Central Google Scholar
Шкопоров А.Н. и др. Виром кишечника человека очень разнообразен, стабилен и индивидуален. Cell Host Microbe 26 , 527–541 e525 (2019).
CAS PubMed Google Scholar
Touchon, M., Bernheim, A.И Роча, Э. П. Генетические и жизненные особенности, связанные с распределением профагов в бактериях. ISME J. 10 , 2744–2754 (2016).
CAS PubMed PubMed Central Google Scholar
Krupovic, M. & Forterre, P. Microviridae идет в умеренный климат: связанные с микровирусами провирусы находятся в геномах Bacteroidetes. PLoS ONE 6 , e19893 (2011).
CAS PubMed PubMed Central Google Scholar

Бобай, Л. М., Роча, Э. П. и Тушон, М. Адаптация бактериофагов умеренного климата к геномам их хозяев. Мол. Биол. Evol. 30 , 737–751 (2013).
CAS PubMed Google Scholar
Cornuault, J. K. et al. Фаги, заражающие Faecalibacterium prausnitzii , относятся к новым вирусным родам, которые помогают расшифровывать кишечные виромы. Микробиом 6 , 65 (2018).
PubMed PubMed Central Google Scholar
Lugli, G.A. et al. Профаги рода Bifidobacterium как модулирующие агенты микробиоты кишечника младенца. Environ. Microbiol. 18 , 2196–2213 (2016).
PubMed Google Scholar
Waller, A. S. et al. Классификация и количественная оценка таксонов бактериофагов в метагеномах кишечника человека. ISME J. 8 , 1391–1402 (2014).
CAS PubMed PubMed Central Google Scholar
Kim MSB, J. W. Лизогения широко распространена в кишечной микробиоте мышей. ISME J. 12 , 1127–1141 (2018).
Google Scholar
Cornuault J. K., et al. Враг изнутри: профаг Roseburia Кишечник систематически превращается в литический в кишечнике мыши, стимулируя бактериальную адаптацию за счет приобретения спейсера CRISPR. ISME J . https://doi.org/10.1038/s41396-019-0566-x (2019).
PubMed Google Scholar
Oh, J. H. et al. Профаги в Lactobacillus reuteri связаны с компромиссом в пригодности, но могут повысить конкурентоспособность кишечной экосистемы. заявл. Environ. Microbiol. 86 , e01922–19 (2019). pii.
PubMed PubMed Central Google Scholar

Эдвардс, Р. А., Макнейр, К., Фауст, К., Раес, Дж. И Дутиль, Б. Е. Вычислительные подходы для прогнозирования взаимоотношений между бактериофагом и хозяином. FEMS Microbiol. Ред. 40 , 258–272 (2016).
CAS PubMed Google Scholar
Stern, A., Mick, E., Tirosh, I., Sagy, O. & Sorek, R. Нацеливание на CRISPR обнаруживает резервуар общих фагов, связанных с микробиомом кишечника человека. Genome Res 22 , 1985–1994 (2012).
CAS PubMed PubMed Central Google Scholar
Paez-Espino, D. et al. Открытие вирома Земли. Природа 536 , 425–430 (2016).
CAS PubMed Google Scholar
Галиес, К., Зиберт, М., Эно, Ф., Винсент, Дж. И Содинг, Дж. Виш: кто хозяин? Прогнозирование прокариотических хозяев из метагеномных фаговых контигов. Биоинформатика 33 , 3113–3114 (2017).
Биоинформатика 33 , 3113–3114 (2017).
CAS PubMed PubMed Central Google Scholar
Moreno-Gallego, J. L. et al. Разнообразие вирома коррелирует с разнообразием кишечного микробиома у взрослых монозиготных близнецов. Cell Host Microbe 25 , 261–272 e265 (2019).
CAS PubMed PubMed Central Google Scholar
Guerin, E. et al. Биология и таксономия crAss-подобных бактериофагов, самого распространенного вируса в кишечнике человека. Cell Host Microbe 24 , 653–664 e656 (2018).
CAS PubMed Google Scholar
Шкопоров А.Н. и др. PhiCrAss001 представляет собой наиболее многочисленное семейство бактериофагов в кишечнике человека и инфицирует Bacteroides Кишечник . Nat. Commun. 9 , 4781 (2018).
PubMed PubMed Central Google Scholar

Devoto, A. E. et al. Мегафаги заражают Prevotella, и их разновидности широко распространены в микробиомах кишечника. Nat. Microbiol. 4 , 693–700 (2019).
CAS PubMed PubMed Central Google Scholar
Forterre, P., Soler, N., Krupovic, M., Marguet, E. & Ackermann, H. W.Поддельные вирусные частицы, полученные с помощью флуоресцентной микроскопии. Trends Microbiol. 21 , 1–5 (2013).
CAS PubMed Google Scholar
Чакериан Б. Вирусоподобные частицы: гибкие платформы для разработки вакцин. Expert Rev. Vaccines 6 , 381–390 (2007).
CAS PubMed Google Scholar
Кобиан Гуэмес, А.G. et al. Вирусы как победители в игре жизни. Annu. Rev. Virol. 3 , 197–214 (2016).
CAS PubMed Google Scholar

Hoyles, L. et al. Характеристика вирусоподобных частиц, связанных с микробиотой фекалий и слепой кишки человека. Res. Microbiol. 165 , 803–812 (2014).
CAS PubMed Google Scholar
Ким, М. С., Парк, Э. Дж., Ро, С. В. и Бэ, Дж. У. Разнообразие и количество вирусов одноцепочечной ДНК в человеческих фекалиях. заявл. Environ. Microbiol. 77 , 8062–8070 (2011).
CAS PubMed PubMed Central Google Scholar
Sender, R., Fuchs, S. & Milo, R. Пересмотренные оценки количества человеческих и бактериальных клеток в организме. PLoS Biol. 14 , e1002533 (2016).
PubMed PubMed Central Google Scholar
Берг Х. и Перселл Э. М. Физика хеморецепции. Biophys. J. 20 , 193–219 (1977).
CAS PubMed PubMed Central Google Scholar

Barr, J. J. et al. Бактериофаг, прилипший к слизи, обеспечивает иммунитет, не связанный с хозяином. Proc. Natl Acad. Sci.США 110 , 10771–10776 (2013).
CAS PubMed Google Scholar
Фрейзер, Дж. С., Ю, З., Максвелл, К. Л. и Дэвидсон, А. Р. Ig-подобные домены на бактериофагах: рассказ о беспорядочных половых связях и обмане. J. Mol. Биол. 359 , 496–507 (2006).
CAS PubMed Google Scholar
Lepage, P. et al. Дисбактериоз при воспалительном заболевании кишечника: роль бактериофагов? Кишечник 57 , 424–425 (2008).
CAS PubMed Google Scholar
Hsu, B. B. et al. Динамическая модуляция кишечной микробиоты и метаболома бактериофагами на мышиной модели. Cell Host Microbe 25 , 803–814 e805 (2019).
PubMed PubMed Central Google Scholar

De Paepe, M. et al. Носительство латентного вируса лямбда дорого обходится его бактериальному хозяину из-за частой реактивации в моноксенном кишечнике мыши. PLoS Genet. 12 , e1005861 (2016).
PubMed PubMed Central Google Scholar
Weiss, M. et al. Репликация in vivo бактериофагов Т4 и Т7 у стерильных мышей, колонизированных Escherichia coli . Вирусология 393 , 16–23 (2009).
CAS PubMed Google Scholar
Чжан, Х.и другие. Хинолоновые антибиотики вызывают бактериофаги, кодирующие токсин Шига, выработку токсинов и гибель мышей. J. Infect. Дис. 181 , 664–670 (2000).
CAS PubMed Google Scholar
Нанда, А. М., Торманн, К. и Фрунцке, Дж. Влияние спонтанной индукции профага на приспособленность бактериальных популяций и взаимодействия хозяина и микроба. J. Bacteriol. 197 , 410–419 (2015).
J. Bacteriol. 197 , 410–419 (2015).
PubMed PubMed Central Google Scholar
Oh, J. H. et al. Диетическая фруктоза и короткоцепочечные жирные кислоты, полученные из микробиоты, способствуют выработке бактериофагов в кишечном симбионте Lactobacillus reuteri . Cell Host Microbe 25 , 273–284 e276 (2019).
CAS PubMed Google Scholar
Сэмюэлс, А.Н., Рогиани, М., Чжу, Дж., Гулиан, М. и Коли, Р. М. SOS-ответ опосредует устойчивую колонизацию кишечника млекопитающих. Заражение. Иммун. 87 , e00711 – e00718 (2019).
CAS PubMed PubMed Central Google Scholar
Jubelin G., et al. Модуляция энтерогеморрагической Escherichia coli выживаемости и вирулентности в желудочно-кишечном тракте человека. Микроорганизмы 6 , pii: E115 (2018).
Эрнандес, С. Б., Кота, И., Дюкре, А., Аусель, Л. и Касадесус, Дж. Адаптация и преадаптация Salmonella enterica к желчи. PLoS Genet. 8 , e1002459 (2012).
CAS PubMed PubMed Central Google Scholar
Diard, M. et al. Воспаление способствует передаче бактериофагов между Salmonella spp. Наука 355 , 1211–1215 (2017).
CAS PubMed Google Scholar
Rossmann, F. S. et al. Фаго-опосредованное распространение биопленки и распространение генов вирулентности бактерий индуцируется зондированием кворума. PLoS Pathog. 11 , e1004653 (2015).
CAS PubMed PubMed Central Google Scholar
Silpe, J.E. & Bassler, B.L. Рецепторы LuxR-типа, кодируемые фагом, реагирующие на продуцируемые хозяином аутоиндукторы, воспринимающие кворум бактерий. MBio 10 , e00638–19 (2019).
MBio 10 , e00638–19 (2019).
CAS PubMed PubMed Central Google Scholar
Тейлор, В. Л., Фицпатрик, А. Д., Ислам, З. и Максвелл, К. Л. Различное влияние фагов-дебилов на приспособленность бактерий и вирулентность. Adv. Virus Res. 103 , 1–31 (2018).
PubMed Google Scholar
Валь, А., Баттести, А. и Ансальди, М. Профаги в Salmonella enterica : движущая сила в изменении генома и физиологии их бактериального хозяина? Мол. Microbiol. 111 , 303–316 (2019).
CAS PubMed Google Scholar
Rolain, J. M., Fancello, L., Desnues, C. & Raoult, D. Бактериофаги как носители резистома при муковисцидозе. J. Antimicrob. Chemother. 66 , 2444–2447 (2011).
CAS PubMed Google Scholar

Fancello, L., Desnues, C., Raoult, D. & Rolain, J. M. Бактериофаги и распространение генов, кодирующих устойчивость к противомикробным препаратам в микробиоте мокроты при муковисцидозе. J. Antimicrob. Chemother. 66 , 2448–2454 (2011).
CAS PubMed Google Scholar
Деброас Д. и Сигуре К.Вирусы как ключевые резервуары генов устойчивости к антибиотикам в окружающей среде. ISME J. 13, 2856–2867 2019.
Калеро-Касерес, В., Йе, М. и Балказар, Дж. Л. Бактериофаги как экологические резервуары устойчивости к антибиотикам. Trends Microbiol. 27 , 570–577 (2019).
CAS PubMed Google Scholar
Моди, С. Р., Ли, Х. Х., Спина, К. С. и Коллинз, Дж.J. Лечение антибиотиками расширяет резервуар устойчивости и экологическую сеть метагенома фага. Природа 499 , 219–222 (2013).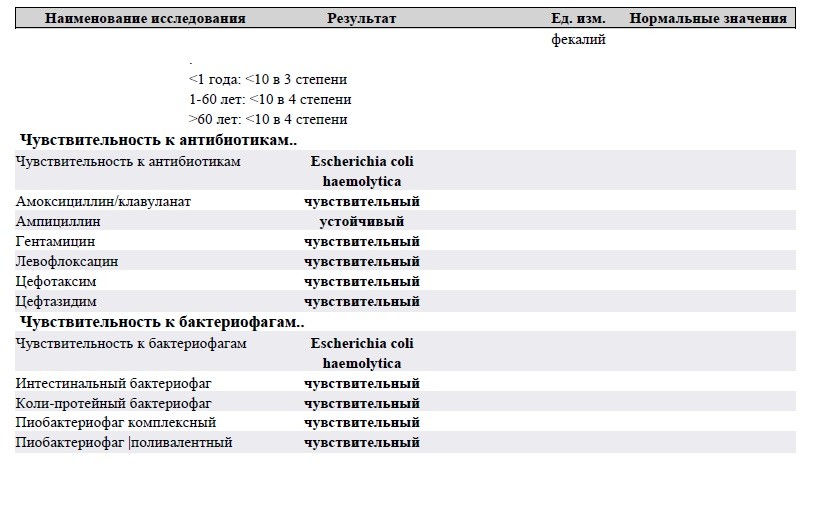
CAS PubMed PubMed Central Google Scholar
Enault, F. et al. Фаги редко кодируют гены устойчивости к антибиотикам: предостережение для анализов на виром. ISME J. 11 , 237–247 (2017).
CAS PubMed Google Scholar
Дэвис, Дж. И Дэвис, Д. Истоки и эволюция устойчивости к антибиотикам. Microbiol. Мол. Биол. Ред. 74 , 417–433 (2010).
CAS PubMed PubMed Central Google Scholar
Ли Б. А. Сотрудничество между конфликтами: профаги защищают бактерии от фагоцитоза. Cell Host Microbe 26 , 450–452 (2019).
CAS PubMed Google Scholar
Feiner, R. et al. Новый взгляд на лизогению: профаги как активные регуляторные переключатели бактерий. Nat. Rev. Microbiol. 13 , 641–650 (2015).
Microbiol. 13 , 641–650 (2015).
CAS PubMed Google Scholar
Рабинович, Л., Сигал, Н., Боровок, И., Нир-Паз, Р. и Херсковиц, А. А. Удаление профага активирует генов компетенции Listeria , которые способствуют ускользанию от фагосом и вирулентности. Cell 150 , 792–802 (2012).
CAS PubMed Google Scholar
Bille, E. et al. Связанный с вирулентностью нитчатый бактериофаг Neisseria meningitidis увеличивает колонизацию клеток-хозяев. PLoS Pathog. 13 , e1006495 (2017).
PubMed PubMed Central Google Scholar
Обенг, Н., Пратама, А. и Эльзас, Дж. Д. В. Значение мутуалистических фагов для экологии и эволюции бактерий. Trends Microbiol. 24 , 440–449 (2016).
CAS PubMed Google Scholar

Duerkop, B. A., Clements, C. V., Rollins, D., Rodrigues, J. L. & Hooper, L. V. Составной бактериофаг изменяет колонизацию кишечной комменсальной бактерией. Proc. Natl Acad. Sci. США 109 , 17621–17626 (2012).
CAS PubMed Google Scholar
Frazao, N., Sousa, A., Lassig, M. & Gordo, I. Горизонтальный перенос генов отменяет мутацию в Escherichia coli , колонизирующую кишечник млекопитающих. Proc. Natl Acad. Sci. США 116 , 17906–17915 (2019).
CAS PubMed Google Scholar
Sekse, C., Solheim, H., Urdahl, A. M. и Wasteson, Y. Является ли отсутствие восприимчивых реципиентов в кишечной среде ограничивающим фактором для трансдукции фагов, кодирующих токсин Shiga? Дж.Прил. Microbiol. 105 , 1114–1120 (2008).
CAS PubMed Google Scholar
Zhao, S. et al. Адаптивная эволюция микробиомов кишечника здоровых людей. Cell Host Microbe 25 , 656–667 e658 (2019).
CAS PubMed Google Scholar
Chibani-Chennoufi, S. et al. Бактериолитическая активность in vitro и in vivo фагов Escherichia coli : значение для фаговой терапии. Антимикробный. Агенты Chemother. 48 , 2558–2569 (2004).
CAS PubMed PubMed Central Google Scholar
Маура, Д. и Дебарбье, Л. О взаимодействиях между вирулентными бактериофагами и бактериями в кишечнике. Бактериофаг 2 , 229–233 (2012).
PubMed PubMed Central Google Scholar
Де Сорди, Л., Ханна, В. и Дебарбье, Л. Микробиота кишечника способствует изменению генетического разнообразия и инфекционности бактериальных вирусов. Cell Host Microbe 22 , 801–808 e803 (2017).
PubMed Google Scholar
Gabig, M. et al. Белок клеточной поверхности Ag43 способствует фаговой инфекции Escherichia coli в присутствии солей желчных кислот и углеводов. Microbiology 148 (Pt 5), 1533–1542 (2002).
CAS PubMed Google Scholar
Maura, D., Galtier, M., Le Bouguenec, C. & Debarbieux, L. Вирулентные бактериофаги могут нацеливаться на энтероагрегант O104: h5 Escherichia coli в кишечнике мыши. Антимикробный. Агенты Chemother. 56 , 6235–6242 (2012).
CAS PubMed PubMed Central Google Scholar
Лоренко, М., Де Сорди, Л. и Дебарбье, Л. Разнообразие образа жизни бактерий препятствует устойчивости бактериофагов. Вирусы 10 , E327 (2018).
PubMed Google Scholar
Брюссоу, Х. Взаимодействие бактериофага и хозяина: от великолепной изоляции к беспорядочной реальности. Curr. Opin. Microbiol. 16 , 500–506 (2013).
CAS PubMed Google Scholar
Seed, K. D. et al. Эволюционные последствия хищничества фагов внутри пациента для микробных популяций. Элиф 3 , e03497 (2014).
PubMed PubMed Central Google Scholar
Рейес, А., Ву, М., МакНалти, Н. П., Ровер, Ф. Л. и Гордон, Дж. И. Гнотобиотическая мышиная модель динамики фаго-бактериального хозяина в кишечнике человека. Proc. Natl Acad. Sci. США 110 , 20236–20241 (2013).
CAS PubMed Google Scholar
Miedzybrodzki, R. et al. Клинические аспекты фаговой терапии. Adv. Virus Res. 83 , 73–121 (2012).
CAS PubMed Google Scholar

Саркер, С.А. и Брюссоу, Х. От скамейки к постели и обратно: фаготерапия у детей Escherichia coli диарея. Ann.Акад. Sci. 1372 , стр. 42–52 (2016).
PubMed Google Scholar
Sarker, S.A. et al. Пероральная фаговая терапия острой бактериальной диареи двумя препаратами колифага: рандомизированное испытание на детях из Бангладеш. EBioMedicine 4 , 124–137 (2016).
PubMed PubMed Central Google Scholar
Отт, С.J. et al. Эффективность переноса стерильного фекального фильтрата для лечения пациентов с инфекцией Clostridium difficile . Гастроэнтерология 152 , 799–811 e797 (2017).
PubMed Google Scholar
Jahn, M. T. et al. Белок фага помогает бактериальным симбионтам уклоняться от иммунитета эукариот. Cell Host Microbe 26 , 542–550 e545 (2019).
CAS PubMed Google Scholar
Tetz, G.V. et al. Бактериофаги как потенциальные новые патогены млекопитающих. Sci. Отчет 7 , 7043 (2017).
PubMed PubMed Central Google Scholar
Galtier, M. et al. Бактериофаги уменьшают перенос в кишечнике устойчивых к антибиотикам уропатогенов с низким влиянием на состав микробиоты. Environ. Microbiol. 18 , 2237–2245 (2016).
CAS PubMed Google Scholar
Диссанаяке, У., Уханова, М., Мойе, З. Д., Сулаквелидзе, А., Май, В. Бактериофаги снижают количество патогенных Escherichia coli у мышей без искажения микробиоты кишечника. Фронт. Microbiol. 10 , 1984 (2019).
PubMed PubMed Central Google Scholar
Febvre, H. P. et al. Исследование PHAGE: влияние дополнительного приема бактериофагов на воспаление и микробиоту кишечника у здоровых взрослых. Питательные вещества 11 , E666 (2019).
P. et al. Исследование PHAGE: влияние дополнительного приема бактериофагов на воспаление и микробиоту кишечника у здоровых взрослых. Питательные вещества 11 , E666 (2019).
PubMed Google Scholar
Sarker, S.A. et al. Пероральное применение бактериофага Escherichia coli : тесты на безопасность у здоровых и страдающих диареей детей из Бангладеш. Environ. Микробиол . 19 , 237–250 (2017).
CAS PubMed Google Scholar
Чан, Б.K. et al. Отбор фагов восстанавливает чувствительность к антибиотикам у MDR Pseudomonas aeruginosa . Sci. Отчет 6 , 26717 (2016).
CAS PubMed PubMed Central Google Scholar
Chatterjee, A. et al. Устойчивость к бактериофагам изменяет опосредованное антибиотиками расширение кишечника Enterococci . Заражение. Иммун. 87 , e00085–19 (2019).
Заражение. Иммун. 87 , e00085–19 (2019).
CAS PubMed PubMed Central Google Scholar
Lossouarn, J. et al. Enterococcus faecalis противодействует поражению вирулентным бактериофагом Picovirinae. Вирусы 11 , E48 (2019).
PubMed Google Scholar
Rigottier-Gois, L. et al. Поверхностный рамнополисахарид epa Enterococcus faecalis является ключевым фактором колонизации кишечника. J. Infect. Дис. 211 , 62–71 (2015).
CAS PubMed Google Scholar
Кортрайт, К. Э., Чан, Б. К., Кофф, Дж. Л. и Тернер, П. Е. Фаговая терапия: обновленный подход к борьбе с устойчивыми к антибиотикам бактериями. Cell Host Microbe 25 , 219–232 (2019).
CAS PubMed Google Scholar
Голомидова, А., Куликов, Е., Исаева, А., Маныкин, А., Летаров, А. Разнообразие колифагов и колиформ в фекалиях лошади выявляет сложную картину экологических взаимодействий. Appl Environ. Microbiol. 73 , 5975–5981 (2007).
CAS PubMed PubMed Central Google Scholar
Rodriguez-Valera, F. et al. Объяснение геномики микробной популяции через хищничество фагов. Nat. Rev. Microbiol. 7 , 828–836 (2009).
CAS PubMed Google Scholar
Le Chatelier, E.и другие. Богатство микробиома кишечника человека коррелирует с метаболическими маркерами. Природа 500 , 541–546 (2013).
PubMed Google Scholar
Торрес-Барсело, С. Несопоставимые эффекты бактериофагов на устойчивые к антибиотикам бактерии. Emerg. Микробы заражают. 7 , 168 (2018).
PubMed PubMed Central Google Scholar
Norman, J. M. et al. Специфические изменения кишечного вирома при воспалительном заболевании кишечника. Cell 160 , 447–460 (2015).
CAS PubMed PubMed Central Google Scholar
Majewska, J. et al. Пероральное применение фага Т4 вызывает слабую продукцию антител в кишечнике и в крови. Вирусы 7 , 4783–4799 (2015).
CAS PubMed PubMed Central Google Scholar
Nguyen S., et al. Трансцитоз бактериофага обеспечивает механизм пересечения слоев эпителиальных клеток. MBio 2017 8 , e01874–17 (2017).
Barfoot, R. et al. Некоторые свойства дендритных макрофагов из периферической лимфы. Иммунология 68 , 233–239 (1989).
CAS PubMed PubMed Central Google Scholar
Венгер, С. Л., Тернер, Дж.Х. и Петриччиани, Дж. С. Цитогенетические, пролиферативные и жизнеспособные эффекты четырех бактериофагов на лимфоциты человека. Vitro 14 , 543–549 (1978).
CAS Google Scholar
Ароноу Р., Данон Д., Шахар А. и Аронсон М. Электронная микроскопия эндоцитоза фага Т2 in vitro клетками перитонеального экссудата кролика. J. Exp. Med. 120 , 943–954 (1964).
CAS PubMed PubMed Central Google Scholar
Мабботт, Н.А., Дональдсон, Д.С., Оно, Х., Уильямс, И.Р. и Махаджан, А. Клетки с микроскладкой (М): важные посты иммунного надзора в кишечном эпителии. Mucosal Immunol. 6 , 666–677 (2013).
CAS PubMed PubMed Central Google Scholar
Yang, J. Y. et al. Кишечные вирусы уменьшают воспаление кишечника за счет продукции интерферона-бета, опосредованной Toll-подобным рецептором 3 и Toll-подобным рецептором 7. Иммунитет 44 , 889–900 (2016).
CAS PubMed Google Scholar
Van Belleghem, JD, Clement, F., Merabishvili, M., Lavigne, R. & Vaneechoutte, M. Про- и противовоспалительные реакции мононуклеарных клеток периферической крови, индуцированные Staphylococcus aureus и Фаги Pseudomonas aeruginosa . Sci. Отчет 7 , 8004 (2017).
PubMed PubMed Central Google Scholar
Sweere, J. M. et al. Бактериофаг запускает противовирусный иммунитет и препятствует избавлению от бактериальной инфекции. Наука 363 , eaat9691 (2019).
CAS PubMed PubMed Central Google Scholar
Брюссоу, Х. Препятствия для того, чтобы фаготерапия стала реальностью — редакторский комментарий. Вирусы 11 , E557 (2019).
PubMed Google Scholar
Zheng, Q., Chen, Q., Xu, Y., Suttle, C. A. & Jiao, N. Вирус, инфицирующий морские фотогетеротрофные Alphaproteobacteria ( Citromicrobium spp.), Определяет новую линию вирусов оцДНК. Фронт. Microbiol. 9 , 1418 (2018).
PubMed PubMed Central Google Scholar
Характеристика четырех вирулентных бактериофагов Klebsiella pneumoniae и оценка их потенциального использования в комплексных препаратах фагов | Virology Journal
Изоляты бактерий
Клинические штаммы Klebsiella pneumoniae были получены из коллекции «МикроМир».Все штаммы исследовали на масс-спектрометре MALDI-TOF Microflex (Bruker, США) и с помощью биохимических тестов (MIKROLATEST, Erba Mannheim) с последующим анализом на спектрофотометре Multiskan Ascent (Thermo Scientific, США) перед их добавлением в коллекцию. Штаммы были получены из:
Клинические изоляты из Тулы; Серпухов; Москва; Пущино; город Уфа;
Научный центр акушерства, гинекологии и перинатологии имени М.В. Кулакова;
Московский городской научно-исследовательский институт скорой медицинской помощи имени Н.В. Склифосовский;
Клиническая больница №83 ФМБА, г. Москва;
Городская клиническая больница №67 в Москве.
Штаммы являются клиническими и были получены от многих пациентов в течение нескольких лет, что позволяет говорить об актуальности коллекции и ее соответствии текущему спектру циркулирующих штаммов.Более подробная информация о характеристиках бактериальных штаммов, включая результаты MALDI-TOF и MIKROLATEST, включена в Дополнительный файл 1.
Для выделения и получения бактериофагов и проведения экспериментов использовали четыре штамма: Kl 327, Kl 325, Kl 315. и Kl 263. Эти штаммы используются в лаборатории как наиболее удобные для производства и наиболее чувствительные к бактериофагам. Для каждого бактериофага использовали отдельный штамм: Kl 327 для vB_KpnS_FZ10, Kl 325 для vB_KpnS_FZ41, Kl 315 для vB_KpnP_FZ12 и Kl 263 для vB_KpnM_FZ14.
Выделение фагов
Klebsiella фагов vB_KpnS_FZ10, vB_KpnP_FZ12, vB_KpnM_FZ14 и vB_KpnS_FZ41 были изолированы в 4-х отдельных обогатительных фабриках из канализационного района, расположенного недалеко от станции очистки сточных вод Чеховской больницы №5 в районе Московской больницы. Процесс выделения начался с добавления натрий-фосфатного буфера (pH 7,0) к образцу до конечной концентрации 0,05 M, и NaCl был добавлен до конечной концентрации 1 M. Смесь инкубировали на экологическом шейкере-инкубаторе ES- 20/60 (Biosan, Латвия) в течение 60 мин при + 37 ° C и 100 об / мин.Затем отбирали супернатант и центрифугировали (6800 g, 20 мин) на центрифуге Avanti J-E с ротором JA 14,50 (Beckman Coulter, США). Затем супернатант центрифугировали в течение 2 ч при 96 200 g в ультрацентрифуге Optima L-90 K (Beckman Coulter, США) с ротором SW28. Супернатант удаляли и осадок растворяли в 1 мл 0,1 М трис-HCl буфера (pH 7,0). Полученную суспензию затем фильтровали через фильтры 1,2 мкм, 0,45 мкм и 0,22 мкм (MF-Millipore, США). Полученный фильтрат хранили при 4 ° C.
Амплификация и очистка бактериофага
Смешивали 800 мл бульона Brain Heart Infusion (BHI) и 10 мл ночной культуры клеток Klebsiella pneumoniae . В каждой встряхиваемой колбе были представлены клетки определенного штамма Klebsiella pneumoniae (Kl 327, Kl 325, Kl 315 и Kl 263). Смесь инкубировали на экологическом шейкере-инкубаторе ES-20/60 (Biosan, Латвия) в течение 2 ч при + 37 ° C и 100 об / мин. Затем в колбы добавляли 1 мл фильтрата бактериофага и инкубировали в течение ночи.Утром наблюдали лизис бактериальной культуры. Содержимое колб подвергали дифференциальному центрифугированию, а затем полученный результат фильтровали, как описано выше. Фильтраты хранили при 4 ° C в холодильнике.
Анализы бактериофаговых бляшек
Готовили суспензию клеток Klebsiella pneumoniae в физиологическом солевом растворе. Концентрация клеток в суспензии составляет приблизительно 10 9 КОЕ / мл (колониеобразующих единиц на мл).Затем готовили серийные разведения (от 10 –1 до 10 –10 ) каждого из четырех полученных фильтратов бактериофагами в физиологическом солевом растворе. 0,2 мл культуры и 0,1 мл специфического разведения бактериофага добавляли в пробирки с мягким агаром (0,6%), перемешивали. Полученную смесь распределяли по чашкам Петри с твердым агаром. Инкубировали 24 ч при температуре + 37 ° С в термостате (Binder GmbH, Германия). После инкубационного периода оценивали полученные бляшки.
Приготовление «чистых линий» бактериофагов и оценка морфологии бляшек
Одиночные бляшки с фрагментами агара, полученными для каждого из четырех фильтратов, вырезали из мягкого агара и помещали в разные пробирки с 1 мл физиологического раствора соли. Их инкубировали 10 мин при комнатной температуре. Затем брали экстракты и повторяли этапы анализа амплификации / бляшек (было сделано 3 повтора). Полученные фильтраты хранили при 4 ° C в холодильнике.После анализа бляшек, описанного выше, оценивали морфологию бляшек.
Определение диапазона фага-хозяина
Для оценки литического спектра накопленного бактериофага использовали двухслойный метод. В качестве тест-культуры использовали 14 штаммов Klebsiella pneumoniae . Готовили суспензию клеток Klebsiella pneumoniae в физиологическом солевом растворе. Концентрация клеток в суспензии составляет примерно 10 9 КОЕ / мл.0,2 мл культуры добавляли в пробирки с мягким агаром (0,6%), перемешивали, выливали в чашку Петри с агаром и давали затвердеть. Затем на мягкий агар наносили суспензию фага в нескольких разведениях. Чашки Петри инкубировали 24 ч при + 37 ° C в термостате (Binder GmbH, Германия). После инкубации оценивали наличие пятен лизиса. Чтобы убедиться, что образование пятен лизиса было вызвано литическим действием фага, были выполнены анализы бактериофаговых бляшек, как описано выше . Кроме того, был проведен анализ пятен лизиса на электронном микроскопе JEM-1011 (JEOL, Япония). Для этого из пятна лизиса брали фрагмент чашки с агаром и помещали в каплю 0,1 мл физиологического раствора. Инкубируют 25–30 мин. После этого пластину с агаром удаляли и проводили электронную микроскопию капли. Оценивали наличие бактериофагов в исследуемом материале.
Центрифугирование в градиенте CsCl
Готовили растворы с различным процентным содержанием CsCl (50, 30, 20, 10, 5).В качестве растворителя использовали 0,05 М трис-HCl буфер (pH 7,0). После этого растворы осторожно добавляли в центрифужную пробирку из ротора SW 28, наслаивая градиент от более высокой концентрации к более низкой с помощью пипетки Пастера. Последним добавляли фильтрат бактериофага. На каждом этапе контролировали фазовую однородность, предотвращая их перемешивание. Пробирки уравновешивали 5% -ным раствором CsCl и помещали в ультрацентрифугу Optima L-90 K (Beckman Coulter, США). Затем центрифугировали 2 ч при 96 200 g.После центрифугирования содержимое зоны с фагом осторожно отбирали в пробирки Эппендорфа с помощью пипетки. Затем содержимое пробирок центрифугировали в течение 2 ч при 96 200 g на центрифуге Optima L-90 K (Beckman Coulter, США) с ротором SW 28. Осадок ресуспендировали в 0,05 М трис-HCl буфере (pH 7,0). Полученную суспензию фага хранили при 4 ° C в холодильнике.
Электронная микроскопия
Электронную микроскопию проводили с использованием фильтрата бактериофагов с высоким титром, очищенных в градиенте плотности CsCl.Образцы наносили на нитроцеллюлозные пленки с углеродным покрытием, окрашивали 1% уранилацетатом и исследовали в просвечивающем электронном микроскопе (ПЭМ) JEM-1011 (JEOL, Япония). Электронные микрофотографии сделаны камерой Erlangshen ES500W (Gatan, США). Параметры бактериофагов измеряли с помощью программы ImageJ на основе изображений, полученных с помощью электронной микроскопии. В качестве маркеров использовали стандарты, основанные на измерениях длины хвоста (114 нм) бактериофага Т4. Для каждого фага измеряли 35 частиц и рассчитывали SD (стандартное отклонение).
Оценка частоты образования фагорезистентных форм
Клетки из ночной культуры суспендировали в физиологическом солевом растворе до 10 8 КОЕ / мл, 0,1 мл культуры и 0,1 мл фильтрата фага, первоначально содержащего 10 8 БОЕ / мл (бляшкообразующих единиц на мл) добавляли в пробирки с мягким агаром (0,6%) и перемешивали. Полученную смесь распределяли по чашкам Петри с твердым агаром. Инкубировали 24 ч при температуре + 37 ° С в термостате (Binder GmbH, Германия).После этого оценивали количество устойчивых колоний и рассчитывали частоту образования фагорезистентных форм. Полученные устойчивые колонии помещали в пробирки с 10 мл бульона BHI и перемешивали. Полученные суспензии инкубировали 2 ч при 37 ° C в термостате (Binder GmbH, Германия). Затем в пробирки добавляли митомицин С до конечных концентраций 0,2 мкг / мл, 0,5 мкг / мл и 2 мкг / мл и инкубировали в течение 24 ч при + 37 ° C в термостате (Binder GmbH, Германия).Затем суспензии центрифугировали (6800 g, 20 мин) на центрифуге Avanti JE с ротором JA 14.50 (Beckman Coulter, США), супернатанты отбирали в чистые пробирки, центрифугировали 2 ч при 96 200 g на Optima L-90 K. ультрацентрифуга (Beckman Coulter, США) с ротором SW28, и образец анализировали на электронном микроскопе на наличие фага в суспензии. Кроме того, исходную суспензию устойчивых колоний обрабатывали хлороформом, затем центрифугировали (6800 g, 20 мин) на центрифуге Avanti J-E с JA 14.50 (Beckman Coulter, США) и супернатанты были нанесены на чувствительные к фагу газоны Klebsiella pneumoniae .
Чувствительность фаговых частиц к температуре и pH
В анализе чувствительности к температуре и pH методы, используемые Jamal et al. были применены [41]. Фильтрат бактериофага инкубировали в течение 1 ч в пробирках на водяной бане (GFL, Германия) при температурах 37, 50, 55, 60, 65 и 70 ° C. Затем были приготовлены серийные разведения фильтрата бактериофага от 10 –2 до 10 –10 с шагом 10 2 .Титр фага получали с помощью анализа бляшек, как описано выше. Для изучения чувствительности к pH были приготовлены пробирки с мясопептонным бульоном (MPB) (исходный pH 7,2) со значениями pH от 3 до 13. Для получения желаемых значений pH использовали 6 M растворы NaOH и HCl. MPB фильтровали через фильтры с диаметром пор 0,22 мкм (MF-Millipore, США). В пробирки добавляли по 1 мл фага с каждым значением pH и инкубировали 18 ч при + 37 ° C в инкубаторе (Binder GmbH, Германия). За pH следили после инкубационного периода.Такой же период инкубации для анализа чувствительности к pH использовали Сулеймани Сасани и Эфтехар [42]. Затем были приготовлены серийные разведения раствора с фагами от 10 –1 до 10 –10 и проведен анализ бляшек, как описано выше, для получения титра фага.
Скорость адсорбции фага
Клетки из ночной культуры суспендировали в бульоне BHI до 10 9 КОЕ / мл. 5 мл бактериальной суспензии и суспензии фага, разведенных до 10 7 БОЕ / мл, инкубировали в 45 мл бульона BHI на экологическом шейкере-инкубаторе ES-20/60 (Biosan, Латвия) при + 37 ° C и 100 об / мин в течение 5 дней. мин.После этого супернатант фильтровали через фильтр с размером пор 0,22 мкм и подсчитывали количество свободных фагов, используя анализ бляшек, описанный выше. Снижение титра фага представляло собой количество фагов, адсорбированных на клетках. Фильтрат бактериофага использовали в качестве контроля. Снижения титра в контроле не наблюдалось. Константа адсорбции рассчитывалась по следующей формуле:
$$ k = \ left ({\ frac {- 1} {{Bt}}} \ right) \ times \ ln \ left ({\ frac {P} {{ P_ {0}}}} \ right) $$
P — концентрация свободного фага на мл, P 0 — исходная концентрация фага, B — исходная концентрация бактерий, k — константа скорости адсорбции (мл / мин) , t — время (мин).
Одностадийная кривая роста
Смешивали 1 мл бульона BHI, суспензию клеток с конечной концентрацией 10 9 КОЕ / мл и фильтрат бактериофага с конечной концентрацией 10 7 БОЕ / мл. Смесь инкубировали при 37 ° C в течение 8 мин в термостате (Binder GmbH, Германия), а затем центрифугировали 2 мин при 4800 g на Centrifuge 5424 (Eppendorf, Германия). Супернатант удаляли и осадок ресуспендировали в 100 мл бульона BHI. Аликвоты 0,5 мл полученной суспензии отбирали каждые 5 мин в течение 80 мин, и титр бактериофага оценивали с помощью анализа бляшек, описанного выше.Латентный период определяли как интервал между адсорбцией фага на клетке-хозяине и высвобождением потомства фага. Размер взрыва фага выражали как отношение окончательного количества высвобожденных фаговых частиц к количеству инфицированных бактериальных клеток в течение латентного периода.
Размножение фага в жидкой питательной среде и оценка титра бактериофага
Клетки из ночной культуры суспендировали в бульоне BHI до 10 9 КОЕ / мл. 5 мл бактериальной суспензии, содержащей 10 9 КОЕ / мл и фаг, разведенный до 10 6 БОЕ / мл, инкубировали в 45 мл бульона BHI на экологическом шейкере-инкубаторе ES-20/60 (Biosan, Латвия) при температуре + 37 ° C. ° C и 100 об / мин в течение 18 часов.В качестве контроля одна колба не содержала фага, добавленного к культуре Klebsiella . Колбы инкубировали 18 ч при + 37 ° C и 100 об / мин. После этого титр фага в экспериментальной системе оценивали с использованием анализов бляшек, описанных выше. Инкубируют 24 ч при + 37 ° С в термостате (Binder GmbH, Германия). После инкубации оценивали титр фага.
Выделение и рестрикционное расщепление ДНК фага
Геномную ДНК фага экстрагировали из фильтрата бактериофага с высоким титром, очищали в градиенте плотности CsCl.Раствор этилендиаминтетрауксусной кислоты (ЭДТА) добавляли к 0,45 мл фильтрата бактериофага до конечной концентрации 25 мМ. Затем добавляли протеиназу К до конечной концентрации 100 мкг / мл и инкубировали при + 50 ° C в течение 2 часов. После этого добавляли додецилсульфат натрия (SDS) до концентрации 0,5% и инкубировали при + 55 ° C в течение 2 часов. Затем смесь нагревали 20 мин при + 65 ° C для инактивации ферментов. Далее была проведена двойная экстракция хлороформом. К водной фазе добавляли 0,5 мл изопропилового спирта, после чего ДНК экстрагировали на стеклянную палочку.После трехкратной промывки в 70% растворе этанола ДНК сушили в течение 5 мин на воздухе, а затем растворяли в 0,4 мл буфера ТЕ (pH 8,0). Количество и качество экстрагированной ДНК контролировали анализом на спектрофотометре NanoDrop ND-1000 (ThermoFisher, США).
ДНК фага расщепляли рестрикционными ферментами в соответствии с протоколом производителя в течение 90 мин при + 37 ° C (при + 30 ° C для SmaI) в буфере и условиях, подходящих для рестрикционного фермента (в 50 мкл реакции: 5 единиц фермента, 1 мкг ДНК и объем дистиллированной воды).Использовали следующие эндонуклеазы рестрикции: HindIII, HinfI, HaeIII, SspI, BamHI, EcoRV, NotI, EcoRI, KpnI, MspI, VspI, NdeI, BgII, BgIII, PvuI, SmaI. Для анализа результатов электрофорез проводили на 1% агарозном геле при 180–200 В в течение 1 ч при комнатной температуре на ячейке Sub-cell Model 92 (Biorad). В лунки добавляли 15–20 мкл (1-2 мкл буфера для нанесения на 5 мкл реакции). В качестве маркеров использовали лямбда-ДНК / HindIII (Thermo Scientific, США).
Визуализацию результатов проводили после окрашивания гелей агарозы в течение 20 мин в растворе бромистого этидия (1 мкг / мл).Для документирования результатов использовалась система DOCPRINT (Vilber Lourmat, Франция). Полученные профили рестрикции сравнивали с предсказанными in silico с помощью программы RestrictionMapper (restrictionmapper.org).
Секвенирование, сборка и аннотация генома
ДНК фага экстрагировали хлороформом [43]. Библиотеку ДНК конструировали с использованием набора для подготовки библиотеки ДНК Nextera (Illumina, Сан-Диего, Калифорния) и секвенировали с помощью секвенатора Illumina HiSeq T1500, что дало примерно 1 миллион считываний парных концов 2 × 250.Контроль качества и первичная обработка выполнялись с использованием FASTQC и trimmomatic (HEADCROP: 20, SLIDINGWINDOW: 3: 24, MINLEN: 200, CROP: 200) [44]. Покрытие было нормализовано до × 50 с использованием BBNorm [45]. Сборка de novo производилась с использованием ассемблера MIRA [46] версии 4.9.6. Завершение контига было подтверждено сравнением с близкородственными геномами, о которых известно, что они полные (номера доступа представлены в таблице 5). Поиск в открытых рамках считывания производился с помощью MetaProdigal 2.6 [47]. Аннотации выполнены с использованием всех рецензируемых фаговых и бактериальных белков от UniProt (https: // www.uniprot.org) и все белки из баз данных детерминант устойчивости к противомикробным препаратам и факторов вирулентности бактерий: VFDB [48], CARD [49], ARG-ANNOT [50] и Resfinder [51]. Остальные ORF были аннотированы приложением hmmscan (минимальное значение е 0,001) [52] с использованием всех бактериальных профилей HMM из базы данных Pfam (https://pfam.xfam.org). тРНК была предсказана с помощью tRNAscan-SE 2.0 [53]. Все анализы, кроме указанных, были выполнены с параметрами по умолчанию. BLASTn (https: //blast.ncbi.nlm.nih.gov/Blast.cgi) использовался для поиска сходства с другими бактериофагами, а также для расчета средней идентичности нуклеотидов и охвата запросов.
Полные геномные последовательности фагов Klebsiella pneumoniae vB_KpnS_FZ10, vB_KpnP_FZ12, vB_KpnM_FZ14 и vB_KpnS_FZ41 депонированы в GenBank под номерами доступа MK5214521906 и MK55145145 955 95545 955 945 Необработанные чтения Illumina доступны на NCBI SRA под номерами доступа SRR10037530 , SRR10037529 , SRR10037528 и SRR10037527 соответственно.Соответствующий регистрационный номер BioProject — PRJNA562287. Инструмент GenomeVx [54] использовался для полной визуализации генома. Таксономическая идентификация была произведена GenBank (https://www.ncbi.nlm.nih.gov/genbank/) на основе схемы филогенетической классификации, используемой в базе данных таксономии NCBI (https://www.ncbi.nlm.nih.gov / Таксономия).
Кишечный виром у детей с муковисцидозом отличается от здорового контроля
% PDF-1.6 % 1 0 объект > поток DOI: 10.1371 / journal.pone.0233557
Дисбиоз кишечной микробиоты при воспалительном заболевании кишечника: современные методы лечения и потенциал терапевтических подходов, регулирующих микробиоту
Нг, С., Ши, Х., Хамиди, Н., Андервуд, Ф., Танг, В., Бенчимол, Э. (2017). Заболеваемость и распространенность воспалительных заболеваний кишечника во всем мире в 21 -м годах: систематический обзор популяционных исследований. Ланцет. https://doi.org/10.1016/s0140-6736(17)32448-0
Тернбо, П., Лей, Р., Хамади, М., Фрейзер-Лиггетт, К., Найт, Р., Гордон, Дж. (2007). Проект микробиома человека. Природа. https://doi.org/10.1038/nature06244
Баума, Г., Стробер, В. (2003). Иммунологические и генетические основы воспалительного заболевания кишечника. Nat Rev Immunol. https://doi.org/10.1038/nri1132
Коварик, Дж., Тиллинджер, В., Хофер, Дж., Хольцль, М., Хайнцль, Х., Саеманн, М. (2011). Нарушение противовоспалительной эффективности н-бутирата у пациентов с ВЗК. евро J Clin Invest. https://doi.org/10.1111/j.1365-2362.2010.02407.x
Оливера, П., Данезе, С., Джей, Н., Натоли, Г., Пейрин-Бируле, Л. (2019). Большие данные в IBD: взгляд в будущее. Nat Rev Gastroenterol Hepatol. https://doi.org/10.1038/s41575-019-0102-5
Ни, Дж., Ву, Г., Альбенберг, Л., Томов, В. (2017). Микробиота кишечника и ВЗК: причинная связь или корреляция ?. Nat Rev Gastroenterol Hepatol. https://doi.org/10.1038/nrgastro.2017,88
Джонс-Холл, Ю., Накацу, К. (2016). Пересечение TNF, IBD и микробиома. Кишечные микробы. https://doi.org/10.1080/194
.2015.1121364Коззи, С., Эскарпа, А., Парра, Д., Джамал, Д., Митджана, Дж., Пиулатс, Дж. (2019). Связь между воспалительным заболеванием кишечника и увеальной меланомой: клинический случай двух молодых людей и обзор литературы. Rep Pract Oncol Radiother. https://doi.org/10.1016/j.rpor.2018.10.002
Аагаард, К., Ма, Дж., Энтони, К., Гану, Р., Петрозино, Дж., Версалович, Дж. (2014). Плацента содержит уникальный микробиом. Sci Transl Med. https://doi.org/10.1126/scitranslmed.300↗
Родригес, Дж., Мерфи, К., Стэнтон, К., Росс, Р., Кобер, О., Джуге, Н. (2015). Состав микробиоты кишечника на протяжении всей жизни с акцентом на молодость. Microb Ecol Health Dis. https://doi.org/10.3402/mehd.v26.26050
Кениг, Дж., Спор, А., Скалфон, Н., Фрикер, А., Стомбо, Дж., Найт, Р. (2011). Последовательность микробных консорциумов в развивающемся микробиоме кишечника младенца. Proc Natl Acad Sci. https://doi.org/10.1073/pnas.1000081107
Авершина, Э., Сторро, О., Эйен, Т., Йонсен, Р., Поуп, П., Руди, К. (2014). Состав и разнообразие основной фекальной микробиоты меняется с возрастом в географически ограниченной когорте матерей и их детей. FEMS Microbiol Ecol. https://doi.org/10.1111/1574-6941.12223
Aagaard, K., Riehle, K., Ma, J., Segata, N., Mistretta, T., Coarfa, C. (2012). Метагеномный подход к характеристике микробиома влагалища во время беременности. PLoS One. https://doi.org/10.1371/journal.pone.0036466
Якобссон, Х., Абрахамссон, Т., Дженмальм, М., Харрис, К., Айва, К., Джернберг, К. (2014). Снижение разнообразия кишечной микробиоты, задержка колонизации Бактероидетами и снижение ответа Th2 у младенцев, рожденных с помощью кесарева сечения. Gut. https://doi.org/10.1136/gutjnl-2012-303249
Костелло, Э., Стагаман, К., Детлефсен, Л., Боханнан, Б., Релман, Д. (2012). Применение экологической теории к пониманию микробиома человека. Наука. https://doi.org/10.1126/science.1224203
Салминен, С., Гибсон, Г., Маккартни, А., Изолаури, Э. (2004). Влияние способа доставки на состав микробиоты кишечника у детей семи лет. Gut.https://doi.org/10.1136/gut.2004.041640
Куйтунен, М., Кукконен, К., Юнтунен-Бакман, К., Корпела, Р., Пусса, Т., Тууре, Т. (2009). Пробиотики предотвращают IgE-ассоциированную аллергию до 5 лет у детей, родившихся после кесарева сечения, но не во всей когорте. J Allergy Clin Immunol. https://doi.org/10.1016/j.jaci.2008.11.019
ван Нимвеген, Ф., Пендерс, Дж., Стобберинг, Э., Постма, Д., Коппельман, Г., Керкхоф, М. (2011). Способ и место родов, микробиота желудочно-кишечного тракта и их влияние на астму и атопию. J Allergy Clin Immunol. https://doi.org/10.1016/j.jaci.2011.07.027
Бэкхед, Ф., Росвалл, Дж., Пэн, Ю., Фэн, К., Цзя, Х., Ковачева-Датчари, П. (2015). Динамика и стабилизация микробиома кишечника человека в течение первого года жизни. Клеточный микроб-хозяин. https://doi.org/10.1016/j.chom.2015.05.012
Бэкхед, Ф. (2011). Программирование метаболизма хозяина кишечной микробиотой. Ann Nutr Metab. https://doi.org/10.1159/000328042
Капорасо, Дж., Лаубер, К., Костелло, Э., Берг-Лайонс, Д., Гонсалес, А., Стомбо, Дж. (2011). Движущиеся картинки микробиома человека. Genome Biol. https://doi.org/10.1186/gb-2011-12-5-r50
Детлефсен, Л., Релман, Д. (2011). Неполное восстановление и индивидуальные ответы микробиоты дистальных отделов кишечника человека на повторяющееся воздействие антибиотиков. Proc Natl Acad Sci. https://doi.org/10.1073/pnas.1000087107
Клаэссон, М., Кьюсак, С., О’Салливан, О., Грин-Диниз, Р., де Верд, Х., Фланнери, Э. (2011). Состав, изменчивость и временная стабильность кишечной микробиоты пожилых людей. Proc Natl Acad Sci.
Бьяджи, Э., Нюлунд, Л., Кандела, М., Остан, Р., Буччи, Л., Пини, Э. (2010). Через старение и не только: кишечная микробиота и воспалительный статус у пожилых и долгожителей. PLoS One. https://doi.org/10.1371/journal.pone.0010667
Клаэссон, М., Джеффри, И., Конде, С., Пауэр, С., О’Коннор, Э., Кьюсак, С. (2012). Состав кишечной микробиоты у пожилых людей коррелирует с диетой и здоровьем. Природа.
Вудмэнси, Э., Мак-Мердо, М., Макфарлейн, Г., Макфарлейн, С. (2004). Сравнение составов и метаболической активности фекальных микробиот у молодых людей и у пожилых людей, лечившихся и не принимавших антибиотики. Appl Environ Microbiol. https://doi.org/10.1128/aem.70.10.6113-6122.2004 г.
Бьяджи, Э., Кандела, М., Туррони, С., Гарагнани, П., Франчески, К., Бриджиди, П. (2013). Старение и микробы кишечника: перспективы сохранения здоровья и долголетия. Pharmacol Res. https://doi.org/10.1016/j.phrs.2012.10.005
Бэкхед, Ф., Фрейзер, К., Рингель, Ю., Сандерс, М., Сартор, Р., Шерман, П. (2012). Определение здорового микробиома кишечника человека: современные концепции, будущие направления и клиническое применение. Клеточный микроб-хозяин.https://doi.org/10.1016/j.chom.2012.10.012
Браун, Х., Форстер, С., Анонье, Б., Кумар, Н., Невилл, Б., Старес, М. (2016). Культивирование «некультивируемой» микробиоты человека выявило новые таксоны и обширное спороношение. Природа. https://doi.org/10.1038/nature17645
Цинь, Дж., Ли, Р., Раес, Дж., Арумугам, М., Бургдорф, К., Маничань, К. (2010). Каталог кишечных микробных генов человека, созданный с помощью метагеномного секвенирования. Природа.
Гуинан, К., Тадрус, А., Фухи, Ф., Райан, К., Демпси, Э., Мерфи, Б. (2013). Микробный состав придатков человека после аппендэктомии. МБио. https://doi.org/10.1128/mbio.00366-12
Лурье-Вайнбергер, М., Гофна, У. (2015). Археи внутри и на теле человека: последствия для здоровья и направления на будущее. PLoS Pathog. https://doi.org/10.1371/journal.ppat.1004833
Хоффманн, К., Доллив, С., Грюнберг, С., Чен, Дж., Ли, Х., Ву, Г. (2013). Археи и грибы микробиома кишечника человека: корреляция с диетой и бактериальными жителями. PLoS One. https://doi.org/10.1371/journal.pone.0066019
Лагкувардос И., Оверманн Дж., Клавель Т. (2017). Культивированные микробы составляют значительную часть кишечной микробиоты человека и мыши. Кишечные микробы. https://doi.org/10.1080/194
.2017.1320468(2012). Структура, функции и разнообразие микробиома здорового человека. Природа. https://doi.org/10.1038/nature11234
Ширмер, М., Смикенс, С., Вламакис, Х., Йегер, М., Остинг, М., Франзоза, Э. (2016). Связывание микробиома кишечника человека с производительностью воспалительных цитокинов. Cell. https://doi.org/10.1016/j.cell.2016.10.020
Гилберт, Дж., Блазер, М., Капорасо, Дж., Янссон, Дж., Линч, С., Найт, Р. (2018). Современное понимание микробиома человека. Nat Med. https://doi.org/10.1038/nm.4517
Урселл, Л., Ван Треурен, В., Меткалф, Дж., Пиррунг, М., Гевиртц, А., Найт, Р. (2013). Пополнение наших защитных микробов. Bioessays. https://doi.org/10.1002/bies.201300018
Райилич-Стоянович, М., Хейлиг, Х., Тимс, С., Зетендал, Э., де Вос, В. (2012). Долгосрочный мониторинг микробиоты кишечника человека. Environ Microbiol. https://doi.org/10.1111/1462-2920.12023
Сонг, С., Лаубер, К., Костелло, Э., Лозупоне, К., Хамфри, Г., Берг-Лайонс, Д. (2013). Сожительствующие члены семьи разделяют микробиоту друг с другом и со своими собаками. Элиф. https://doi.org/10.7554/elife.00458
Дэвид, Л., Морис, К., Кармоди, Р., Гутенберг, Д., Баттон, Дж., Вулф, Б. (2014). Диета быстро и воспроизводимо изменяет микробиом кишечника человека. Природа. https://doi.org/10.1038/nature12820
Детлефсен, Л., Хусе, С., Согин, М., Релман, Д. (2008). Всестороннее воздействие антибиотика на микробиоту кишечника человека, выявленное глубоким секвенированием 16S рРНК. PLoS Biol. https://doi.org/10.1371/journal.pbio.0060280
Бидерманн, Л., Цейтц, Дж., Мвиньи, Дж., Саттер-Миндер, Э., Рехман, А., Отт, С. (2013). Отказ от курения вызывает глубокие изменения в составе кишечной микробиоты человека. PLoS One. https://doi.org/10.1371/journal.pone.0059260
Флорес, Г., Капорасо, Дж., Хенли, Дж., Райдаут, Дж., Домогала, Д., Чейз, Дж. (2014). Временная изменчивость — это индивидуальная особенность микробиома человека. Genome Biol. https://doi.org/10.1186/s13059-014-0531-y
Бирчер, Дж. (2005). К динамическому определению здоровья и болезни. Med Health Care Philos.
Дэвид, Л., Матерна, А., Фридман, Дж., Кампос-Баптиста, М., Блэкберн, М., Перротта, А. (2014). Образ жизни хозяина ежедневно влияет на микробиоту человека. Genome Biol. https://doi.org/10.1186/gb-2014-15-7-r89
Фирер, Н., Лаубер, К., Чжоу, Н., Макдональд, Д., Костелло, Э., Найт, Р. (2010). Судебно-медицинская идентификация с использованием бактериальных сообществ кожи. Proc Natl Acad Sci. https://doi.org/10.1073/pnas.1000162107
Шарара, А., Аль-Авади, С., Альхарби, О., Аль-Дахаб, Х., Мунир, М., Салез, Л. (2018). Эпидемиология, бремя болезней и проблемы лечения язвенного колита в Африке и на Ближнем Востоке. Exp Rev Gastroenterol Hepatol. https://doi.org/10.1080/17474124.2018.1503052
Селиберто, Л., Грэф, Ф., Хили, Г., Босман, Э., Якобсон, К., Слай, Л. (2018). Воспалительное заболевание кишечника и иммунное питание: новые терапевтические подходы путем изменения диеты и микробиома кишечника. Иммунология. https://doi.org/10.1111/imm.12939
Брант, С., Око, Д., Симпсон, К., Катлер, Д., Харитунианс, Т., Брэдфилд, Дж. (2017). Полногеномное ассоциативное исследование выявляет специфические для Африки локусы восприимчивости у афроамериканцев с воспалительным заболеванием кишечника. Гастроэнтерология. https://doi.org/10.1053/j.gastro.2017.02.041
Найтс, Д., Лассен, К., Ксавьер, Р. (2013). Достижения в патогенезе воспалительных заболеваний кишечника: связь генетики хозяина и микробиома. Gut. https://doi.org/10.1136/gutjnl-2012-303954
Терсби, Э., Джуге, Н. (2017). Введение в микробиоту кишечника человека. Biochem J. https://doi.org/10.1042/bcj20160510
Виллинг, Б., Диксвед, Дж., Халфварсон, Дж., Андерссон, А., Лучио, М., Чжэн, З. (2010). Исследование пиросеквенирования у близнецов показывает, что микробный профиль желудочно-кишечного тракта зависит от фенотипа воспалительного заболевания кишечника. Гастроэнтерология. https://doi.org/10.1053/j.gastro.2010.08.049
Карлссон, А., Якименко, О., Оливье, И., Хоканссон, Ф., Постма, Э., Кейта, Э. (2013). Надосадочная жидкость Faecalibacterium prausnitzii улучшает барьерную функцию кишечника у мышей с DSS-колитом. Сканд Дж Гастроэнтерол. https://doi.org/10.3109/00365521.2013.82≅
Райт, Э., Камм, М., Тео, С., Иноу, М., Вагнер, Дж., Кирквуд, К. (2015). Последние достижения в характеристике микробиома желудочно-кишечного тракта при болезни Крона: систематический обзор. Воспаление кишечника. https://doi.org/10.1097/mib.0000000000000382
Сартор, Р. (2006). Механизмы болезни: патогенез болезни Крона и язвенного колита. Nat Clin Pract Gastroenterol Hepatol.https://doi.org/10.1038/ncpgasthep0528
Сокол, Х., Пиньер, Б., Уоттерлот, Л., Лахдари, О., Бермудес-Хумаран, Л., Гратаду, Дж. (2008). Faecalibacterium prausnitzii — это противовоспалительная комменсальная бактерия, выявленная при анализе микробиоты кишечника пациентов с болезнью Крона. Proc Natl Acad Sci USA. https://doi.org/10.1073/pnas.0804812105
Франк, Д., Аманд, А., Фельдман, Р., Бёдекер, Э., Харпаз, Н., Пейс, Н. (2007). Молекулярно-филогенетическая характеристика дисбаланса микробного сообщества при воспалительных заболеваниях кишечника человека. Proc Natl Acad Sci. https://doi.org/10.1073/pnas.0706625104
Уоллес, К., Чжэн, Л., Канадзава, Ю., Ши, Д. (2014). Иммунопатология воспалительных заболеваний кишечника. World J Gastroenterol.
Фудзимото, Дж., Кадара, Х., Гарсия, М., Каббут, М., Беренс, К., Лю, Д. (2012). Экспрессия члена A семейства C, группы 5 рецепторов, сопряженных с G-белком (GPRC5A), снижена в соседнем поле и нормальном бронхиальном эпителии у пациентов с хронической обструктивной болезнью легких и немелкоклеточным раком легких. J Thorac Oncol. https://doi.org/10.1097/jto.0b013e31826bb1ff
Росси, О., Хан, М., Шварцер, М., Худкович, Т., Сруткова, Д., Дункан, С. (2015). Faecalibacterium prausnitzii штамм HTF-F и его внеклеточный полимерный матрикс снижают клинические параметры при колите, вызванном DSS. PLoS One. https://doi.org/10.1371/journal.pone.0123013
Уокер, А., Инс, Дж., Дункан, С., Вебстер, Л., Холтроп, Г., Зе, X. (2011). Доминирующие и зависимые от диеты группы бактерий в микробиоте толстой кишки человека. ISME J. https://doi.org/10.1038/ismej.2010.118
Стробер, В., Фасс, И., Маннон, П. (2007). Фундаментальные основы воспалительного заболевания кишечника. J Clin Investig. https://doi.org/10.1172/jci30587
Эйхеле, Д., Харбанда, К. (2017). Модель колита с декстрановым сульфатом натрия на мышах: незаменимый инструмент для улучшения нашего понимания патогенеза воспалительных заболеваний кишечника. World J Gastroenterol. https://doi.org/10.3748/wjg.v23.i33.6016
Де Фацио, Л., Кавацца, Э., Списни, Э., Стриллаччи, А., Чентанни, М., Кандела, М. (2014). Продольный анализ воспаления и динамики микробиоты на модели легкого хронического колита, индуцированного декстрансульфатом натрия, у мышей. World J Gastroenterol. https://doi.org/10.3748/wjg.v20.i8.2051
Гковскоу К., Делигианни К., Цацанис К., Элиопулос А. (2014). Микробиота кишечника на мышиных моделях воспалительного заболевания кишечника. Front Cell Infect Microbiol. https://doi.org/10.3389/fcimb.2014.00028
Д’Ханс, Г., Гебоэс, К., Петерс, М., Баерт, Ф., Пеннинкс, Ф., Рутгертс, П. (1998). Ранние поражения рецидивирующей болезни Крона, вызванные инфузией кишечного содержимого в исключенную подвздошную кишку. Гастроэнтерология. https://doi.org/10.1016/s0016-5085(98)70476-7
Диксвед, Дж., Шрайбер, О., Виллинг, Б., Петерссон, Дж., Ранг, С., Филлипсон, М. (2012). Lactobacillus reuteri поддерживает функциональный барьер слизистой оболочки во время лечения DSS, несмотря на дисфункцию слизистого слоя. PLoS One. https://doi.org/10.1371/journal.pone.0046399
Макилрой, Дж., Яниро, Дж., Мукхопадхья, И., Хансен, Р., Холд, Г. (2018). Микробиом кишечника при воспалительных заболеваниях кишечника — пути борьбы с микробами. Aliment Pharmacol Ther. https://doi.org/10.1111 / кв. 14384
Хансен, Р., Берри, С., Мукхопадхья, И., Томсон, Дж., Сондерс, К., Николл, К. (2013). Микроаэрофильная микробиота новообразованных педиатрических воспалительных заболеваний кишечника: исследование BISCUIT. PLoS One. https://doi.org/10.1371/journal.pone.0058825
Хансен, Р., Рассел, Р., Рейфф, К., Луис, П., Макинтош, Ф., Берри, С. (2012). Микробиота детей с ВЗК de novo: увеличение Faecalibacterium prausnitzii и снижение бактериального разнообразия при болезни Крона, но не при язвенном колите. Am J Gastroenterol. https://doi.org/10.1038/ajg.2012.335
Лопес-Силес, М., Хан, Т., Дункан, С., Хармсен, Х., Гарсия-Гил, Л., Флинт, Х. (2012). Культивируемые представители двух основных филогрупп толстой кишки человека Faecalibacterium prausnitzii могут использовать для роста пектин, уроновые кислоты и субстраты, полученные от хозяина. Appl Environ Microbiol. https://doi.org/10.1128/aem.06858-11
Геверс Д., Кугатхасан С., Денсон Л., Васкес-Баеза, Ю., Ван Треурен, В., Рен, Б. (2014). Микробиом, ранее не получавший лечения, при впервые возникшей болезни Крона. Клеточный микроб-хозяин. https://doi.org/10.1016/j.chom.2014.02.005
Швирц, А., Якоби, М., Фрик, Дж., Рихтер, М., Руш, К., Келер, Х. (2010). Микробиота при воспалительных заболеваниях кишечника у детей. J Pediatr. https://doi.org/10.1016/j.jpeds.2010.02.046
Фудзимото, Т., Имаеда, Х., Такахаши, К., Касуми, Э., Бамба, С., Фудзияма, Ю. (2013). Снижение численности Faecalibacterium prausnitzii в кишечной микробиоте при болезни К. Рона. J Gastroenterol Hepatol. https://doi.org/10.1111/jgh.12073
Пирцер, У., Шёнхаар, А., Флейшер, Б., Герман, Э., Бюшенфельде, К. (1991). Реактивность инфильтрирующих Т-лимфоцитов микробными антигенами при болезни Крона. Lancet (Лондон, Англия). https://doi.org/10.1016/0140-6736(91)
-aМакферсон, А., Ху, У., Форгакс, И., Филпотт-Ховард, Дж., Бьярнасон, И. (1996). Антитела слизистой оболочки при воспалительном заболевании кишечника направлены против кишечных бактерий. Gut. https://doi.org/10.1136/gut.38.3.365
Браун, С., Майер, Л. (2007). Иммунный ответ при воспалительном заболевании кишечника. Am J Gastroenterol.
Харрингтон, Л., Хаттон, Р., Манган, П., Тернер, Х., Мерфи, Т., Мерфи, К. (2005). CD4 + эффекторные Т-клетки, продуцирующие интерлейкин 17, развиваются по клону, отличному от клонов Т-хелперов 1-го и 2-го типов. Nat Immunol. https://doi.org/10.1038/ni1254
Гюнтер, К., Мартини, Э., Витткопф, Н., Аманн, К., Вейгманн, Б., Нойман, Х. (2011). Каспаза-8 регулирует TNF-α-индуцированный эпителиальный некроптоз и терминальный илеит. Природа. https://doi.org/10.1038/nature10400
Perrier, C., De Hertogh, G., Cremer, J., Vermeire, S., Rutgeerts, P., Van Assche, G. (2013). Нейтрализация мембранного TNF, но не растворимого TNF, имеет решающее значение для лечения экспериментального колита. Воспаление кишечника. https://doi.org/10.1002/ibd.23023
Нейрат, М. (2019). Нацелены на цепи иммунных клеток и торговля воспалительными заболеваниями кишечника. Nat Immunol. https://doi.org/10.1038/s41590-019-0415-0
Ордас И., Фиган Б., Сандборн В. (2011). Раннее использование иммунодепрессантов или антагонистов TNF для лечения болезни Крона: время для перемен. Gut. https://doi.org/10.1136/gutjnl-2011-300934
Ханауэр, С., Фиган, Б., Лихтенштейн, Г., Майер, Л., Шрайбер, С., Коломбель, Дж. (2002). Поддерживающий инфликсимаб при болезни Крона: рандомизированное исследование ACCENT I. Ланцет. https://doi.org/10.1016/s0140-6736(02)08512-4
Сартор, Р., Ву, Г. (2017). Роль кишечных бактерий, вирусов и грибов в патогенезе воспалительных заболеваний кишечника и терапевтических подходах. Гастроэнтерология. https://doi.org/10.1053/j.gastro.2016.10.012
Бутто, Л., Халлер, Д. (2016). Дисбактериоз при воспалении кишечника: причина или следствие. Int J Med Microbiol.
Сартор, Р. (2010). Генетика и взаимодействие с окружающей средой формируют микробиом кишечника, способствуя воспалительному заболеванию кишечника по сравнению с гомеостазом слизистой оболочки. Гастроэнтерология. https://doi.org/10.1053/j.gastro.2010.10.036
Элинав, Э., Стровиг, Т., Кау, А., Энао-Мехиа, Дж., Тайсс, К., Бут, К. (2011). Инфламмасома NLRP6 регулирует микробную экологию толстой кишки и риск колита. Cell. https://doi.org/10.1016/j.cell.2011.04.022
Джионкетти, П., Риццелло, Ф., Вентури, А., Бриджиди, П., Маттеуцци, Д., Баззокки, Г. (2000). Пероральная бактериотерапия в качестве поддерживающей терапии у пациентов с хроническим поучитом: двойное слепое плацебо-контролируемое исследование. Гастроэнтерология. https://doi.org/10.1053/gast.2000.9370
Хаттенхауэр, К., Найт, Р., Браун, К., Капорасо, Дж., Клементе, Дж., Геверс, Д. (2014). Развитие сообщества исследователей микробиома. Cell.
Льюис, Дж., Чен, Э., Балдассано, Р., Отли, А., Гриффитс, А., Ли, Д. (2015). Воспаление, антибиотики и диета как факторы стресса окружающей среды кишечного микробиома при болезни Крона у детей. Клеточный микроб-хозяин. https://doi.org/10.1016/j.chom.2015.09.008
Патва, Л., Фан, Т., Чаптчет, С., Лю, Ю., Люсье, Ю., Сартор, Р. (2011). Хроническое воспаление кишечника вызывает гены стресс-реакции в комменсале Escherichia coli . Гастроэнтерология. https://doi.org/10.1053/j.gastro.2011.06.064
Ын, К., Мисима, Ю., Вольгемут, С., Лю, Б., Бауэр, М., Кэрролл, И. (2014). Индукция бактериального антиген-специфического колита упрощенным консорциумом микробиоты человека у мышей-гнотобиотиков интерлейкина-10 — / -. Infect Immun. https://doi.org/10.1128/iai.01513-13
Шеффлер, Х., Херлеманн, Д., Альбертс, К., Кашицки, А., Бодаммер, П., Баннерт, К. (2016). Сообщество прикрепленных к слизистой оболочке бактерий при болезни Крона согласуется с индексом клинической активности заболевания. Environ Microbiol Rep. Https://doi.org/10.1111/1758-2229.12411
Лаубиц, Д., Харрисон, К., Мидура-Кила, М., Рамалингам, Р., Лармонье, К., Чейз, Дж. (2016). Пониженный эпителиальный обмен Na + / H + вызывает микробный дисбиоз кишечника и способствует воспалительной реакции при Т-клеточном колите у мышей. PLoS One 2016. https://doi.org/10.1371/journal.pone.0152044
Чапчет, С., Фан, Т., Гезер, Л., Шенборн, А., Гулати, А., Сартор, Р.(2013). Вызванные воспалением гены кислотоустойчивости gadAB в просвете комменсала Escherichia coli ослабляют экспериментальный колит. Infection Immun. https://doi.org/10.1128/iai.00355-13
Дарфей-Мишо, А., Будо, Дж., Булуа, П., Нейт, К., Глассер, А., Барнич, Н. (2004). Высокая распространенность адгезивно-инвазивной Escherichia coli , связанной со слизистой оболочкой подвздошной кишки, при болезни Крона. Гастроэнтерология. https://doi.org/10.1053/j.гастро.2004.04.061
Лю Ю., ван Круининген, Х., Уэст, А., Картун, Р., Корто, А., Коломбел, Дж. (1995). Иммуноцитохимическое доказательство наличия Listeria , Escherichia coli и Streptococcus при болезни Крона. Гастроэнтерология. https://doi.org/10.1016/0016-5085(95)
Атрея, Р., Нейрат, М. (2017). Текущие и будущие цели для заживления слизистой оболочки при воспалительном заболевании кишечника. Visceral Med. https://doi.org/10.1159/000458006
Хансен, Дж., Сартор, Р. (2015). Терапевтические манипуляции с микробиомом при ВЗК: текущие результаты и будущие подходы. Варианты лечения Curr Гастроэнтерол. https://doi.org/10.1007/s11938-014-0042-7
Cénit, M., Matzaraki, V., Tigchelaar, E., Zhernakova, A. (2014). Быстро расширяющиеся знания о роли кишечного микробиома в здоровье и болезнях. Biochim Biophys Acta.https://doi.org/10.1016/j.bbadis.2014.05.023
Касер, А., Цейссиг, С., Блумберг, Р. (2010). Воспалительное заболевание кишечника. Annu Rev Immunol. https://doi.org/10.1146/annurev-immunol-030409-101225
Шрайбер, С., Дигнасс, А., Пейрин-Бируле, Л., Хазер, Г., Демут, Д., Мосли, М. (2018). Систематический обзор с метаанализом: Реальная эффективность и безопасность ведолизумаба у пациентов с воспалительным заболеванием кишечника. J Гастроэнтерол.https://doi.org/10.1007/s00535-018-1480-0
Мосли, М., Ривера-Ньевес, Дж., Фиган, Б. (2014). Перенос Т-клеток и стратегии борьбы с адгезией при воспалительном заболевании кишечника: текущие и будущие перспективы. Наркотики. https://doi.org/10.1007/s40265-013-0176-2
Рутгеертс, П., Ван Аше, Г., Сандборн, В., Вольф, Д., Гебоэс, К., Коломбел, Дж. (2012). Адалимумаб вызывает и поддерживает заживление слизистых оболочек у пациентов с болезнью Крона: данные исследования EXTEND. Гастроэнтерология. https://doi.org/10.1053/j.gastro.2012.01.035
Д’Хэнс, Г., Сандборн, В., Фиган, Б., Гебоес, К., Ханауэр, С., Ирвин, Э. (2007). Обзор показателей активности и конечных точек эффективности для клинических испытаний медикаментозной терапии у взрослых с язвенным колитом. Гастроэнтерология. https://doi.org/10.1053/j.gastro.2006.12.038
Квапис, Л., Мосли, М., Чанд, Н., Ян, Б., Битон, М., Микско, Дж. (2015). Экспресс-анализ фекального кальпротектина для оценки активности эндоскопического заболевания при воспалительном заболевании кишечника: диагностическое когортное исследование. Саудовская Дж. Гастроэнтерол. https://doi.org/10.4103/1319-3767.170948
Маламут, Г., Афчайн, П., Веркар, В., Леконт, Т., Амиот, А., Дамот, Д. (2009). Представление и долгосрочное наблюдение рефрактерной целиакии: сравнение типа I с типом II. Гастроэнтерология. https://doi.org/10.1053/j.gastro.2008.09.069
Мосли, М., Фиган, Б., Сандборн, В., Д’Хэнс, Г., Белинг, К., Каплан, К. (2014). Гистологическая оценка язвенного колита: систематический обзор индексов активности болезни. Воспаление кишечника. https://doi.org/10.1097/01.mib.0000437986.00190.71
Мосли, М., Фиган, Б., Цзоу, Г., Сандборн, В., Д’Хэнс, Г., Ханна, Р. (2015). Воспроизводимость гистологических оценок активности болезни при ЯК. Gut. https://doi.org/10.1136/gutjnl-2014-307536
Джайрат В., Пейрин-Бируле Л., Зоу Г., Мосли М., Кастил Н., Пай Р. (2019). Чувствительность гистологических индексов активности заболевания при язвенном колите: апостериорный анализ с использованием данных рандомизированного контролируемого исследования TOUCHSTONE. Gut. https://doi.org/10.1136/gutjnl-2018-316702
Бреннан, Ф., Майни, Р., Фельдманн, М. (1992). TNFa — основная роль в ревматоидном артрите ?. Ревматология. https://doi.org/10.1093/rheumatology/31.5.293
Йошихара, Т., Шинзаки, С., Кавай, С., Фуджи, Х., Иватани, С., Ямагути, Т. (2017). Концентрации препаратов противоопухолевого фактора некроза опухолей в тканях связаны с долгосрочным исходом у пациентов с болезнью Крона. Воспаление кишечника. https://doi.org/10.1097/mib.0000000000001260
Поджи, А., Бенелли, Р., Вене, Р., Коста, Д., Феррари, Н., Тозетти, Ф. (2019). Человеческие естественные клетки-киллеры, ассоциированные с кишечником, в состоянии здоровья и болезней. Front Immunol. https://doi.org/10.3389/fimmu.2019.00961
Коломбел, Дж., Рутгертс, П., Райниш, В., Эссер, Д., Ван, Ю., Ланг, Ю. (2011). Раннее заживление слизистых оболочек инфликсимабом связано с улучшением отдаленных клинических исходов при язвенном колите. Гастроэнтерология. https://doi.org/10.1053/j.gastro.2011.06.054
Коломбел, Дж., Сандборн, В., Райниш, В., Манцарис, Г., Корнблут, А., Рахмилевиц, Д. (2010). Инфликсимаб, азатиоприн или комбинированная терапия болезни Крона. N Engl J Med. https://doi.org/10.1056/nejmoa0
Атрея, Р., Циммер, М., Барч, Б., Вальднер, М., Атрея, И., Нойман, Х. (2011). Антитела против фактора некроза опухоли (TNF) вызывают апоптоз Т-клеток у пациентов с воспалительными заболеваниями кишечника через рецептор TNF 2 и кишечные макрофаги CD14 (+). Гастроэнтерология. https://doi.org/10.1053/j.gastro.2011.08.032
Рутгертс, П., Сандборн, В., Фиган, Б., Рейниш, В., Олсон, А., Йоханнс, Дж. (2005). Инфликсимаб для индукционной и поддерживающей терапии язвенного колита. N Engl J Med. https://doi.org/10.1056/nejmoa050516
Сандборн, В., Коломбел, Дж., Д’Хэнс, Г., Ван Аше, Г., Вольф, Д., Крон, М. (2013). Годовые результаты поддерживающей терапии среди пациентов с активным язвенным колитом средней и тяжелой степени, которые ответили на индукционную терапию адалимумабом: анализ подгрупп из ULTRA 2. Aliment Pharmacol Ther. https://doi.org/10.1111/apt.12145
Магнуссон, М., Стрид, Х., Сапнара, М., Лассон, А., Баджор, А., Унг, К. (2016). Ответ на терапию анти-TNF у пациентов с язвенным колитом связан с экспрессией антимикробного пептида толстой кишки и составом микробиоты. J Crohns Colitis. https://doi.org/10.1093/ecco-jcc/jjw051
Варела, Э., Маничан, К., Галларт, М., Торрехон, А., Борруэль, Н., Каселлас, Ф.(2013). Колонизация Faecalibacterium prausnitzii и поддержание клинической ремиссии у пациентов с язвенным колитом. Aliment Pharmacol Ther. https://doi.org/10.1111/apt.12365
Ли Д., Ю. Г., Ху, Х., Ли, X., Ван, Ю., Сяо, Ю. (2017). Характеристики фекальной микробиоты при болезни Крона у детей и их динамические изменения во время терапии инфликсимабом. J Crohns Colitis. https://doi.org/10.1093/ecco-jcc/jjx153
Бен-Хорин, С., Мао, Р., Чен, М. (2015). Оптимизация биологического лечения ВЗК: объективные меры, но когда, как и как часто ?. БМК Гастроэнтерол. https://doi.org/10.1186/s12876-015-0408-x
Нокс, Н., Форбс, Дж., Ван Домселаар, Г., Бернштейн, К. (2019). Микробиом кишечника как мишень для лечения ВЗК: мы еще не достигли цели ?. Curr Treat Options Гастроэнтерол. https://doi.org/10.1007/s11938-019-00221-w
Биндлосс, М., Ольсан, Э., Ривера-Чавес, Ф., Тиффани, К., Севаллос, С., Локкен, К. (2017). Активированная микробиотой передача сигналов PPAR-g ингибирует распространение дисбиотика Enterobacteriaceae . Наука. https://doi.org/10.1126/science.aam9949
Литвак Ю., Биндлосс М., Цолис Р., Боймлер А. (2017). Дисбиотик Протеобактерии Расширение: микробный признак эпителиальной дисфункции. Curr Opin Microbiol. https://doi.org/10.1016/j.mib.2017.07.003
Шоу, К., Берта, М., Хофмеклер, Т., Чопра, П., Ватанен, Т., Шриватса, А. (2016). Дисбиоз, воспаление и реакция на лечение: продольное исследование педиатрических субъектов с впервые диагностированным воспалительным заболеванием кишечника. Genome Med. https://doi.org/10.1186/s13073-016-0331-y
Махильс, К., Сабино, Дж., Вандермостен, Л., Йооссенс, М., Арийс, И., де Брюн, М. (2017). Конкретные представители преобладающей кишечной микробиоты предсказывают поучит после колэктомии и IPAA при ЯК. Gut. https://doi.org/10.1136/gutjnl-2015-309398
Райка, С., Грондин, В., Луи, Э., Вернье-Массуй, Ж., Гримо, Ж., Бухник, Ю. (2014). Изменения микробиома кишечника (дисбиоз) как предиктор рецидива после отмены инфликсимаба при болезни Крона. Воспаление кишечника. https://doi.org/10.1097/mib.0000000000000036
Мустафа, А., Ли, В., Андерсон, Э., Вонг, Э., Дулай, П., Сандборн, В. (2018). Генетический риск, дисбактериоз и стратификация лечения с использованием генома хозяина и микробиома кишечника при воспалительном заболевании кишечника. Клин Транс Гастроэнтерол. https://doi.org/10.1038/ctg.2017.58
Имханн, Ф., Вич Вила, А., Бондер, М., Фу, Дж., Геверс, Д., Висчедейк, М. (2018). Взаимодействие генетики хозяина и микробиоты кишечника, лежащее в основе возникновения и клинических проявлений воспалительного заболевания кишечника. Gut. https://doi.org/10.1136/gutjnl-2016-312135
Шредер Б., Бэкхед Ф. (2016). Сигналы от микробиоты кишечника к отдаленным органам в физиологии и болезнях. Nat Med. https://doi.org/10.1038/nm.4185
Гинан, К., Коттер, П. (2013). Роль микробиоты кишечника в здоровье и хронических желудочно-кишечных заболеваниях: понимание скрытого метаболического органа. Ther Adv Gastroenterol. https://doi.org/10.1177/1756283×13482996
Макилрой, Дж., Яниро, Дж., Мукхопадхья, И., Хансен, Р., Холд, Г. (2018). Обзорная статья: Микробиом кишечника при воспалительных заболеваниях кишечника — способы борьбы с микробами. Aliment Pharmacol Ther. https://doi.org/10.1111/apt.14384
Рехман, А., Рауш, П., Ван, Дж., Скечевичене, Дж., Киуделис, Г., Бхагалия, К. (2016). Географические закономерности постоянного и активного микробиома кишечника человека при здоровье и ВЗК. Gut. https://doi.org/10.1136/gutjnl-2014-308341
Шенк, М., Бушон, А., Биррер, С., Колонна, М., Мюллер, К. (2005). Макрофаги, экспрессирующие запускающий рецептор, экспрессируемые на миелоидных клетках-1, недостаточно представлены в кишечнике человека. J Immunol. https://doi.org/10.4049/jimmunol.174.1.517
Алипур, М., Заиди, Д., Валчева, Р., Ховель, Дж., Мартинес, И., Серги, К. (2015). Истощение слизистого барьера и потеря разнообразия бактерий являются первичными аномалиями при язвенном колите у детей. J Crohns Colitis. https://doi.org/10.1093/ecco-jcc/jjv223
Шах, Р., Коуп, Дж., Надь-Сакаль, Д., Дауд, С., Версалович, Дж., Холлистер, Э. (2016). Состав и функция микробиома слизистой оболочки толстой кишки у детей, не получавших лечения, с язвенным колитом. Кишечные микробы. https://doi.org/10.1080/194
.2016.11Айва, К., Иджаз, У., Ломан, Н., Эрен, А., Сольнье, Д., Рассел, Дж. (2015). Обширная модуляция фекального метагенома у детей с болезнью Крона при исключительном энтеральном питании. Am J Gastroenterol. https://doi.org/10.1038/ajg.2015.357
Райилич-Стоянович, М., Шанахан, Ф., Гварнер, Ф., де Вос, В. (2013). Филогенетический анализ дисбактериоза при язвенном колите в период ремиссии. Воспаление кишечника. https://doi.org/10.1097/mib.0b013e31827fec6d
Каакуш Н., Дэй А., Хуйнао К., Лич С., Лемберг Д., Дауд С. (2012). Микробный дисбактериоз у детей с болезнью Крона. J Clin Microbiol. https://doi.org/10.1128/jcm.01396-12
Морган, X., Щекотка, Т., Сокол, Х., Геверс, Д., Девани, К., Уорд, Д. (2012). Дисфункция кишечного микробиома при воспалительном заболевании кишечника и лечение. Genome Biol. https://doi.org/10.1186/gb-2012-13-9-r79
Демографические характеристики больных. | Скачать таблицу
Биопленки — это сообщества микроорганизмов, прикрепленных к поверхности, с особыми свойствами, которые оказывают огромное влияние на наше здоровье и безопасность пищевых продуктов. Исследование было направлено на выявление образования биопленок и устойчивости к антибиотикам Klebsiella oxytoca и Klebsiella pneumoniae из продуктов животного происхождения. В этом исследовании 100 образцов пищевых продуктов были исследованы на наличие Klebsiella oxytoca, Klebsiella pneumoniae и других членов семейства Enterobacteriaceae.В этом исследовании 19 изолятов Klebsiella oxytoca и 5 Klebsiella pneumoniae были выделены из образцов сыра и мясного фарша с использованием стандартных биохимических тестов и идентификационного набора. Образование биопленок в этих изолятах было обнаружено с помощью микропланшетов, конго красного агара и методов прикрепления пробирок. Тестирование чувствительности к антибиотикам проводили методом дисковой диффузии на агаре Мюллера-Хинтона. При использовании метода микропланшетов сильное образование биопленок наблюдалось у 16 (84%) и 5 (100%) изолятов Klebsiella oxytoca и Klebsiella pneumoniae после 24 часов инкубации на среде триптического соевого бульона, содержащей 2% глюкозы, соответственно.После 24 и 48 часов инкубации в триптическом соевом бульоне без глюкозы образование сильной биопленки было обнаружено в 10 (52,6%) и 2 (40%) изолятах Klebsiella oxytoca и Klebsiella pneumoniae соответственно. После 24 часов инкубации на красном агаре Конго 14 (73,7%) и 3 (60%) изоляты Klebsiella oxytoca и Klebsiella pneumoniae были положительными по фактору слизи соответственно. В методе прикрепления пробирки 13 (68,4%) и 4 (80%) было замечено, что изоляты Klebsiella oxytoca и Klebsiella pneumoniae прочно прилипли после 24 часов инкубации на среде триптического соевого бульона, содержащей 2% глюкозы.В целом, сильное образование биопленок этими штаммами наблюдалось на среде триптического соевого бульона при добавлении глюкозы. Среди всех Klebsiella oxytoca самые высокие показатели восприимчивости наблюдались к триметоприм-сульфаметоксазолу (100%) и имипенему (94,7%), за которым следовали хлорамфеникол (73,7%) и гентамицин (68,4%). Среди 19 изолятов Klebsiella oxytoca самые высокие показатели устойчивости были отмечены к стрептомицину (73,7%) и канамицину (73,7%), за которым следует ампициллин (63,2%). Большинство изолятов Klebsiella pneumoniae были устойчивы к канамицину (80%) и стрептомицину (80%), а затем к амикацину (60%).С другой стороны, 80% Klebsiella pneumoniae были чувствительны к имипенему, хлорамфениколу, триметоприм-сульфаметоксазолу и цефотаксиму. Как правило, большинство изолятов Klebsiella oxytoca и Klebsiella pneumoniae демонстрировали сильное образование биопленок в различных условиях роста, и большинство изолятов также обладали устойчивостью к антибиотикам. Следовательно, производство биопленки этими внутрибольничными бактериями имеет значение для общественного здравоохранения и открывает путь к повышенной устойчивости организмов, связанных с биопленкой, к антимикробным агентам.
Дисбактериоз
Дисбактериоз
- Бактериофаги применяются для профилактики и лечения дисбактериоза (дисбактериоза) кишечного тракта.
- Бактериофаги применяют перорально и ректально (в клизмах).
- Бактериофаги применяются при полирезистентности бактерий-возбудителей к антибиотикам.
- Бактериофаги применяются для лечения пациентов с непереносимостью антибиотиков или противопоказаниями к их применению.
- Бактериофаги можно применять в сочетании с пробиотиками, пребиотиками и антимикробными препаратами.
- Бактериофаги используются для профилактики дисбактериоза в группах риска: у пациентов, принимающих антибиотики, детей с РРИ, пациентов с аллергией, пациентов с нарушенным иммунитетом, при неправильном кормлении и т. Д.
Стабильный состав микрофлоры кишечника играет важную роль в здоровье человека. Нормальная микрофлора кишечника выполняет ряд функций: защищает организм от болезнетворных микробов, нейтрализует токсины, стимулирует иммунную систему, участвует в процессе пищеварения, обеспечивает синтез и всасывание ряда витаминов и минералов, регулирует перистальтику кишечника. , нормализует перистальтику, регулирует аппетит и др.
Помимо полезных бактерий, кишечник населен условно-патогенными микроорганизмами, которые незаметны для здоровых людей, но если защитные силы организма не срабатывают, эти организмы могут начать размножаться. Это вызывает нарушение пищеварения, развитие общей интоксикации, в конечном итоге — воспаление слизистой оболочки кишечника. Состояние, при котором в кишечнике преобладают условно-патогенные микроорганизмы, называется дисбактериозом (дисбактериозом).
Дисбактериоз может развиться в результате приема антибиотиков, кишечных инфекций, заболеваний пищеварительной системы (гастрит, язвенная болезнь, панкреатит), низкого потребления пищевых волокон, сбоя защитных сил организма. С одной стороны, микрофлора участвует в развитии заболеваний пищеварительной системы, с другой — любые неблагоприятные изменения в организме приводят к изменению состава и свойств микрофлоры.
При дисбактериозе человек может страдать от вздутия живота и болей в животе, неприятного запаха изо рта, диареи или, наоборот, запора, может быть общее беспокойство, потеря аппетита, головная боль и начало аллергии.
Для коррекции дисбиотических нарушений в кишечнике обычно назначают пробиотические препараты, содержащие живые культуры лакто- и бифид-бактерий — обычных обитателей кишечника. Однако этого может быть недостаточно для лечения хронического и особенно длительного дисбактериоза. Для устранения условно-патогенной микрофлоры целесообразно использовать соответствующие бактериофаги. Фагопродукты очень специфичны — они убивают только определенные бактерии и не влияют на полезную микрофлору.Кроме того, риск развития резистентности патогенных бактерий к продуктам этого типа минимален. В связи с высокой степенью безопасности Pyophage® разрешен к применению у детей (см. Инструкцию). Использование бактериофагов стимулирует специфические и неспецифические факторы иммунитета, что особенно эффективно при лечении хронических воспалительных заболеваний на фоне иммунодепрессий.
Препараты Интестифаг® или Пиофаг® при дисбактериозе вводятся перорально и ректально.Препарат применяют внутрь в соответствии с возрастной дозой 3 раза в день за 1 час до еды в течение 7-20 дней. Также возможно применение препарата ректально в виде клизм — согласно возрастной дозе 1 раз в сутки после дефекации вместо 1 приема внутрь.
В профилактических целях бактериофаг назначают внутрь в соответствии с возрастной дозой 1 раз в день за 1 час до еды. Продолжительность курса зависит от эпидемической ситуации.
- Возрастные дозы препарата указаны в Инструкциях по медицинскому применению лекарственных средств Пиофаг® и Интестифаг®.
- Полная информация о продуктах содержится в инструкции по медицинскому применению.
- Перед применением прочтите Инструкцию по медицинскому применению лекарственных средств Пиофаг® и Интестифаг®.
Скачать инструкцию по медицинскому применению лекарственного препарата Пиофаг®
Скачать Инструкцию по медицинскому применению лекарственного препарата Интестифаг®
Пиофаг® Р.С. № UA / 15974/01/01. Утверждено приказом Минздрава Украины № 478 от 28.04.2017.
Intestifag® Р.С. № UA / 15970/01/01. Утверждено приказом Минздрава Украины № 478 от 28.

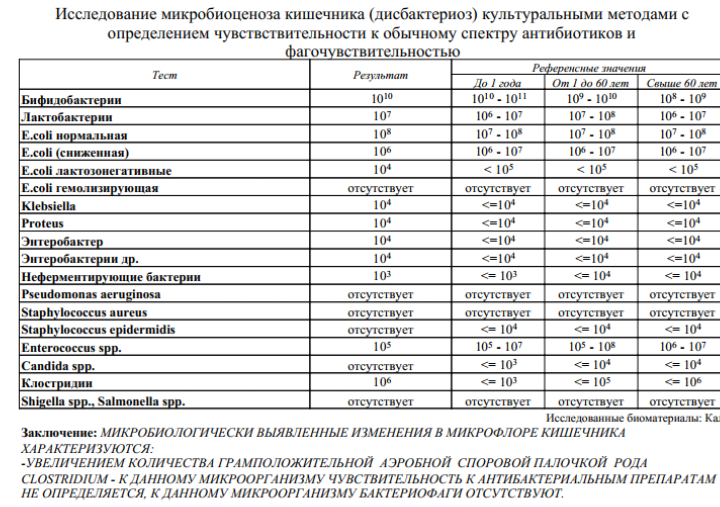
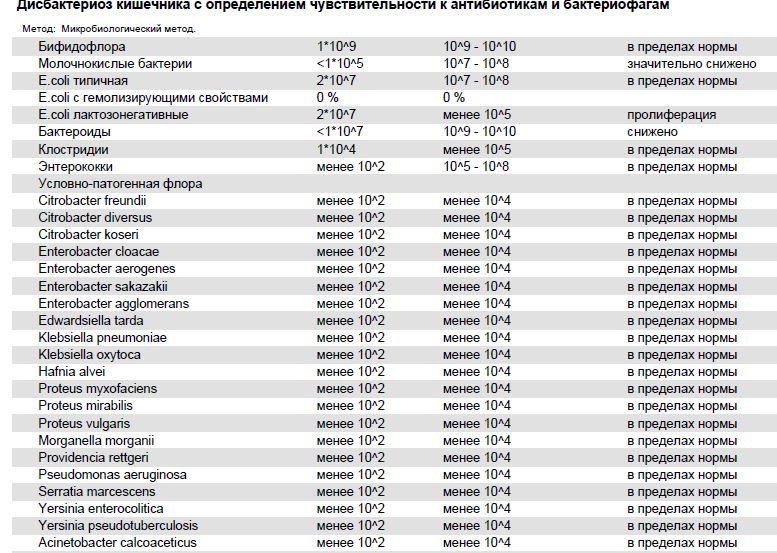
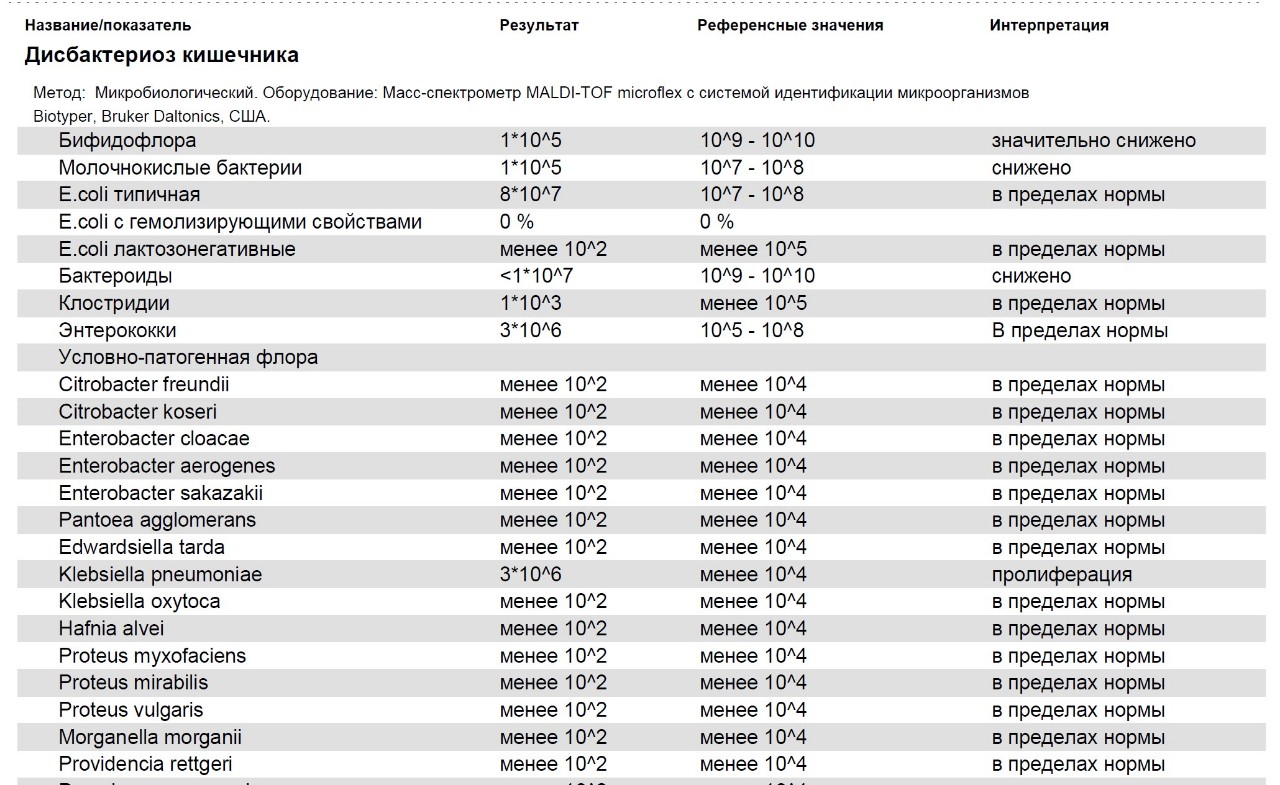 Вы не найдете указаний на необходимость этого исследования ни в руководстве WGO по синдрому раздраженного кишечника, ни в рекомендациях ACG (Американской коллегии гастроэнтерологов) по острой диарее, ни в стандарте AAFP (Американской ассоциации семейных врачей) по наблюдению новорожденных с коликами. Ну и, естественно, никакого диагноза «дисбактериоз» нет ни в Международной классификации болезней, ни в хотя бы одном (!) нерусскоязычном учебнике.
Вы не найдете указаний на необходимость этого исследования ни в руководстве WGO по синдрому раздраженного кишечника, ни в рекомендациях ACG (Американской коллегии гастроэнтерологов) по острой диарее, ни в стандарте AAFP (Американской ассоциации семейных врачей) по наблюдению новорожденных с коликами. Ну и, естественно, никакого диагноза «дисбактериоз» нет ни в Международной классификации болезней, ни в хотя бы одном (!) нерусскоязычном учебнике. 8 в грамме стула. Ссылок на литературу в стандарте полно, но, что подозрительно, среди них нет ни одной зарубежной публикации. Ну а сами статьи и учебники не описывают, как именно сравнивали микрофлору здоровых и больных людей, то есть как именно был сделан вывод о нормальном содержании той или иной бактерии.
8 в грамме стула. Ссылок на литературу в стандарте полно, но, что подозрительно, среди них нет ни одной зарубежной публикации. Ну а сами статьи и учебники не описывают, как именно сравнивали микрофлору здоровых и больных людей, то есть как именно был сделан вывод о нормальном содержании той или иной бактерии.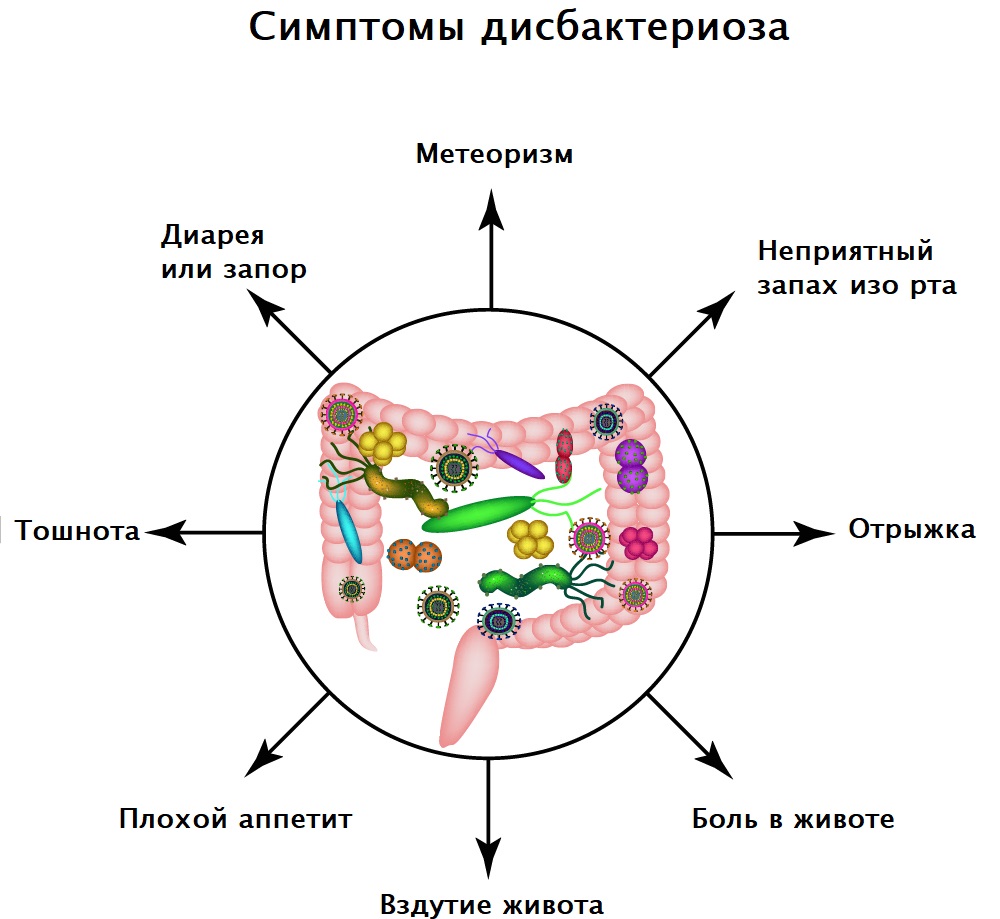
 А значит, не должен и пытаться это сделать.
А значит, не должен и пытаться это сделать.